8 сынып. Күні:
Сабақтың тақырыбы: Қышқылдардың жіктелуі, алынуы, химиялық қасиеттері.
Сабақтың мақсаты: 1. Оқушылардың қышқылдар, күрделі заттар, оксидтер жөніндегі білімдерін жүйелеп, тереңдете отырып, қышқылдардың металдармен, металл оксидтерімен әрекеттесуін, жіктеуін, алынуын түсіндіру.
2.Оқушылардың пәнге деген қызығушылықтарын, ойлау, есте сақтау қабілеттерін жетілдіру, химиялық формула, теңдеу құру, есеп шығару біліктерін дамыту.
3. Оқушыларды белсенділікке, іскерлікке, жауапкершілікке, ұйымшылдыққа, ізденімпаздыққа тәрбиелеу.
Сабақтың түрі: аралас сабақ.
Сабақтың әдісі: сатылай комплексті талдау.
Керекті құралдары:
Сабақтың барысы:
1. Ұйымдастыру кезеңі.
оқушылармен сәлемдесу;
оқушыларды түгендеу;
оқушылар назарын сабақ барысында білім алуға бағыттап,
бірыңғай талап қою.
2. Үй тапсырмасын тексыру.
Сұрақ – жауап, 2 – 3 оқушыға есептер беру арқылы.
а) негіздердің жіктелуі, мысалдар келтір?
ә) негіздердің химиялық қасиеттері?
№ 7. 28 х
2Li + 2Н2О 2LiОН + Н2
14 22,4
х = 28*22,4 / 14 =44,8 л.
№ 8. Массасы 4,6 г натрийді 150 г суда еріту арқылы алынған натрий гидроксидінің массалық үлесі ?
Берілгені: Шешуі:
m(Na)=4,6 г. W = m(зат)/m(ер)*100 = 4,6 / 154,6 * 100 = 3%
m(H2O)=150 г.
т/ кW (NaOH) =? Жауабы: W (NaOH) = 3%
№ 9. СаСО3; Н2О.
СаСО3 —› СаО + СО2
СаО + Н2О —› Са(ОН)2
СО2 + Н2О —› Н2СО3
Са(ОН)2 + СО2 —› СаСО3 + Н2О
№ 10.
Берілгені: Шешуі:
m(NaOH) = 20 20 х
т/к m(Na2CO3) =? 2NaOH + CO2 = Na2CO3 + H2O x1 = 26,5
m(NaCl)=? 80 106
V(CO2)=?
26,5 x x
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
106 117 22,4
х2 (Na2CO3) =29,25г.
x3 V(CO2) = 5,6 л.
3. Жаңа сабақты түсіндіру.
Тақтада схема жазылып, шығарылады.
Қышқылдар.



1.Анықтама
2.Жіктелуі
3.Құрылымдық формуласы
4.Алынуы
5.Қасиеттері (физикалық, химиялық)
6.Маңызы (зияны, пайдасы)
7. Қорытынды.
Оқушыларға тапсырма беру.
№ 1. Мына қосылыстар ішінен қышқылдарды тауып, атаңыз.
HCl, KOH, MgO, CaCl2, CO2, HBr, H2SO4, Ba(OH)2, H3PO4, HNO3
HCl – тұз қышқылы, H2SO4 – күкірт қышқылы,
HBr – бромсутек, H3PO4 – фосфор қышқылы
HNO3 – азот қышқылы.
1.Қышқылдыр – сутек атомынан және қышқыл қалдығынан құралған күрделі заттар.
2.Жіктелуі Қышқылдар
Оттекті, себебі құрамында Оттексіз, себебі құрамында
оттек атомы бар оттек атомы жоқ
HNO3 – бірнегізді HCl – бірнегізді
H2SO4 – екінегізді H2S – екінегізді
H3PO4 – үшнегізді
3. Құрылымдық формула. (Оқушыларға тапсырма ретінде беру).
H3PO4, H2SO4, HCl, Н2СО3
Н – О
– О
Н – О – Р = О
– О – Р = О
Н – О
4. Алынуы. а) қышқылдық оксидтер сумен әрекеттескенде:
Р2О5 + 3Н2О 2H3PO4
SO3 + Н2О H2SO4
ә) сутекті бейметалдармен әрекеттестіргенде:
Н2 + Cl2 2HCl
5. Қасиеттері: а) физикалық - H2SO4 , HNO3 - сұйық, H3PO4 – қатты күйде болады, суда жақсы ериді, күйдіргіш.
Ca(OH)2 + HNO3 Ca(NO3)2 + 2Н2О
Mg + 2HCl MgCl2 + H2
Na2CO3 + 2HCl 2NaCl + Н2О + CO2
FeO + 2HCl FeCl2 + Н2О
6. Маңызы: зияны – қоршаған ортаны ластайды, себебі олар тотықтырғыштар.
пайдасы - қышқылдар химия өнеркәсібінің негізгі шикізаты.
7. Қорытынды – қышқылдар – маңызды күрделі бейорганикалық қосылыстар.
4. Жаңа сабақты бекіту.
№ 4.
H3PO4 + 3КОН К3РО4 + 3Н2О
H2SO4 + NaОН Na2SO4 + 2Н2О
HCl + NaОН NaCl + Н2О
№ 6.
Ag + H2SO4
2Al(OH)3 + 3H2SO4 Al2(SO4)3 + 6Н2О
Fe(OH)2 + H2SO4 FeSO4 + 2Н2О
Cu + H2SO4
Cu(OH)2 + H2SO4 CuSO4 + 2Н2О
CuO + H2SO4 CuSO4 + Н2О
№ 9. 12,6 г x
Na2SO3 + 2HCl 2NaCl + H2SO3 х =0,2 моль
126 2 моль
5. Жаңа сабақты қорытындылау.
1) Қышқылдар қалай жіктеледі?
2) Қышқылдар қалай алынады?
3) Қышқылдармен жұмыс істегендегі қауіпсіздік ережесі?
6. Үйге тапсырма беру.
§ 47. № 5, 7, 10
7. Оқушылар білімін бағалау.



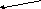
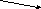
 – О
– О  – О – Р = О
– О – Р = О















