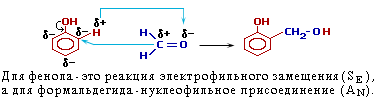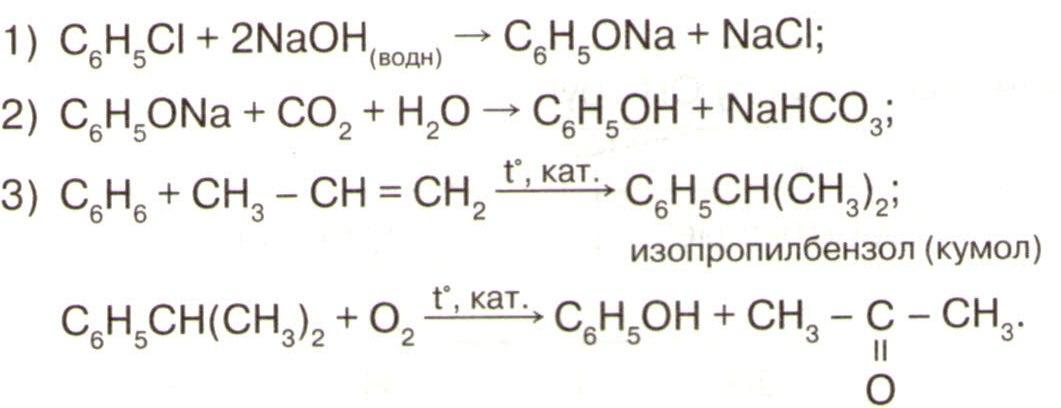систематизация органических соединений начиная с предельных углеводородов заканчивая эфирами. строение, типы гибридизации, химические свойства, получение В пособии изложены основные теоретические положения и фактический материал курса органической химии, рассмотрено строение органических соединений, их классификация, способы получения, основные физические и химические свойства. Предназначено для учащихся 10-11 классов, изучающих дисциплину " органическая Химия".
Просмотр содержимого документа
«Систематика органических соединений »
предельные
непредельные
Алканы
Циклоалканы
Алкены
этиленовые
Диеновые
Алкины
ацетиленовые
Ароматические
бензол
Общая формула
C n H 2n+2
C n H 2n
C n H 2n
C n H 2n-2
C n H 2n-2
C n H 2n -6
название
ан
цикло
ен
диен
Ин
отличительный признак,
строение УВ
−
Замкнутая цепь
=
= =
≡
вид гибридизации
SP 3
SP 3
SP 2
SP 2
SP
SP 2
характеристика
химической связи
109 0 28'
0, 154 нм
154 нм
0
1 3 4 нм
1 20 0
1 3 4 нм
1 80 0
1 20 нм
1 20 0
1 40нм
изомеры для n =5, названия
По углеводородному скелету
По углеводородному скелету
межклассовая изомерия
( с алкенами)
1.Изомерия по углеводородному скелету.
2. По положению кратной связи.
3. Межклассовая изомерия
( с циклоалканами)
3. Пространственная изомерия ( цис и транс изомеры)
1.Изомерия по углеводородному скелету.
2. По положению кратной связи.
3. Межклассовая изомерия
( с алк ин ами)
1.Изомерия по углеводородному скелету.
2. По положению кратной связи.
3. Межклассовая изомерия
( с диеновыми)
1.Изомерия по углеводородному скелету.
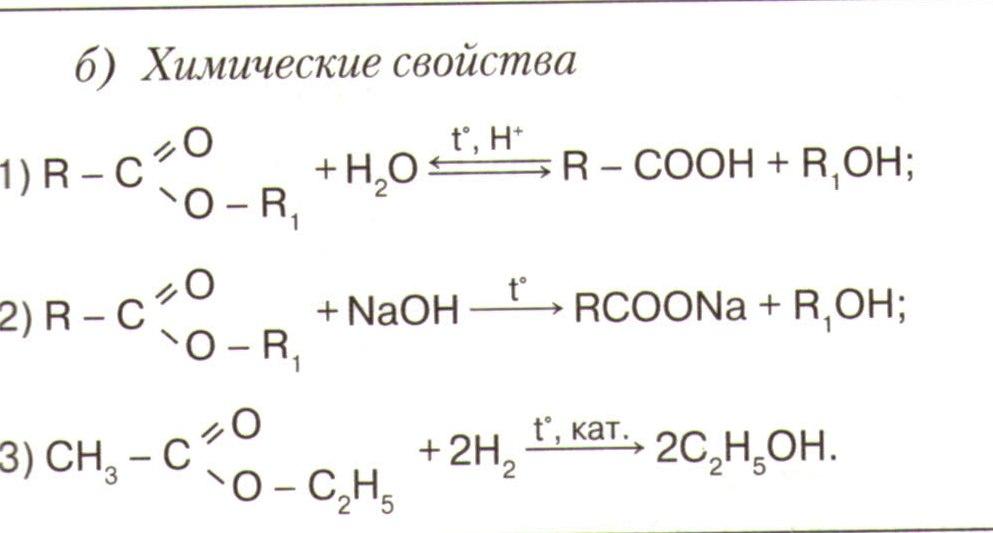
Химические свойства
1
Н 2 С
.Горят CH 4 +2О 2 → СО 2 +2Н 2 О
2
Н 2 С
. вступают в реакцию замещения
3. Реакции дегидрирования:
2СН 4 150 ?° С ' С 2 Н 2 + ЗН 2
4. В присутствии катализаторов окисляются
5. разложения СН 4 С+2Н 2
6. начиная с бутана изомеризуются
СН 3 — СН 2 —СН 2 — СН 3
СН 2 —СН—СН 3 ,
│
СН 3
СН 2
+О 2
горят горя
СН 2
→ СО 2 +Н 2 О
Вступают в реакцию присоединения
С 4 Н 8 +Н 2 С 4 Н 10
С 4 Н 8 + Br 2 С 4 Н 8 Br 2
1. горение ,
С 2 Н 4 + 3О 2 →2СО 2 +2Н 2 О
2. присоединения :
а) Н 2
СН 2= СН 2 + Н 2 → СН 3– СН 3
б) галогенами( Br 2 , С l 2 , I 2 )
СН 2 =СН 2 + Br 2 → СН 2 Br –СН 2 Br в) галогеноводородами
СН 2 =СН 2 + HBr →СН 3 -СН 2 Br
г) водой
СН 2 = СН 2 +H 2 O→ СН 3 - СН 2 OH
этанол
3. полимеризации
4. окисление с КМ п О 4
СН 2= СН 2 + [ O ] + H 2 O → CH 2– CH 2 ( этиленгликоль)
l l
OH OH
5.Реакция дегидрирования :
СН 2 =СН 2 → СН≡СН+Н 2
Горят
2С4 Н6 +11О2 →8СО 2 +6Н 2 О
2. присоединения :
а) Н 2
CH3 –СH =CH–CH3
CH3 –СH2 −CH2 –CH3
б ) галогенами Br 2 , С l 2 , I 2 )
→CH 2 Br –С HBr − CHBr - CH 2 Br
в)галогеноводородами
CH 2 Br– С H =CH–CH 3
CH 2 Br– С H Br-CH 2 -CH 3
г ) водой
3. полимеризации
n CH 2 =CH−CH=CH 2
(−CH2 –СH =CH–CH2 −)n
Алкины
1. горение ,
2С 2 Н 2 +5O 2 →4СO 2 +2Н 2 О;
2. присоединения :
а) Н 2
HCCH+H2 → H2 C=CH2
H2 C=CH2 +H2 → H3 C-CH3
б ) галогенами
HCCH+Br2 →HCBr=CHBr HCBr=CHBr +Br2 → HCBr2 CBr2 H
в)галогеноводородами
HCCH+HBr→H2 C=CHBr
H2 C=CHBr +HBr → H3 C−CBr2
г) водой
3 . полимеризации
3 Н C CH →С 6 H 6
Н C CH + Н C CH → Н 2 C=CH C CH
4. окисление с КМ п О 4 3 C 2 H 2 +8 KMnO 4 +4 H 2 O →8 KOH
+3HOOC-COOH + 8MnO 2
Ароматические углеводороды Бензол
1 . горение
2С 6 Н 6 + 15О 2 12СО 2 + 6Н 2 О
2. присоединения :
а) Н 2
С 6 Н 6 2 → С 6 Н 12
б) галогенами
С 6 Н 6 2 → С 6 Н 6 6
3. замещения :
а) галогенами, С 6 Н 6 2 → С 6 Н 5
б) азотной кислотой
С 6 Н 6 3 → С 6 Н 5 NO 2 +H2 O
4. окисление с КМ п О 4
( для толуола )
С 6 Н 5 CH 3 2 O+ КМп О4
С 6 Н 5 COOH + 8MnO 2 + KOH
Получение
В промышленности алканы выделяют из продуктов переработки нефти и попутных нефтяных газов
В лаборатории:
а) метан получают при нагревании прокаленного ацетата натрия с твердым гидроксидом натрия СН 3 СОО Na + Na ОН→СН 4 ↑+ Na 2 СО 3
б) этан и другие алканы с более длинной углеродной цепью получают взаимодействием галогенопроизводных алканов с активными металлами
2СН 3 -СН 2 - Cl +2 Na → C 4 H 10 +2 NaCI
Из алканов:
С2 Н6 → СН 2 =СН 2 +Н 2
Из спиртов:
С2 Н5 ОН →СН 2 =СН 2 2 О
Из галогенопроизводных алканов:
СН2 Br−СН2 Br+Zn→ CH2 =CH2 +ZnBr2
Дегидрированием и дегидратацией этилового спирта при пропускании паров спирта
450º С ;ZnO,Al 2 O 3
2CH 3 CH 2 OH → CH 2 =CH-CH=CH 2 +H 2 +2H 2 O
kat, t
CH 3 – CH(CH 3 ) – CH 2 – CH 3 → CH 2 = C(CH 3 ) – CH = CH 2 + 2H 2
2СН 4 ® С 2 Н 2 + 3Н 2
СаС2 +2Н2 О →Са(ОН)2 +Н2 ↑
С6 Н14 →С6 Н6 + Н2
С6 Н12 →С6 Н6 +3Н2
3С2 Н2 →С6 Н6
Спирты
Альдегиды
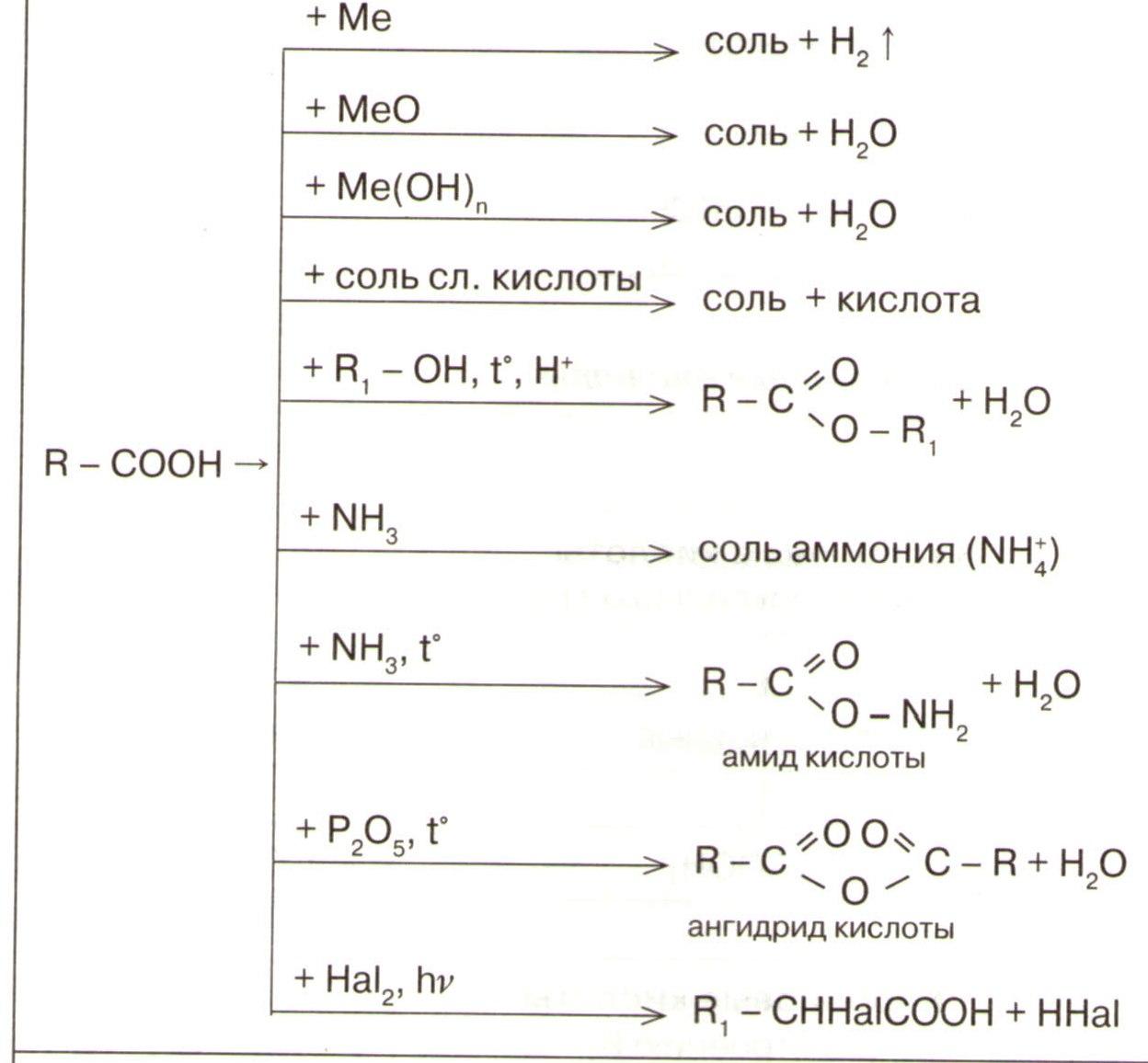
Карбоновые кислоты
эфиры
Одноатомные
Многоатомные
Фенолы
общая формула
C n H 2n+ 1 ОН
ROH
C2 −CH2
OH OH
C 6 H 5 ОН
n H2n O2
R-COOR1
Сn H2n O2
название
ол
Этиленгликоль
глицерин
Фенол
аль
овая
изомеры
По углеводородному скелету
межклассовая изомерия
простые эфиры
По углеводородному скелету
По положению функциональной группы
По углеводородному скелету
По углеводородному скелету
изомерия углеродного скелета, 4
межклассовая изомерия с кетонами, 3
межклассовая изомерия с непредельными спиртами и простыми эфирами 3
По углеводородному скелету
межклассовая изомерия
( эфиры)
По углеводородному скелету
межклассовая изомерия (кислоты)
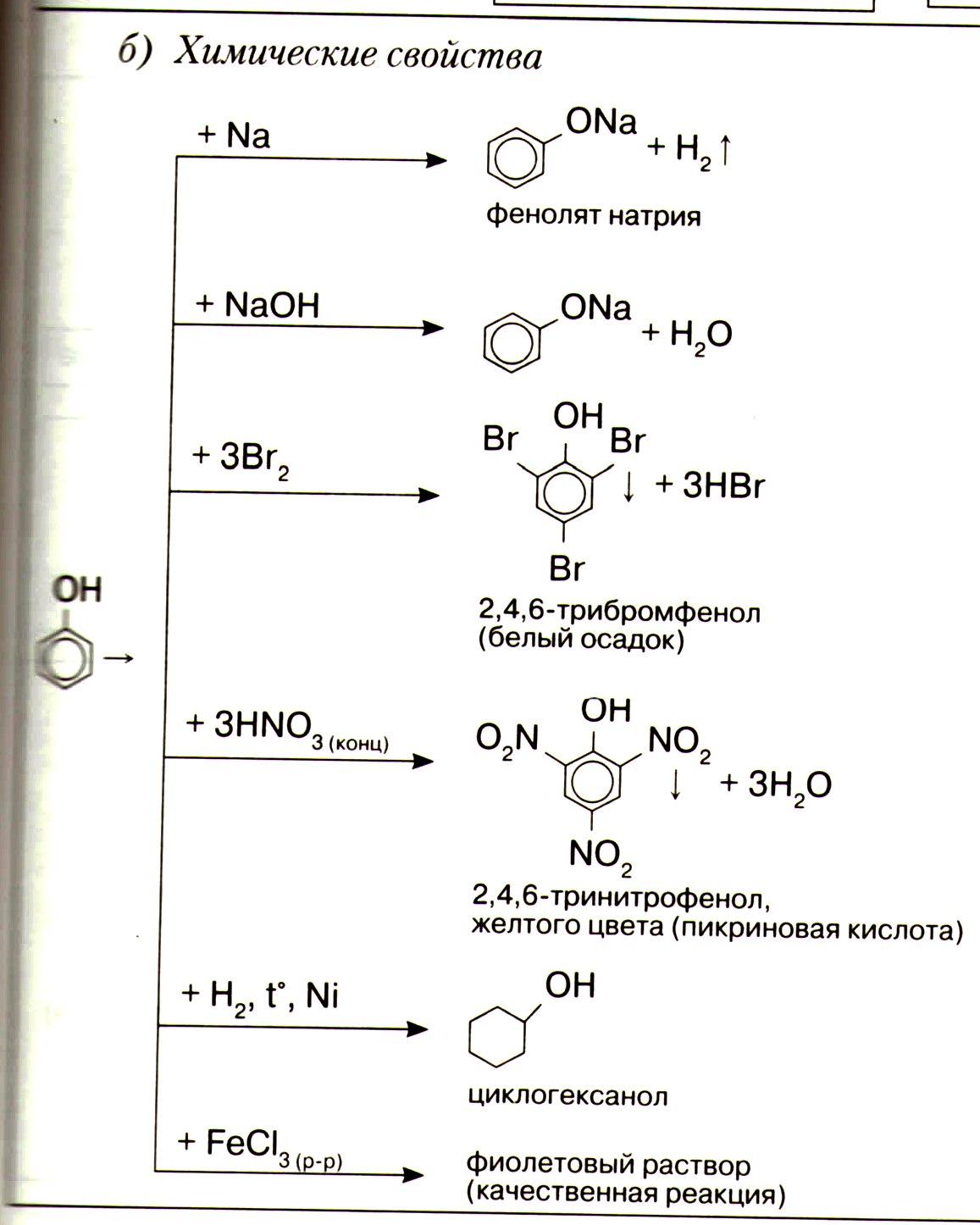
Химические свойства
Горят
С2 Н5 ОН + 3O2 → 2СO2 + 3Н2 О
с
CH2 −CH2 +Cu(OH)2 →CH2 −CH2 +2H2 O
│ │ │ │
OH OH O-Cu-O
2 H4 (OH)2 +5O2 →4СO2 +6Н2 О +Q
C2 −CH2 +2Na→CH2 −CH2 +H2
│ │ │ │
OH OH ONa ONa
C2 −CH2 +HCl→CH2 −CH2 +2H2 O
│ │ │ │
OH OH Cl Cl
C2 −CH2 + 2CH3 COOH→
CH2 −CH2 +2H2 O
│ │
O O
│ │
C=O C=O
│ │
CH3 CH3
с водородом
2 O→RCOOH+2Ag
2 → Cu2 O+ H2 O +RCOOH
с галогеноводородами
со щелочными металлами С 2 Н 5 ОН +Na →С 2 Н 5 ОNa +Н 2
с карбоновыми кислотами
С 2 Н 5 ОН + СН 3 СООН →Н 2 О+ СН 3 СООС 2 Н 5
Спирты реагируют друг с другом с образованием простых эфиров
С 2 Н 5 ОН + С 2 Н 5 ОН→ С 2 Н 5 -О- С 2 Н 5 + Н 2 О
Р. Дегидратации С 2 Н 5 ОН→ С 2 Н 4 + Н 2 О
С2 Н5 ОН + CuO→Cu + СН3 СОН + Н2 О
2СН3 –СН2 – ОН →СН2 =СН – СН=СН2 +2Н2 О+ Н2
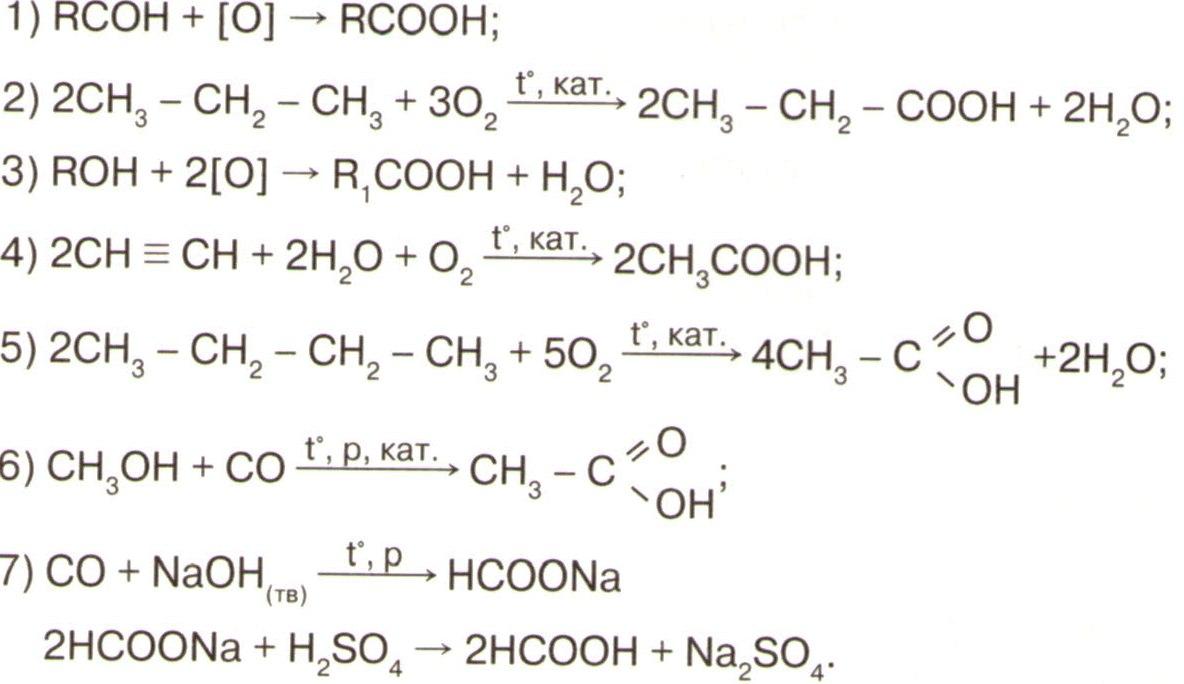
Получение
1. Гидротация алкенов:
СН 2 = СН 2 +НОН →СН 3 – СН 2 ОН
2. В лаборатории из галогеналканов:
CH3 Cl+NaOH → CH3 OH+ NaCl
3. Гидролиз сложных эфиров.
Н 2 О+ СН 3 СООС 2 Н 5 С 2 Н 5 ОН + СН 3 СООН
4. из синтез газа
СО + 2Н2 ® СН3 ОН
5.крахмал®С6 Н12 О6 (глюкоза)®2С2 Н5 ОН + 2СО2
С2 H4 + KMnO4 +H2 O→ C2 H4 (OH)2 + KOH + MnO2
CH2 −CH2 +NaOH→CH2 −CH2 +2HCl
│ │ │ │
Cl Cl OH OH
С2 Н5 ОН +CuO→Cu+СН3 СОН+ Н2 О
C2 H2 + Н2 О → СН3 СОН
1
2
СН 2 =С-СН 2 -СН-СН-СН=С –СН 3
│ │ │ │
СН 3 СН 3 С 3 Н 7 С 2 Н 5
СН 2 =С-СН 2 -СН-СН 2 -С=СН –С 2 Н 5
│ │ │
СН 3 С 2 Н 5 С 2 Н 5
1.Формула соединения содержит 75% углерода и 25% водорода:
а) C2 H6 б) C8 H14 в) C4 H10 г) CH4
2.Формула соединения содержит 80% углерода и 20% водорода:
а) C2 H6 б) C3 H8 в) C4 H10 г) CH4
3.Формула соединения содержит 82% углерода и 18% водорода:
а) C2 H6 б) C8 H14 в) C3 H8 г) C6 H10
4.Формула соединения содержит 88% углерода и 12% водорода:
а) C2 H6 б) C8 H14 в) C4 H10 г) C2 H4
5.Формула соединения содержит 75% углерода и 25% водорода:
а) C3 H6 б) C8 H14 в) C3 H6 г) C4 H10
6.Формула соединения содержит 86% углерода и 14% водорода:
а) C2 H6 б) C8 H14 в) C4 H8 г) C4 H10
7.Формула соединения содержит 88% углерода и 12% водорода:
а) C5 H8 б) C8 H14 в) C4 H10 г) C2 H6
8.Формула соединения содержит 87% углерода и 13% водорода:
а) C2 H6 б) C6 H10 в) C4 H10 г) C8 H14
9.Формула соединения содержит 87,5% углерода и 12,5% водорода:
а) C2 H6 б) C8 H14 в) C7 H12 г) C4 H10
10.Формула соединения содержит 84% углерода и 16% водорода:
а) C2 H6 б) C8 H18 в) C4 H10 г) C8 H14
11.Формула соединения содержит 86% углерода и 14% водорода:
а) C2 H6 б) C8 H14 в) C4 H10 г) C8 H16
12.Формула соединения содержит 87% углерода и 13% водорода:
а) C2 H6 б) C8 H14 в) C4 H10 г) CH4



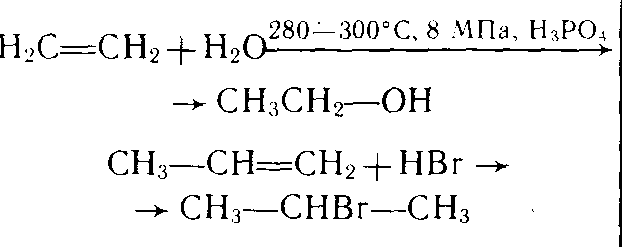
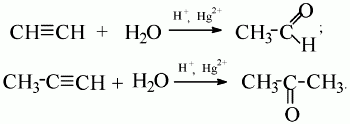

 H2−CH2
H2−CH2