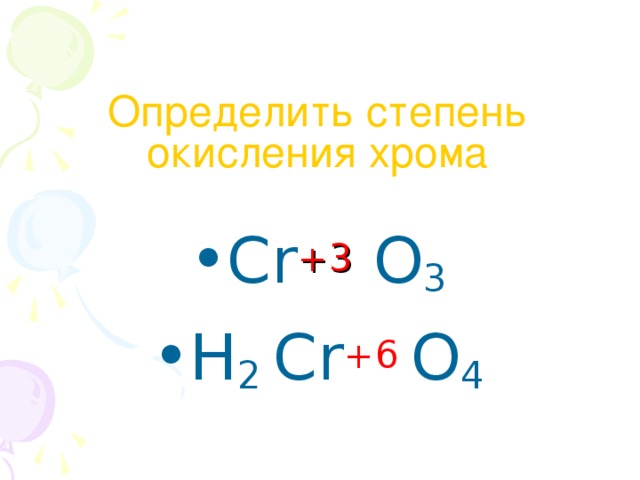
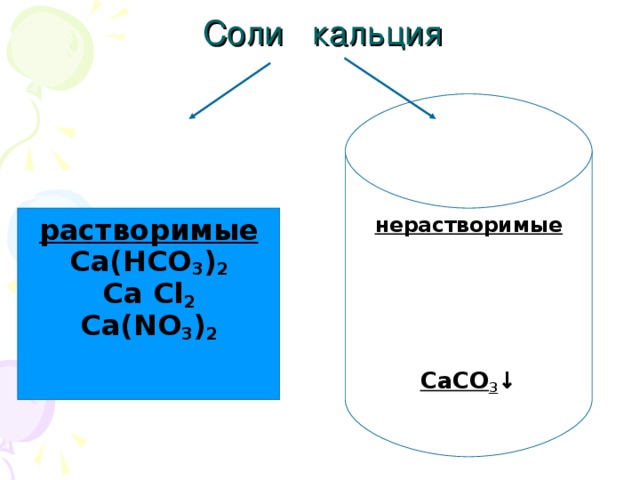
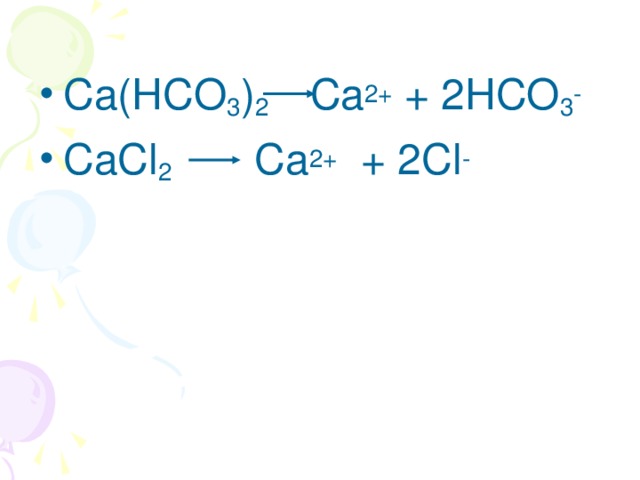
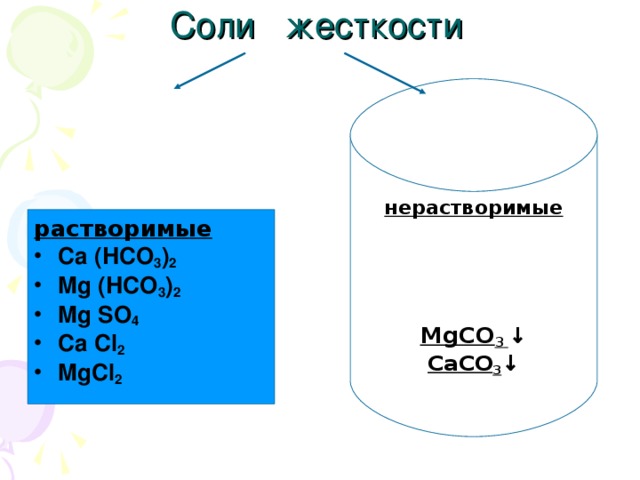
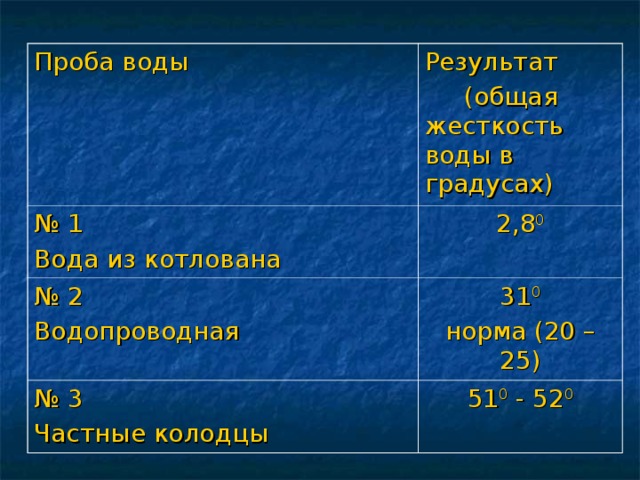
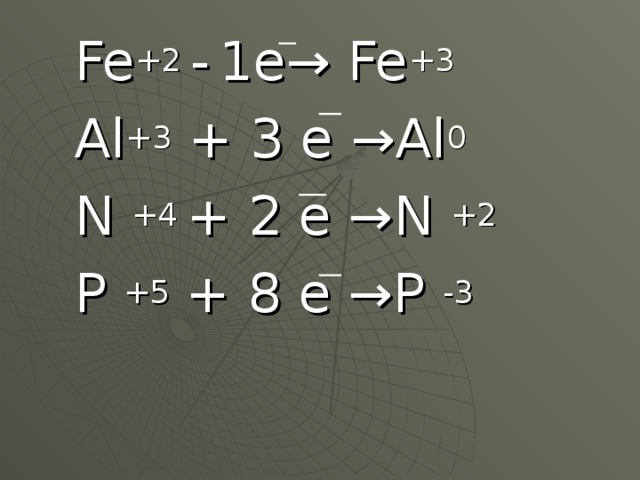Данная презентация представлена двадцатью семью слайдами.Первые девять-химическая разминка. Это повторение ПСХЭ,процессов окисления и восстановления.Задания разминки на понимание физического смысла некоторых понятий, умение определять степени окисления,составление уравнений перехода электронов и т.п. Учащиеся с удовольствием выполняют эти задания. Такую разминку можно проводить и на любом другом уроке , а также на уроках химии в 8 классе после изучения темы" Периодический закон и ПСХЭ".Слайды,помогающие учащимся понять тему" Жесткость воды", не перегружены лишней информацией, содержание их доступно и понятно.Кроме того, один из них содержит вопрос "Жесткая вода: это хорошо или плохо?", который позволяет ученикам порассуждать,используя свой жизненный опыт.Содержание презентации соответствует учебной программе.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Жесткость воды
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Жесткость воды »
Полезное для учителя
Распродажа видеоуроков!
2200 руб.
3140 руб.
1930 руб.
2760 руб.
1990 руб.
2840 руб.
1990 руб.
2840 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства