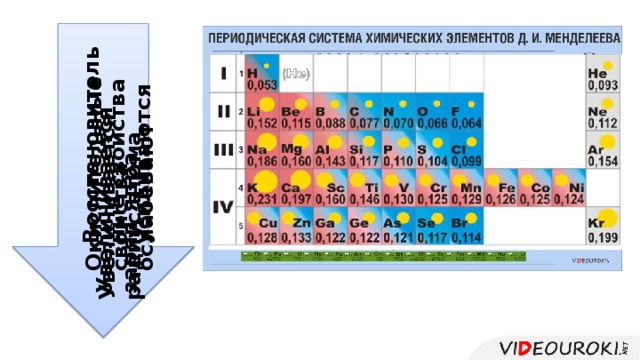
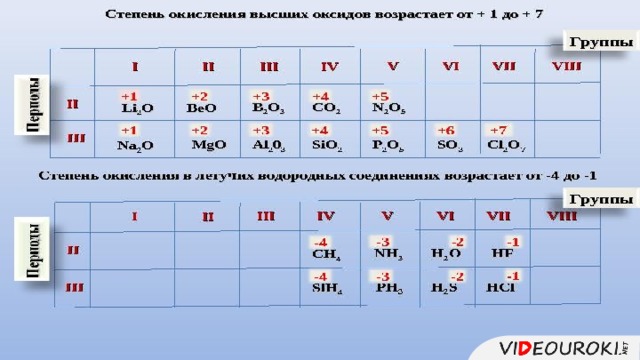
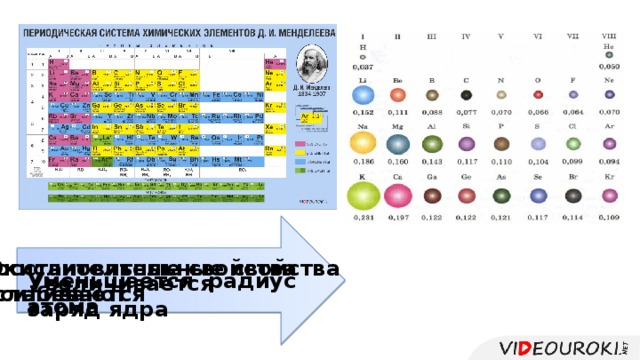
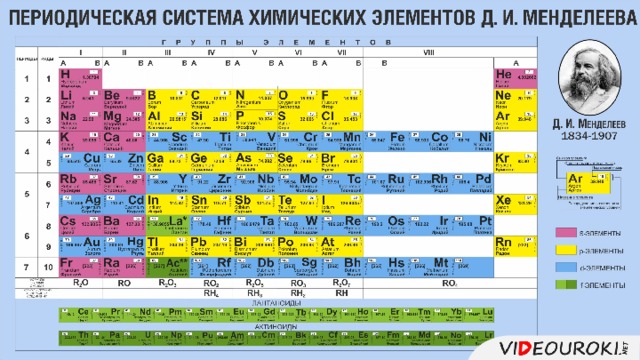
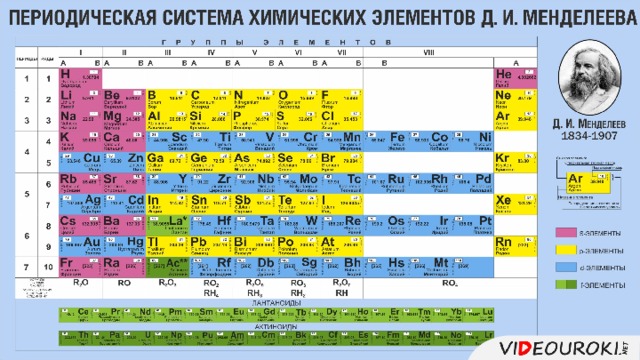
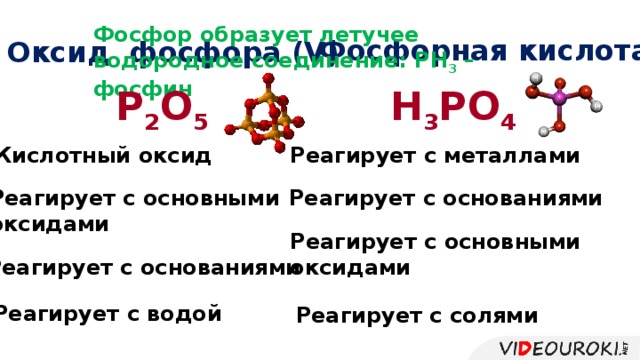
Урок посвящён повторению структуры Периодической системы, изменению свойств атомов химических элементов и их соединений, учащиеся смогут узнать об основных характеристиках химических элементов на основании его положения в Периодической системе Д.И. Менделеева. Презентация иллюстрирована картинками, облегчающими восприятие учебного материала.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
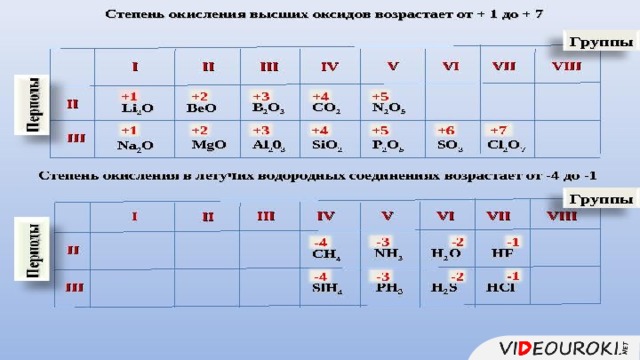
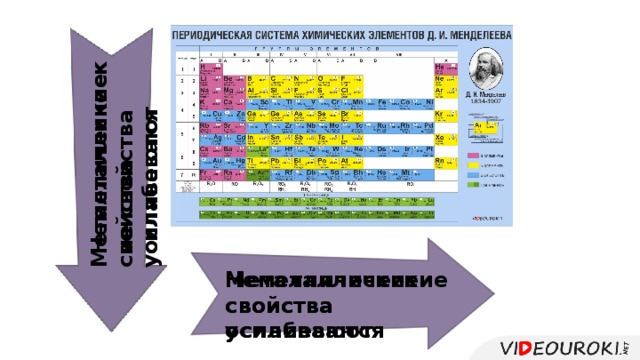
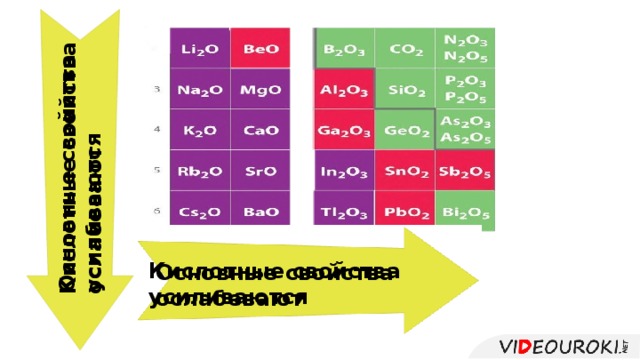
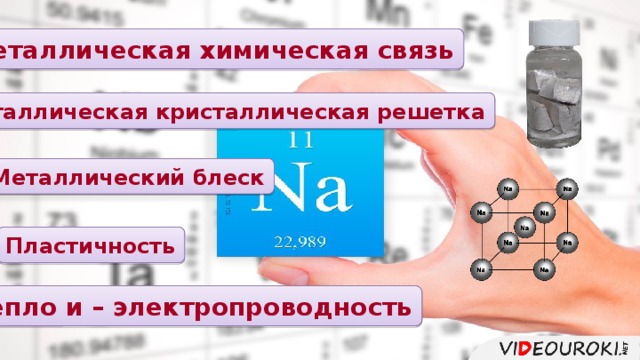
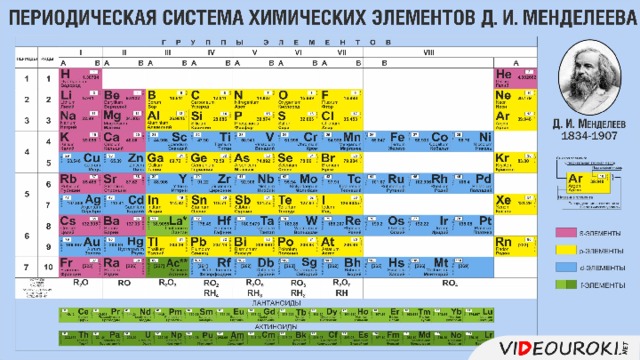
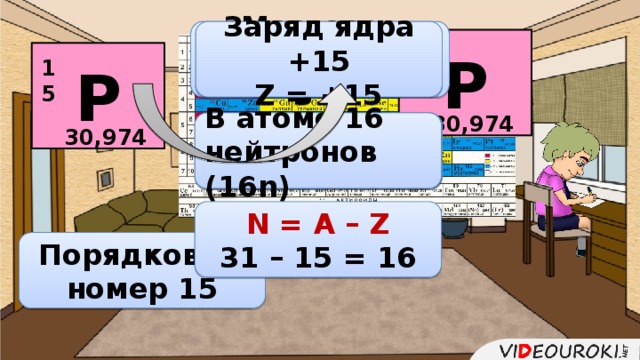
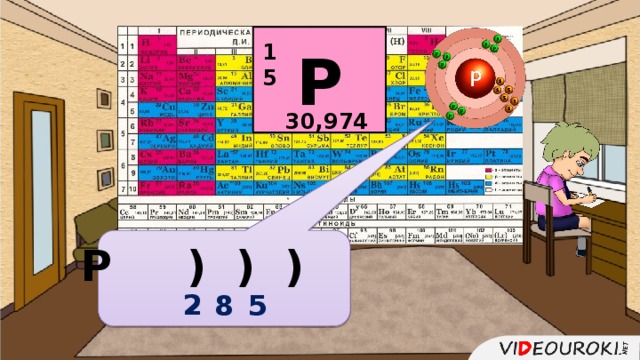
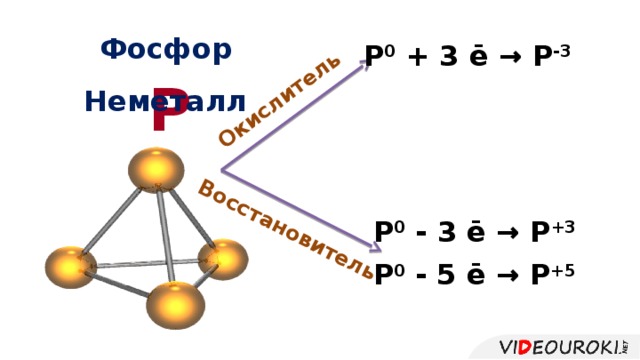
Презентация. Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация. Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева »
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1990 руб.
2840 руб.
2200 руб.
3140 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства