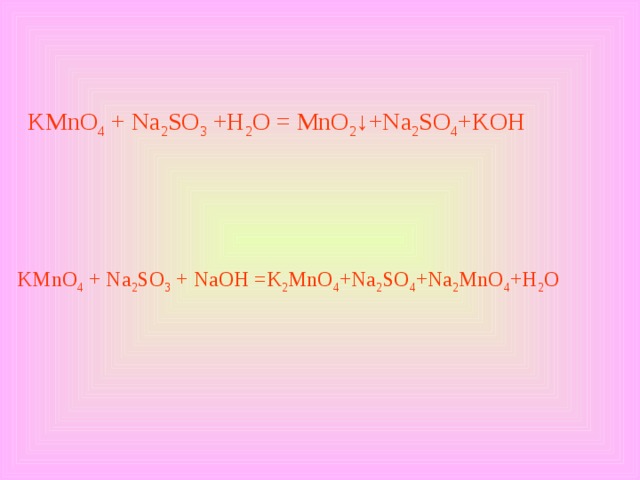Егорова
Валентина Юрьевна,
учитель химии и биологии
ГУ «Средняя общеобразовательная школа №6»

«Жить – это значит узнавать…
Жить – это значит творить,
трудясь без устали,
с неисчерпаемым вдохновением!»
Д. И. Менделеев


Определить степень окисления элементов в соединениях:
Zn,
K Cl O 3 ,
H CL O 4,
H 2,
K 2 S O 3,
H 2 S,
K Mn O 4
+4
-2
+1
+7
-2
+1
+1
-2
0
-2
+7
+1
-2
+5
+1
0
H 2 S,
K 2 S O 3,
K Cl O 3 ,
K Mn O 4
Zn,
H 2,
H CL O 4,

О КИСЛЕНИЕ – О ТДАЧА ЭЛЕКТРОНОВ ( СО повышается)
В ОССТАНОВЛЕНИЕ – В ЗЯТИЕ ЭЛЕКТРОНОВ ( СО понижается)

Восстановители (отдающие электроны): металлы, водород, уголь, С O, сероводород, аммиак
Окислители (принимающие электроны): O 2 , азотная и серная кислоты, галогены, KMnO 4 , K 2 Cr 2 O 7

Сколько ē отдано или принято атомами или ионами при следующих превращениях
1 вариант
а) Cu 0 – ? ē →Cu +2
б) S 0 - ? ē →S +6
в) Cr +6 + ? ē →Cr +3
г) Fe +3 + ? ē →Fe +2
2 вариант
а) N 0 + ? ē →N -3
б) O 0 + ? ē →O -2
в) Mn +2 - ? ē →Mn +6
г) S -2 - ? ē →S +6
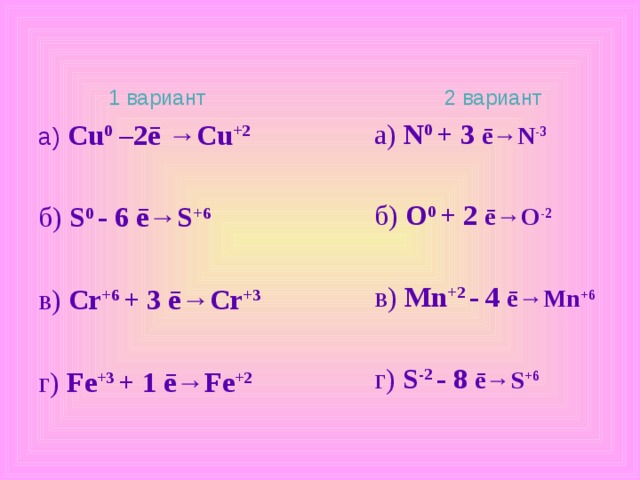
1 вариант
2 вариант
а) Cu 0 – 2 ē →Cu +2
а) N 0 + 3 ē →N -3
б) O 0 + 2 ē →O -2
в) Mn +2 - 4 ē →Mn +6
г) S -2 - 8 ē →S +6
б) S 0 - 6 ē →S +6
в) Cr +6 + 3 ē →Cr +3
г) Fe +3 + 1 ē →Fe +2
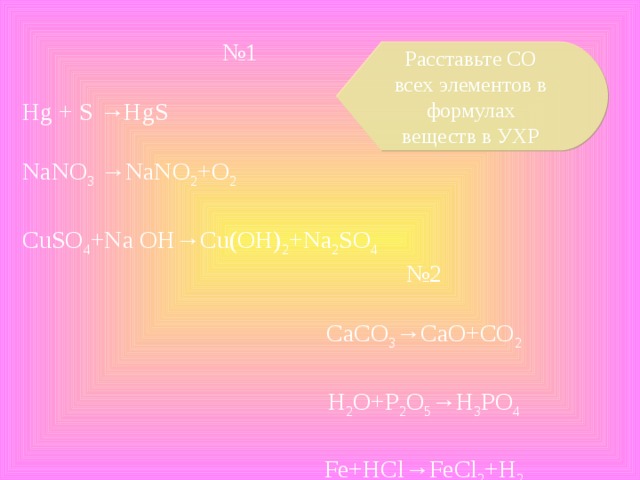
№ 1
Hg + S →HgS
NaNO 3 →NaNO 2 +O 2
CuSO 4 +Na OH→Cu(OH) 2 +Na 2 SO 4
Расставьте СО всех элементов в формулах веществ в УХР
№ 2
CaCO 3 →CaO+CO 2
H 2 O+P 2 O 5 →H 3 PO 4
Fe+HCl→FeCl 2 +H 2

ОВР - это такие реакции,
при которых происходит изменение степеней окисления атомов химических элементов или ионов,
образующих реагирующие вещества


ТБ!
Помните:
при работе с веществами, не берите их руками и не пробуйте на вкус, реактивы – не арбуз: слезет кожа с языка и отвалится рука.

Я известно с давних пор и имею спрос.
Опусти меня в раствор, в медный купорос.
Изменить хочу я соль. Ну-ка, выйди, соизволь!
Удивительный момент - стал другим раствор.
Вытесняю элемент, не вступая в спор.
На меня взгляни, ответь - начинаю я ржаветь.
Железный гвоздик опустите в раствор сульфата меди ( II )
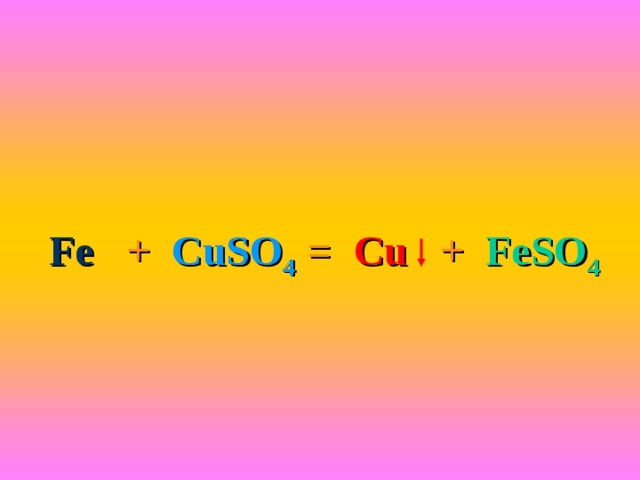
Fe + CuSO 4 = Cu + FeSO 4
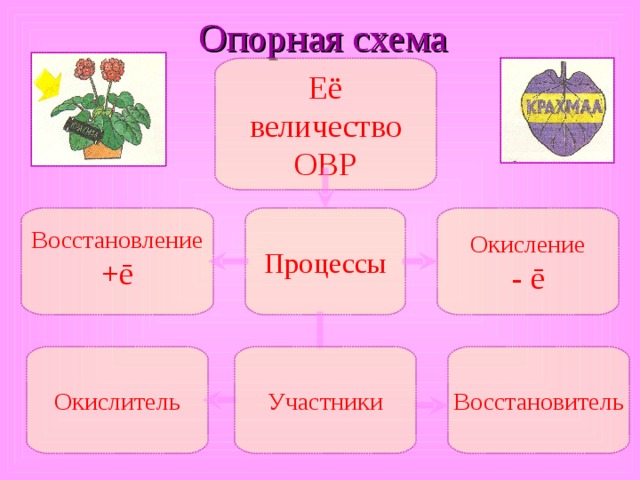
Опорная схема
Её величество ОВР
Окисление
- ē
Процессы
Восстановление
+ ē
Восстановитель
Окислитель
Участники

+5
+5
0
-1
5KClO 3 +6P→5KCl +3 P 2 O 5

 C 6 H 12 O 6 + 6 O 2" width="640"
C 6 H 12 O 6 + 6 O 2" width="640"
Это единственно важный первичный источник энергии для всего живого
6 CO 2 + 6 H 2 O - C 6 H 12 O 6 + 6 O 2

Брожение
Гниение




Данное уравнение реакции имеет огромное значение с точки зрения экологии , так как позволяет связать при обычных условиях случайно пролитую ртуть:
3Hg + 2KMnO 4 + 8H + = 2Hg +2 + 2K + + 2MnO 2 + 2H 2 O
Это возможно в домашних условиях
в случае попадания ртути в труднодоступные места (аптечный пузырёк «марганцовки» (2 гр) + 1 литр воды + 1/2 чайной ложки уксуса)
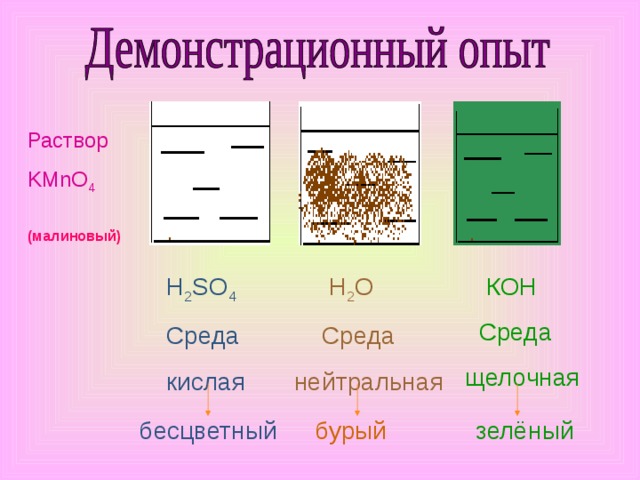
Раствор
KMnO 4
(малиновый)
H 2 SO 4
Среда
кислая
Н 2 О
Среда
нейтральная
К OH
Среда
щелочная
бесцветный
бурый
зелёный
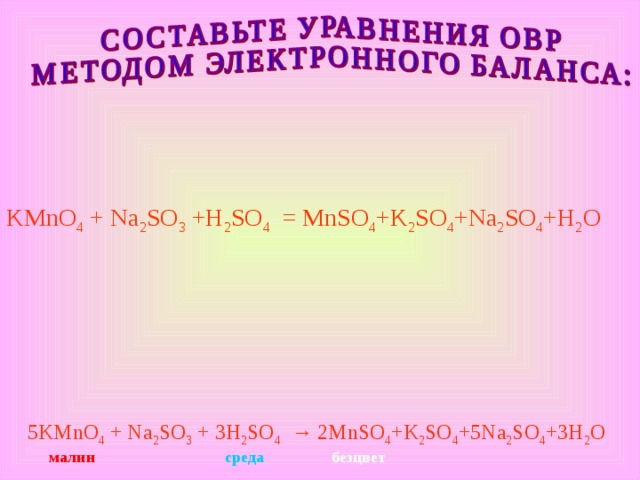
KMnO 4 + Na 2 SO 3 +H 2 SO 4 = MnSO 4 +K 2 SO 4 +Na 2 SO 4 +H 2 O
5 KMnO 4 + Na 2 SO 3 + 3 H 2 SO 4 → 2MnSO 4 +K 2 SO 4 +5Na 2 SO 4 +3H 2 O
малин
среда
безцвет
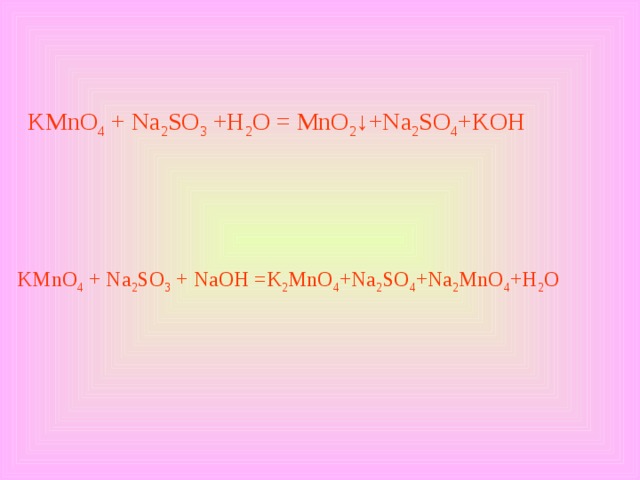
KMnO 4 + Na 2 SO 3 +H 2 O = MnO 2 ↓ +Na 2 SO 4 +KOH
KMnO 4 + Na 2 SO 3 + NaOH = K 2 MnO 4 +Na 2 SO 4 +Na 2 MnO 4 +H 2 O

«Как трудно было сперва поддерживать огонь
и как теперь легко.
Так всё придёт – только трудитесь.
Приобретайте главное своё богатство –
умение себя побеждать»
Д. И. Менделеев







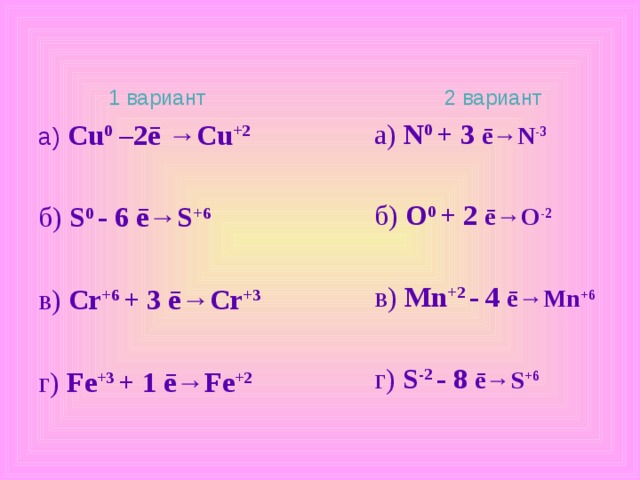
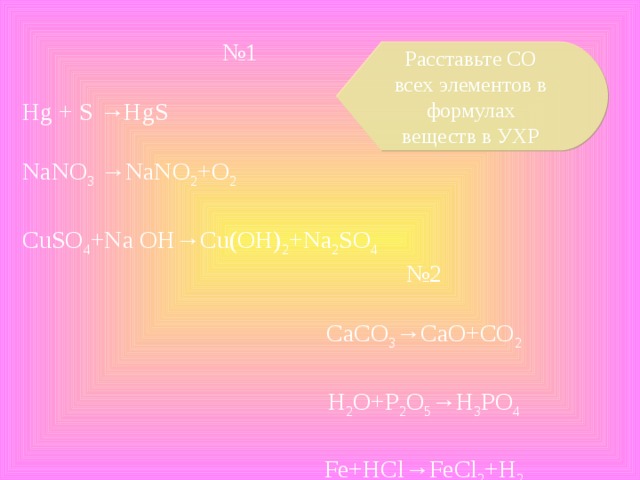




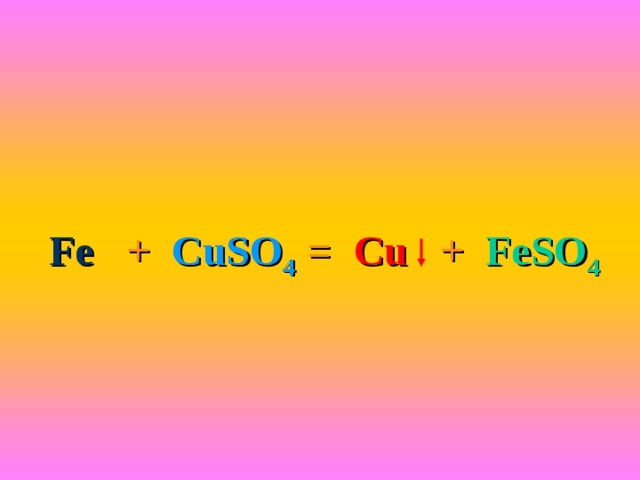



 C 6 H 12 O 6 + 6 O 2" width="640"
C 6 H 12 O 6 + 6 O 2" width="640"