СШ№1 г. Есиль
«Фосфор и его соединения»
Урок химии в9 классе
. Подготовила : учитель химии и биологии.Парусимова М.Н.
2014-15 учебный год
Фосфор и его соединения
.Цели урока: продолжить формирование понятий «элемент» и «вещество», а также показать многообразие образуемых данным элементом (фосфором) соединений и их практическую значимость;• создать условия для развития исследовательских умений учащихся. Задачи: 1. Образовательные: способствовать формированию у учащихся представления о фосфоре как о наиболее активном неметалле; повторить и закрепить понятие аллотропии, умение расставлять коэффициенты методом электронного баланса; рассчитывать массовую долю продукта от теоретически возможного.
2. Развивающие: развивать умение расставлять коэффициенты методом электронного баланса; рассчитывать массовую долю продукта от теоретически возможного, содействовать развитию у учащихся исследовательских умений в процессе обучения в сотрудничестве, развивать познавательный интерес, 3. Воспитательные: способствовать созданию условий для самореализации личности, для взаимопомощи и индивидуальной ответственности каждого в группе, поддерживать интерес к изучению химии через самостоятельную работу, воспитывать сотрудничество, продолжить формирование культуры общения и коммуникативных умений учащихся. Методы и приемы обучения: репродуктивный, частично-поисковый, использование компьютерных технологий.Ход урока сопровождается презентацией, видеофрагментами отдельных вопросов темы по плану урока Оборудование:
ПСХЭ, компьютер, мультимедийный проектор. Диск « Электронное обучение химия 9 класс»,Дем 6 , ЦОР Тип урока: Комбинированный. Урок изучения нового материала.
Формы организации учебной деятельности: самостоятельная работа с текстом учебника; фронтальная; работа в группах. Методы обучения. Методы организации учебной деятельности: словесные (эвристическая беседа),наглядные (коллекция, видеофрагмент)на основе познавательной деятельности частично-поисковый;Педагогические приемы: учебно-организационные (определение цели и задачи урока, создание благоприятных условий деятельности); учебно – информационные (беседа, постановка проблемы, ее обсуждение, работа с учебником, наблюдение); учебно – интеллектуальные (восприятие, осмысление, запоминание информации, решение проблемных задач, мотивация деятельности).
Ход урока:1 Организационный момент.
УЧИТЕЛЬ: Здравствуйте, ребята!Друзья мой я очень рада войти в приветливый наш класс.И для меня уже награда Вниманье ваших умных глаз,Я знаю каждый в классе гений, Но без труда талант не в прок. Возьмем же ручки и мелок.И вместе проведем урок.
Я вижу, что настроение у вас хорошее, поэтому на уроке все должно получиться также хорошо. Для успешной работы организуем группа, выберем Лидера, Теоретик Часовой. Для каждой группы.
II Повторение темы «Азотная кислота.Нитраты».
Лидеры получают индивидуальные задания .Задача .При взаимодействии аммиака количествам 3 моль с серной кислотой , образовался сульфат аммония массой 290г .Рассчитайте массовую долю продукта от теоретически возможного.
Задача. При взаимодействии 4 моль ртути с азотной кислотой образовалось 1000г соли. Рассчитайте массовую долю продукта от теоретически возможного.
ЗаданиеПри взаимодействии 5 моль меди с азотной кислотой образовалось 800г соли. Рассчитайте массовую долю продукта от теоретически возможного.
Фронтальная проверка знаний 1. Перечислите химические элементы, входящие в состав V группы главной подгруппы. 2: Как называются соли азотной кислоты. 3Дать названия веществам NH4NO3 Ca( NO3)2 NaNO3 4. 5. Азотная кислота –это сильная кислота Задание12балла балла4В состав азотной кислоты входит нитрогруппа.а) верно б) неверноЗадание2. 2балла Взаимодействие аммиака с хлороводородом относится к реакциям NH3 + HCI = NH4CI А) разложения б) соединения в)обмена г) замещения 1б
.Задание3 3балла В каком из перечисленных соединений азота степень окисления равна +3:1. NH3 2. HNO3 3. HNO2 4. NO2
Задание4 4 баллаВзданиимодействие медной стружки с концентрированной азотной кислотой приводит к образованию газа:1.NO2 2. N2O 3. NO 4. NH3

 Работа в группахЗадание 5 5баловСоставьте уравнения реакций следующих превращений стрNО NО2НNО3?9Осуществим взоимопроверку ( индивид работы лидеры- друг у друга . в группах также- друг у друга)
Работа в группахЗадание 5 5баловСоставьте уравнения реакций следующих превращений стрNО NО2НNО3?9Осуществим взоимопроверку ( индивид работы лидеры- друг у друга . в группах также- друг у друга)
2NО+О2 = 2 NО2 4NО2 +О2 + Н2О = 4НNО3
Решение задач.Задача1Дано 5 моль 500г
mСu (NО3)2=8000г Си + НNО3 = Си(NО3)2 +2NО2 + 2Н2О НNО3 –изб. 1 моль 188г νСи= 5 моль. МСи(NО3)2 = 188г/моль
φ-?m=М*ν=188г/моль * 1 моль = 188г .Си 5 моль-----Хг Си(NО3)2 Хг= 5моль*188г =940гСи(NО3)2. 1 моль ------188гСи(NО3)2 1 моль
940г-------------100% . 800г----------У% У= 800г* 100г/ =85 % . . 940г% Ответ φ- =85%
Задача2 ДаноM(NН4)2 SО4= 290г 3 моль 290г .Н2SО4 –изб 2NН3 + Н2SО4 = (NН4)2SО4νNН3=3 моль М (NН4)2SО4 =132г 264г
φ-? m=М*ν= 132г*2 моль= 264гХг= 3моль*264г= 396г . 2 моль (NН4)2SО4
369г--------100% У%= 290г *100% =73,2% . 290г ---------У% 369гОтветφ= 73.2%(NН4)2SО4
Задача3*****************************************************************
 Дано 4моль 1000г
Дано 4моль 1000г
M(НgNO3) = 1000гНg + НNO3= Нg(NO3)2 + NО2 + Н2ОνНg=4 моль……. 1моль 325г .φ-? МНg(NO3)2 = 325г m=М*ν=325г*1 моль=325г
1 моль------------ 325г Хг = 4моль*325г = 1300гНg(NO3)2 . 4 моль***------------Хг 1 моль
1300г-------------------100% У% = 1000г*100% = 76,3%Нg(NO3)2 .1000г------------------У% 1300г Ответ .φ = 76,3% Нg(NO3)2
| Колич. баллов | Оценка |
| 16 | 5 |
| 15-14 | 4 |
| 13-4 | 3 |
| 3-1 | 2 |
Критерий оценивания
III Изучение нового материала
УЧИТЕЛЬ: Мы продолжаем изучение отдельных элементов периодической системы Менделеева, и я не сомневаюсь в том, что вас ждут новые открытия, потому что, по словам Ж. Пиаже «понять что-либо значит открыть вновь». Сегодня на уроке речь пойдет о химическом элементе, участвующем в детективной истории, отрывок из которой я вам сейчас прочту.
УЧИТЕЛЬ: (читает отрывок из книги) «…Да. Это была собака, огромная, черная, как смоль. Но такой собаки никто из нас, смертных, еще не видывал. Из ее пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло бы возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившие на нас из тумана…Страшный пес величиной с молодую львицу. Чудовище лежало перед нами… Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза обведены огненными кругами. Я дотронулся до этой светящейся головы и, подняв руку, увидел, что мои пальцы тоже засветились в темноте» Узнали? Что же это за произведение?
(Ответ детей)Да, вы правы. Это отрывок из произведения Артура КонанДойля “Собака Баскервилей». Назовите химический элемент, который замешан в этой истории.УЧАЩИЕСЯ:Фосфор. УЧИТЕЛЬ: Верно Действительно, тема сегодняшнего урока «Фосфор».Откройте тетради и запишите тему урока. «Фосфор и его соединения.» Предлагаю вам вместе сформулировать что мы хотим узнать о фосфоре? Цель нашего урока: получить знания о химическом элементе, простом веществе фосфоре, его аллотропных модификациях, физических и химических свойствах, применении и значении фосфора в природе и жизни человека.
Для этого предлагаю: охарактеризуйте фосфор как химический элемент по его положению в периодической системе химических элементов Д.И. Менделеева по плану. 1. Порядковый номер, номер периода, группа, подгруппа;2. Заряд ядра, электронная формула, 3. Валентность.4. Формула летучего водородного соединения и высшего оксида.УЧИТЕЛЬ: Предлагаю вам использовать лестницупознения и успешнопреодалев ее ступени Мы будем знать о фосфоре всё что наметили .Сегодня мы вместе с вами попробуем взглянуть на фосфор глазами историка, геолога, физика, химика, биолога, медикаСтупенька «Историческая».
Микрофильм 1 историяи т.д.
Из всех древних элементов только фосфор имеет точную дату открытия – 1669 год. В поисках эликсира молодости и попытках получения золота алхимик XVII столетия Геннинг Бранд из Гамбурга пытался изготовить "философский камень". Для этой цели он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной жидкости. Эту жидкость он подверг сильному прокаливанию в смеси с песком и древесным углем без доступа воздуха.
В результате Бранд получил вещество, обладающее необыкновенными свойствами: оно светилось в темноте. Интерес к новому веществу был огромный, ,Бранд показывал новое вещество за деньги. А желающим продавал его небольшими порциями только за чистое золото. Конец это мубизнесу положил английский химик Роберт Бойль, который в 1680 году опубликовал в научном журнале более простую и доступную методику получения фосфора.**Наименование элемента происходит от греческих*слов «фос» - свет и «форос»,- несущий. В России термин фосфор введен в 1746 году М. В. Ломоносовым. Ну а мы поднимаемся на следующую ступеньку лестницы познания «Геологическую».Фосфор принадлежит к весьма распространённым в природе элементам. Он занимает 13 место среди всех элементов. Вследствие высокой химической активности фосфор в свободном состоянии в природе не встречается. Он содержится не менее чем в 190 минералах, из которых главнейшими являются апатиты и фосфориты. В 1926 году
По оконч фильма. А.Е.Ферсманом и его сотрудниками были открыты огромные запасы апатитов на Кольском полуострове в Хибинах, где их залежи не имеют равных нигде в мире. Незадолго до войны было открыто очень крупное месторождение фосфоритов Каратау в Казахстане.
Одно из природных соединений фосфора - газообразный фосфористый водород, особенность которого состоит в том, что он легко воспламеняется на воздухе. Это свойство фосфористого водорода объясняет появление болотных, блуждающих или могильных огней. Огни на болотах и свежих могилах действительно бывают. Это не фантазия и не выдумка. В теплые темные ночи на свежих могилах иногда наблюдаются бледно-голубоватые, слабо мерцающие огоньки. Это "горит" фосфористый водород. Образуется он при гниении отмерших растительных и животных организмов. Фосфорные соединения, входящие в состав трупов животных и человека, под действием грунтовых вод разлагаются с образованием фосфористого водорода, который, выйдя на поверхность, воспламеняется. Таким образом, огни на могилах и болотах - не "чудо", не следы таинственных духов, не привидения, не признак святости или греховности умершего, а результат химической реакции.
Запишите, что фосфор в природе встречается в соединениях, его природные минералы – фосфориты и апатиты.
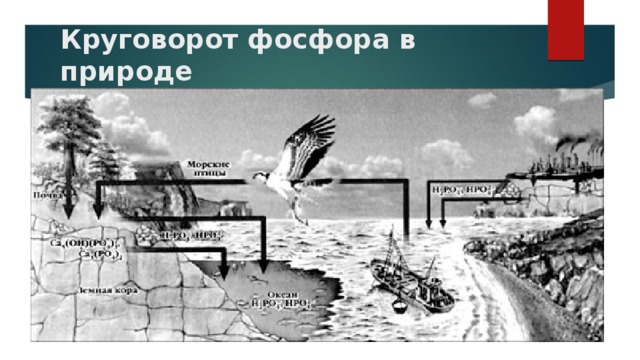
Круговорот фосфора в природе. слайд Сообщение.уч-ка
А впереди нас уже ждёт следующая ступенька «Физическая». Подготовить Эл учебник 9 клДем 6.
Ребята, Вы видите, что свойства белого, красного и черного фосфора различны, хотя они образованы одним химическим элементом. Как вы думаете, Почему различны их свойства?( разная кристаллическая решетка веществ ).
УЧИТЕЛЬ. О роли фосфора в жизни живых организмов мы узнаем, поднявшись на следующую ступеньку, которая называется «Биологическая».
«Знаменитый минеролог один из основоположников науки геохимии академик А.Е. Ферсман назвал фосфор “элементом жизни и мысли”. Содержание фосфора в организме человека массой тела 70 кг составляет 780 г. Суточная норма потребления для взрослых 1 г.
Фосфор входит в состав скелета в виде ортофосфата Са3(Р04)2 и гидрокси апатита ЗСа3(Р04)2 • Са(ОН)2 . Входит в состав зубов в виде гидрокси апатита и фтор апатита 3Са3(Р04)2 • CaF2.»
Из фосфора строится АТФ, которая является универсальным источником энергии для всех реакций, протекающих в клетке. Наиболее интенсивно АТФ расходуется в активно работающих органах тела: печени, мышцах, мозгу. Остатки фосфорной кислоты присутствуют в составе молекул ДНК и РНК.Фосфор необходим для нормальной мышечной и умственной деятельности.В наш организм фосфор поступает с пищей: рыбой, хлебом, молоком, сырами, мясом, бобовыми (горох, фасоль), овсяной, перловой, ячневой крупой.
При недостатке фосфора в организме: развивается рахит, снижается умственная и мышечная деятельность.
Доза фосфора в 0,05–0,15 г для человека смертельна. Профессиональным заболеванием рабочих первых спичечных фабрик был фосфорный некроз – поражение челюстей. Белый фосфор не только является сильным ядом, при попадании на кожу вызывает долго не заживающие ожоги.
 В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля. Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля. Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Микрофильм 2Наша следующая ступенька называется « Химическая». Фосфор многоликий элемент.4Р + 5О2 = 2Р2О5 3Mg + 2P = Mg3P25KClO3 + 6P = 3P2O5 + 5KCl (с бертолетовой солью)
Такая реакция происходит, когда мы зажигаем спички. В головке спичек содержится бертолетова соль, в намазке шкурки – красный фосфор.
А сейчас мы переходим на ступеньку « Практическую»
Применение фосфора. Главные его потребители – производство спичек, металлургия, химические производства. Фосфор используют в производстве фосфорной кислоты и фосфорных удобрений, полупроводниковых материалов, как компонент покрытий стальных изделий и т. д. Белый фосфор применяют для изготовления трассирующих боеприпасов, как дымообразующее и зажигательное средство, красный фосфор – основной компонент обмазки зажигательной поверхности спичечных коробков.его используют при изготовлении безалкогольных напитков., моющих средств,. в хлебопечении, в фармацевтической промышленности
III Закрепление знений.
Углубить и конкретизировать знания о строении атома фосфора, о его нахождении в природе, об аллотропных видоизменениях фосфора, о его физических и химических свойствах; о промышленном способе получения и о применении я прошу вас подготовить ответ в виде краткой схемы- конспекта.
Рефлексия
1. Что узнали нового на уроке. Полезного?2. Если урок понравился, то покажите зеленый квадрат е
Не поняли тему или Не понравился урок –то белый квадрат.
Домашнее задание.§20 стр 91 упр1-5( на оценку 3) упр6-9 (на оценку 4-5)
Подведение итогов урока, комментирование и выставление отметок.

 Работа в группахЗадание 5 5баловСоставьте уравнения реакций следующих превращений стр
Работа в группахЗадание 5 5баловСоставьте уравнения реакций следующих превращений стр Дано 4моль 1000г
Дано 4моль 1000г В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.
В промышленности фосфор получают из фосфоритов и апатитов, нагревая их в электрической печи без доступа воздуха в присутствии оксида кремния (IV) и угля.