| ОРГАНИЗАЦИОННАЯ СТРУКТУРА УРОКА |
Структура интегрированного урока (по ФГОС) |
| ЭТАП 1. Организационный этап |
| Формирование конкретного образовательного результата (группы результатов) | Дли-тель ность этапа | Основной вид учебной деятельности, направленной на формирование данного образовательного результата | Методы обучения | Средства ИКТ для реализации данного вида учебной деятельно-сти | Форма организации деятельности учащихся | Функции (роль учителя на данном этапе) | Основные виды деятельности учителя |
| Личностные: Нравственно-этическое оценивание исходя из социальных и личностных ценностей | 2 мин. | Эмоциональный настрой и познавательный интерес к теме. Быстрое включение учащихся в деловой режим. | Работа с высказыванием: Н.И. Лобачевский «Математика – это язык, на котором говорят все точные науки». М.В. Ломоносов «Далеко простирает химия руки свои в дела человеческие» | Презентация, Слайд №1 , | Просмотр слайда и диалог с учителем. | проблемного характера: эмоционально настроить учащихся на интегрированный урок. | Проводит диалог с учащимися: Учитель математики по высказыванию Н.И. Лобачевского; Учитель химии по словам М.В. Ломоносова
|
| ЭТАП 2. Вхождение в тему урока и создание условий для осознанного восприятия нового материала |
| П- Поиск и выделение необходимой информации К- оценка действий партнёра умение с достаточной полнотой и точностью выражать свои мысли | 5 мин. | Установить правильность, осознанность усвоения учащимися типов текстовых задач | Диалог | Слайд №2 с правильным выбором ответа. Слайд №3 | Отвечают на вопрос учителя: 1. Какие типы текстовых задач решаем в школьном курсе математики? 2.Какой тип задач более связан с химией? 3.Какие слова навели вас на правильный ответ? | Организовать самопроверку по слайду №2 и слайду №3 правильности выполнения задания.
| Учителя математики: Использование небольшой психологической паузы и вопроса: Какой тип задач более связан с химией? побуждающего внимание учащихся к теме урока. |
| ЭТАП 3. Актуализация знаний. Постановка цели и задач урока. Мотивация учебной деятельности учащихся. |
| П- самостоятельное выделение и формулирование познавательной цели Р- Целеполагание
| 5 мин. | 1.Осмысленное восприятие информации 2.Формулировка темы и целей урока. | Практическая «разминка» | Просмотр слайда №4 и №5 (вопросы для «разминки»).
| 1.Отвечают на вопросы. Выполняют задания, сообщают о результатах. 2.Делятся мнениями на поставленную проблему. 3.Выдвигают гипотезу. 4.Формулируют тему урока и цель урока. | Подвести ответы детей к проблеме: Решали или нет такого типа задачи на уроках химии и математики? И что же предстоит сделать на этом уроке? Актуальность этих задач? Помогает сформулировать тему урока | 1. Учитель математики даёт задания устного счёта на проценты. 2. Учитель химии дополняет вопросами по используемым терминам и понятиям из химии, которые будут использоваться в задачах.
|
| ЭТАП 4. Применение знаний решения задач на растворы в реальной жизни. |
| П- самостоятельное выделение и формулирование познавательной цели Л- Развитие математической и химической речи; Р- Целеполагание К- оценка действий партнёра умение с достаточной полнотой и точностью выражать свои мысли | 10 мин | Текстовая постановка проблемных задач из реальной жизни. | Работа с химическими понятиями. | Слайды №7,8,9, 10,11,12 | .1.Делятся мнениями на поставленную проблему. 2.Работают с химическими определениями и понятиями. 3.Отвечают у доски по заданиям на слайдах. | Настроить детей на применение методов решения задач | Учитель математики: Организация работы у доски по карточкам-заданиям. Учитель химии: организация работы с химическими определениями и понятиями.
|
|
|
|
|
|
|
|
|
|
| ЭТАП 5. Организация и самоорганизация учащихся в ходе дальнейшего обобщения и систематизации знаний материала. Практикум. |
| П-Выбор эффективных способов решения задач П-Извлечение необходимой информации из прослушанных, прочитанных текстов различных задач К- оценка действий партнёра умение с достаточной полнотой и точностью выражать свои мысли | 10 мин | 1.Выполнение задачи №1 (на растворы ) по карточкам в тетрадях и у доски. 2, Защита приёмов решения задачи.
| Работа с текстом , представление основного материала одновременно в словесной, знаково-символической форме и в виде таблицы |
| 1.Выполняют задание №1 письменно. 2.Делятся мнениями на поставленную проблему. 3.Работают с определением молярной массы и концентрации. 4.Делают выводы в выборе метода решения, в выборе схемы решения, учитывая знание формул по химии и химических обозначений.
| Создание условий для освоения учащимися знаний преимущественно в форме деятельности | 1.Руководит последователь ностью защиты методов (с помощью системы уравнений с двумя переменными, химическим способом, математическим с помощью уравнения) решения задачи. 2. Предлагает сделать выводы. 3.Организует обсуждение результатов.
.
|
| ЭТАП 6. Новое, давно забытое старое. Или арифметический способ решения задач на растворы. |
| П-Выбор эффективных способов решения задач Умение составлять схемы и уравнения к текстовым задачам. Р- Коррекция; Целеполагание Л - Развитие интереса к предметам;
| 5мин | 1.Выполнение задач №1 и №2 арифметическим методом. | Работа со схемой и самостоятельное составление схемы и решение задачи. |
| 1.Работают в парах. 2.Делают выводы в выборе решения. | Создание условий для освоения учащимися знаний преимущественно в форме деятельности.
| Предлагает сделать выводы. Организует обсуждение результатов. Руководит работой на местах. |
| ЭТАП 7. Первичная проверка полученных результатов. Коррекция. |
| Длительность этапа | Виды учебной деятельности для проверки полученных образовательных результатов | Средства ИКТ для реализации данного вида учебной деятельности | Методы контроля | Способы коррекции | Форма организации деятельности учащихся | Функции(роль учителя на данном этапе) | Основные виды деятельности учителя |
| 3-5мин. | Выполнение по карточкам: 1 вариант: задача №3; 2 вариант: задача №4. | Слайд с текстом | проверка выполнения в тетради | Комментарии учеников и учителя к решению на слайде | Работа с карточками-заданиями | Настраивает детей на быстрое выполнение задания | Помогает комментировать задания после проверки тетрадей. |
| ЭТАП 8. Информация о домашнем задании, инструктаж по его выполнению. |
| Образовательные задачи этапа учебного занятия | Содержание этапа учебного занятия | Показатели выполнения образовательных задач этапа | Условия выполнения образовательных задач этапа | Возможный метод и приём обучения |
| Обеспечить понимание учащихся цели содержания и способов выполнения домашнего задания.
| 1.информация о домашнем задании 2.инструктаж по выполнению д/з. | находить необходимую для выполнения работы информацию в материалах учебника | Соответствие содержания д/з уровню обученности учащихся. Запись домашнего задания в дневник | Задание: 1 уровень: на карточках две задачи 2уровень № 971, на карточках две задачи |
| ЭТАП 9. Рефлексия (Подведение итогов занятия) |
| Образовательные задачи этапа учебного занятия | Содержание этапа учебного занятия | Показатели выполнения образовательных задач этапа | Условия выполнения образовательных задач этапа | Возможный метод и приём обучения |
| 1.Дать качественную оценку работы класса 2.Инициировать рефлексию учащихся по поводу своего эмоционального состояния, мотивации своей деятельности и взаимодействия с учителями и одноклассниками | 1.Подведение итогов урока 2.Мобилизация учащихся на рефлексию своего поведения | 1.Чёткость и краткость 2.Открытость учащихся в осмыслении своих действий и самооценке | Умение учителя давать качественную характеристику работы класса Развитие способностей учащихся к рефлексии | Приём «Смайлики»: Суть- зафиксировать свои достижения на уроке: Я разобрался в теме… Я пропускаю ход… |
| Сокращения в технологической карте: П- познавательные УУД; К- коммуникативные; Р- регулятивные; Л-личностные Ход урока: |
| Этапы урока | Деятельность |
| учителя | ученика |
| ЭТАП 1. Организационный этап | Здравствуйте, дети. Здравствуйте уважаемые гости. Я рада вас видеть. Кто сегодня дежурный? Назовите отсутствующих. Сегодняшнее число? (учитель записывает число на доске). Совершенно верно. Итак, начинаем наш урок. Сегодня у нас не совсем обычный урок, потому что его мы будем вести вдвоём: Домрачева Л.М.( учитель химии) и Давыдова В.А.(учитель математики). Просим вас по ходу урока активно работать. Слайд №1. Эпиграфом к уроку мы взяли слова: Н.И. Лобачевского «Математика – это язык, на котором говорят все точные науки» (говорит учитель математики) М.В. Ломоносова «Далеко простирает химия руки свои в дела человеческие» (говорит учитель химии). | 1.Приветствуют учителя. Готовятся к уроку: в тетрадях записывают число и классная работа. 2.Смотрят на слайд презентации. 3.Отвечают на вопрос учителя. |
| ЭТАП 2. Вхождение в тему урока и создание условий для осознанного восприятия нового материала | Учитель математики: В курсе школьной математики изучают различные практические, текстовые задачи. Давайте вспомним их и кто мне подскажет типы этих задач? (ведётся диалог). Посмотрим на слайд. Слайд №2: Задачи на числа Задачи на движение Задачи на работу Задачи на бассейн и трубы Задачи на растворы, смеси и сплавы Скажите: какой тип задач более связан с химией? (Высказывания детей) Да! Ближе всех к химии задачи на растворы, смеси и сплавы. Какие слова навели вас на правильный ответ? (ответы детей). Слайд №3 Когда мы решаем такие задачи на уроке математики, то нам не хватает химического обоснования этих задач. | 1.Ученики отвечают на вопросы учителя: 1. Какие типы текстовых задач решаем в школьном курсе математики? 2.Какой тип задач более связан с химией? 3.Какие слова навели вас на правильный ответ?
|
| ЭТАП 3. Актуализация знаний. Постановка цели и задач урока. Мотивация учебной деятельности учащихся. | Учитель математики: Давайте мы с вами подумаем и сформулируем цель урока: чем же сегодня будем заниматься на уроке математики? И почему мы сегодня пригласили учителя химии? (Учитель подводит ответы детей к проблеме: Решали или нет такого типа задачи на уроках химии и математики? И что же предстоит сделать на этом уроке? Актуальны ли эти задачи? Учитель помогает сформулировать тему и цель урока). Итак, мы пришли к цели урока: - Вспомним, обобщим, свяжем решение задач на растворы, сплавы и смеси с химическими понятиями и, конечно же, будем искать более простое и оригинальное решение. Слайд №4 А нужно ли нам это? Актуальны ли эти задачи? Для чего же нужно уметь решать такие задачи? (Учитель подводит диалог с учащимися к ответам: - Для успешной сдачи ОГЭ и по химии и по математике. - Для дальнейшей нашей жизни и деятельности.). Запишем тему урока: Систематизация и обобщение знаний по решению задач на растворы и смеси при подготовке к ОГЭ (учитель математики записывает тему на доске). А для старта нам необходима небольшая «разминка» по математике (проводится устный счёт по теме «Проценты»): Посмотрите на слайд, и проведём небольшой устный счёт. (Слайд №5: Понятие «процент». Предоставлены примеры на темы: Перевод процентов в десятичную дробь и десятичной дроби в проценты. Как найти процент от числа? Как найти число по его части?). Учитель химии: Чтобы хорошо решать задачи на растворы и сплавы мы с вами проведём «разминку» и по химии. (Ученики отвечают на вопросы учителя химии, вспоминая понятия и определения.) При опросе используется слайд. Учитель химии дополняет вопросами по используемым терминам и понятиям из химии, которые будут использоваться в задачах. • Что такое раствор? • Что такое растворитель, и какой наилучший биологический растворитель? • Понятие «сухое вещество»? • Что такое массовая доля? • Слайд №6 | 1.Отвечают на вопросы учителя математики. 2.Делятся мнениями на поставленную проблему. 3.Выдвигают гипотезу. 4.Формулируют с помощью учителя математики тему урока и цель урока. 5.Отвечают на вопросы учителя химии. |
| ЭТАП 4. Применение знаний решения задач на растворы в реальной жизни. | Учитель математики: Размялись, а теперь за задачи на растворы: К доске пойдут Григорьева Л., Чиндина Н., Горшкова Т.(Всем троим предстоит решить одну и ту же задачу, но только применяя указанный на листочке метод. Эта задача №1 из раздаточного материала к уроку, которая есть у каждого ученика на его столе. Учитель математики контролирует решение и оформление решения на доске). Учитель химии: Пусть они решают задачи, а мы с вами поговорим о применении задач на растворы в жизни и деятельности человека. Слово предоставим Богдану и Даше. Богдан: Слайд №7 У нас дома есть скутер и машина. И мне часто приходится слышать об аккумуляторах и электролите. Что это такое? В чём могут быть проблемы? Как их решить? И нужно ли мне это знать? Учитель химии: Ответ: (в виде диалога учителя химии с учениками). Конечно, всё готовое в наше время можно купить в специализированных магазинах, но знать, с чем имеешь дело, должен каждый. Бывают моменты, когда магазина рядом нет, а проблема есть и необходимо её решить. - Кто знает: Что такое электролит? - Электролит - это раствор солей, щелочей и кислот. - Что такое кислотный электролит? - Раствор концентрированной серной кислоты H2SO4 в дистиллированной воде H 2O. Слайд №8 - Для чего он используется? - Электролит в аккумуляторе является средой, в которой происходят химические реакции, позволяющие накапливать электрическую энергию и отдавать её. Слайд №9 и Слайд №10 Богдан, ты понял, что такое электролит? А как приготовить электролит, ты к концу урока поймёшь сам. А на следующем слайде указана одна из проблем, которая может возникнуть с аккумулятором. Эта проблема представлена в виде задачи. Слайд 11: Задача: Приготовить 980 граммов кислотного электролита для аккумулятора, имея 98% раствор серной кислоты H2SO4 . Сколько нужно взять воды H2O и серной кислоты H2SO4, чтобы получить 37%-ный раствор электролита? Теперь послушаем Дашу Сергееву. Даша: А меня интересует, как решить вот такую задачу: Слайд 12 Как из 78%-ной уксусной эссенции в домашних условиях приготовить 9%-ный уксус. И для чего в заготовках на зиму используют уксус? Ответ: (в виде диалога: учитель химии и ученики) Уксус является ингибитором, т.е. замедлителем химических процессов. В качестве ингибиторов мы используем растворы соли и сахара. Учитель математики: Задачи-проблемы Богдана и Даши мы увидели. Как видите это задачи из нашей повседневной жизни. Но решать мы их сейчас не будем. В конце урока вы сами сможете помочь им решить их задачи, применяя выбранный вами способ решения. | 1.Делятся мнениями на поставленную проблему. 2.Работают с химическими определениями и понятиями. 3.Отвечают у доски по заданиям на слайдах. |
| ЭТАП 5. Организация и самоорганизация учащихся в ходе дальнейшего обобщения и систематизации знаний материала. Практикум. | Учитель математики: А сейчас рассмотрим алгоритмы решения задач, в которых фигурируют растворы. Ученики-консультанты по химии и математике подготовили нам решение задачи №1, которая есть на каждом столе. Вначале мы с вами ознакомимся с текстом. (Читает вслух один из учеников) Задача №1: Смешали 30%-ный раствор соляной кислоты с 10%-ным раствором и получили 600г 15%-ного раствора. Сколько граммов каждого раствора было взято? Решение задачи №1: Алгебраический способ(слово предоставлено ученикам у доски): (Учитель руководит последовательностью защиты метода решения задачи №1с помощью системы уравнений с двумя переменными). | № р-ра | Масса р-ра в граммах | «Сухое вещество» в % | «Сухое вещество» в граммах | | 1 | х | 30% = 0,3 | 0,3х | | 2 | у | 10% = 0,1 | 0,1 * у | | 3 | 600 | 15% = 0,15 | 0,15 * 600 = 90 | Составляем систему уравнений: х + у = 600, 0,3х + 0,1 * у = 90; выразив из первого уравнения У через Х и подставив во второе уравнение полученный результат получим уравнение: 0,3х + 0,1 * (600 - х) = 90 0,3х + 60 - 0,1х = 90 0,2х = 30 Х = 30 / 0,2 Х =300 / 2 Х = 150 (г) – масса 1 р-ра Тогда У= 600 – Х = 600 – 150 = 450 – масса 2 р-ра Ответ: 150г.; 450г. Учитель химии: Теперь предоставим решение «химикам» (Учитель руководит последовательностью защиты метода решения задачи №1 химическим способом): Химический способ: Дано: 1 = 30% = 0,3 (массовая доля) = m (сух. в-ва) / m(р-ра) 2 = 10% = 0,1 m3(сух. в-ва) = * m3(р-ра) = 0,15 * 600 = 90(г) 3 = 15% = 0,15 m1(р-ра) = х m3 = 600г m2(р-ра) = 600 - х m1 = ? m1 (сух. в-ва) = 0,3х m2 = ? m2 (сух. в-ва) = 0,1 * (600 - х) Составляем уравнение: m1 (сух. в-ва) + m2 (сух. в-ва) = m3(сух. в-ва) подставляя значения масс, получим уравнение: 0,3х + 0,1 * (600 - х) = 90 0,3х + 60 - 0,1х = 90, 0,2х = 30 Х = 30 / 0,2 Х =300 / 2 Х = 150 (г) – масса 1 р-ра 600 – 150 = 450 – масса 2 р-ра Ответ: 150г.; 450г. Учитель математики: (учитель руководит последовательностью защиты метода решения задачи №1 математическим с помощью уравнения ): | № р-ра | Масса р-ра в граммах | «Сухое вещество» в % | «Сухое вещество» в граммах | | 1 | х | 30% = 0,3 | 0,3х | | 2 | 600 - х | 10% = 0,1 | 0,1 * (600 - х) | | 3 | 600 | 15% = 0,15 | 0,15 * 600 = 90 | 0,3х + 0,1 * (600 - х) = 90 0,3х + 60 - 0,1х = 90 0,2х = 30 Х = 30 / 0,2 Х =300 / 2 Х = 150 (г) – масса 1 р-ра 600 – 150 = 450 – масса 2 р-ра Ответ: 150г.; 450г. Сравним решение задачи всеми способами. Кто может сделать вывод? (Учитель предлагает сделать выводы. Организует обсуждение результатов.) ВЫВОД: Разница в решении в том, что в математике - схема, а в химии – описание и формула расчёта, а уравнение для расчёта одно и то же. Может быть стоит совместить решения? А это будет выглядеть так: | № р-ра | m(р-ра)в граммах*(массовая доля)=m (сух. в-ва) | | 1 | х | 30% = 0,3 | 0,3х | | 2 | 600 - х | 10% = 0,1 | 0,1 * (600 – х) | | 3 | 600 | 15% = 0,15 | 0,15 * 600 = 90 | В тетрадях пишем № задачи и перепишем обобщённую таблицу. Запишем уравнение: 0,3х + 0,1 * (600 - х) = 90 и ответ: 150г.; 450г. | 1.Выполняют задание №1 письменно, применяя последнюю обобщённую схему. 2.Делятся мнениями на поставленную проблему. 3.Работают с определением молярной массы и концентрации. 4.Делают выводы в выборе метода решения, в выборе схемы решения, учитывая знание формул по химии и химических обозначений.
|
| ЭТАП 6. Новое, давно забытое старое. Или арифметический способ решения задач на растворы. | Существует ещё один способ решения задач такого типа – это арифметический способ. Этот способ более приближён к реальной жизни и его иногда называют «решение крестом». Решим арифметическим методом задачу №1. Текст у вас есть. (Учитель, составляя схему решения данной задачи, читает каждую строчку. Комментирует каждую запись. Попутно отвечая на возникшие вопросы.) Задача №1 Смешали 30%-ный раствор соляной кислоты с 10%-ным раствором и получили 600 г 15%-ного раствора. Сколько граммов каждого раствора было взято? Решение: Итак, читаем условие задачи №1 и составляем в тетради схему по условию задачи: 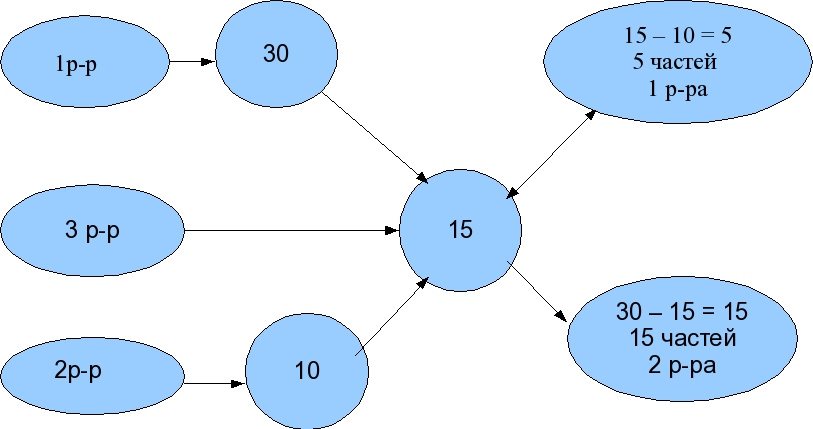 Числа 5 и 15 – это части! первого и второго растворов Отношение 5 : 15 или, упрощая получим 1 : 3. Т.е. взяв 1 часть 1 р-ра и 3 части 2-го р-ра получим третий раствор нужной концентрации. Значит в третьем растворе массой 600 граммов 1 +3 = 4 части. Отсюда следует: (600 : 4) * 1 = 150(г) – масса 1 раствора, (600 : 4) * 3 = 450(г) – масса 2 раствора, Ответ: 150г, 450г Теперь читаем задачу №2 и, вместе со мной учимся записывать решение « крестом» этой задачи. Итак, читаем условие задачи №2 (учитель просит ученика прочитать задачу) и составляем в тетради схему по условию задачи самостоятельно. А теперь проверим себя (учитель составляет схему пошагово для этой задачи): 1р-р 30 50 – 45 = 5(частей) 3 р-р 45 2 р-р 50 45 – 30 = 15(частей) Числа 5 и 15 – это части! первого и второго р-ров берём отношение 5 : 15 или 1 : 3. Ответ: 1 : 3 | 1.Выполняют задание №1и №2 письменно, применяя предложенную схему арифметического решения. 2.Делятся мнениями. 3.Работают в парах. 4.Делают выводы в выборе решения для данного типа задач. |
| ЭТАП 7. Первичная проверка полученных результатов. Коррекция. | Наконец пришло время помочь Богдану и Даше справиться с их проблемой. Их задачи – это №3, №4 на карточках. Попробуем поработать в парах: по вариантам. Слайд №13(самостоятельная работа). (учителя проверяют правильность решения тех, кто быстрее справился с заданием, и оценивают их) А теперь обменяемся тетрадями, сверим решение и найдём ошибки: Слайд №14(решебник) Задача: Как из 78%-ной уксусной эссенции в домашних условиях приготовить 9%-ный уксус? Решение: 1 р-р: 78%(эссенция) 9 – 0 = 9(частей) 3 р-р 9% 2 (р-р) вода 0% 78 – 9 = 69 (частей) Итак 9 : 69 или 3 : 23. Ответ: 3 : 23. Слайд №15 Задача: Приготовить 980 граммов кислотного электролита для аккумулятора, имея 98% раствор серной кислоты H2SO4 . Сколько нужно взять воды H2O и серной кислоты H2SO4, чтобы получить 37%-ный раствор электролита? Решение: . H2SO4 98% 37 – 0 = 37(частей) Электролит(980г) 37% H2O 0% 98 – 37 = 61(частей) 980 : (37+61) * 37 = 980 : 98 * 37 = 370(г) - кислоты, 980 : 98 * 61 = 610(г) – воды Ответ: 370г (H2SO4) , 610г (H2O). Слайд №16(цель урока) Всё выполнено? Обратите внимание на последний пункт: поиск более простого решения задач. Да, мы познакомились с необычной схемой решения для одного из видов химических задач на растворы и смеси, схема «креста». Для других видов задач, может быть, вы придумаете или найдёте схемы сами? Всё в ваших руках. | Работа с карточками-заданиями: задачи №3 и №4. |
| ЭТАП 8. Информация о домашнем задании, инструктаж по его выполнению. | А теперь запишем домашнее задание: у каждого на столе лежат карточки с домашним заданием, положите в дневник. На обратной стороне листка написан № 971 – это «для тех, кто хочет знать больше». | Задание: 1 уровень: на карточках две задачи - это для всех. 2 уровень: на карточках две задачи + № 971 - для более сильных. |
| ЭТАП 9. Рефлексия (Подведение итогов занятия) | Учитель математики: Мне хочется сказать вам дети, что вы все сегодня на уроке работали замечательно. Сегодня кого нам хочется похвалить?… Я с вами согласна. В тетради некоторым из вас поставлены оценки за решение задач в самостоятельной работе. Я их выставила в журнал. Можете подать дневники. А кто хочет тоже себя похвалить пусть за самое маленькое, но открытие для себя, вам наши аплодисменты. А кому сегодня не повезло, то повезёт потом, нужно только постараться. Учитель химии: Я сегодня тоже поставила оценки некоторым ребятам(называет детей), я им поставила уже в дневник, во время самостоятельной работы. Спасибо за урок, дети! Учитель математики: А сейчас, ребята, мы бы хотели узнать мнение об уроке. Для этого заполните, пожалуйста, листочки со смайликами и на переменке мне их на стол. До свидания. | Приём «Смайлики»: Суть - зафиксировать свои достижения на уроке: Я понял… Я пропускаю ход |
| Приложение: | Задания на карточке к уроку (на каждый стол):
1. Смешали 30%-ный раствор соляной кислоты с 10%-ным раствором и получили 600 г 15%-ного раствора. Сколько граммов каждого раствора было взято? 2. Смешали 30%-ный и 50%-ный растворы азотной кислоты и получили 45%-ный раствор. Найдите отношение массы 30%-ного раствора к массе 50%-ного раствора, взятых первоначально. 3. Задача: Приготовить 980 граммов кислотного электролита для аккумулятора, имея 98% раствор серной кислоты H2SO4 . Сколько нужно взять воды H2O и серной кислоты H2SO4, чтобы получить 37%-ный раствор электролита? 4. Задача: Как из 78%-ной уксусной эссенции в домашних условиях приготовить 9%-ный уксус? |

















