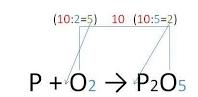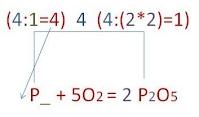-
Тема: Закон сохранения массы веществ. Химические уравнения. Значение индексов и коэффициентов. Составление уравнений химических реакций.
Цель урока: Сформировать понятие закона сохранения массы веществ, научить составлять химические уравнения реакции.
Задачи урока:
• Образовательная: Сформулировать представления о законе сохранения массы веществ, объяснить значение закона.
• Развивающая: Дать понятие о химическом уравнении как об условной записи химической реакции с помощью химических формул; начать формирование навыков составления химических уравнений
• Воспитательная: Привить интерес к химии, расширить кругозор.
Тип урока. Комбинированный.3. Актуализация опорных знаний и умений у учащихся:
Предлагаю вам этюд. Обратите внимание на то, какие физические и химические явления упоминаются в этюде?
а) Зима. На улице стужа. Воет ветер, словно голодный зверь. Мороз-художник изобразил на оконном стекле причудливые узоры. А в избе тепло! Жарко горят поленья дров в печи. Вскипел самовар. Пора за стол. А на столе и соленья, и варенья: квашеная капуста, моченые яблочки, из вчерашнего молока поспела простокваша. Назовите физические и химические явления, которые упоминаются в этюде. Аргументируйте свой ответ.
- Что такое физические явления?
- Что такое химические явления?
- Примеры физических и химических явлений
- Условия протекания химических реакций
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Закон сохранения массы веществ. Химические уравнения. Значение индексов и коэффициентов. Составление химических урвнений
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Закон сохранения массы веществ. Химические уравнения. Значение индексов и коэффициентов. Составление химических урвнений»
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1770 руб.
2530 руб.
1930 руб.
2760 руб.
2200 руб.
3140 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства