Расширяются и углубляются знания по типам расчетных задач. Задачи на смеси в школьном курсе рассматриваются в малом объеме. На данном уроке задачи на смеси классифицируются по нескольким признакам. Приводятся примеры на каждый случай и предлагаются задачи для самостоятельного решения. Решения задач на смеси можно применять при изучении любых элементов и их соединений периодической системы.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Задачи на «смеси», «материальный баланс»
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Задачи на «смеси», «материальный баланс» »
Полезное для учителя
Распродажа видеоуроков!
1660 руб.
2760 руб.
1660 руб.
2760 руб.
1880 руб.
3140 руб.
1700 руб.
2840 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства
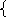
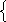
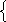 24х + 42у = 6,4 х = 0,0334 моль m (NaH) = 0,8 г
24х + 42у = 6,4 х = 0,0334 моль m (NaH) = 0,8 г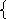
 х + у = 1,6 х = 1,2 моль х : у = 1,2 : 0,4 = 3 : 1
х + у = 1,6 х = 1,2 моль х : у = 1,2 : 0,4 = 3 : 1















