Мы постоянно занимаемся решением задач , поводим семинары для учителей и учеников.В работе представлены задачи на нахождение молекулярной формулы только одного вида, такие задачи используются не только на уроке, но и на факультативных занятияхи при подготовке к олимпиадам.Они способствуют развитию мышления, помогают определять фориулы и свойства органических веществ, хотя аналогичные задачи применяются и про работе с неорганическими веществами.В задачниках для школы мало задач такого типа, поэтому я поставила цель -подобрать разнообразные задачи на нахождение молекулярной формулыи проработать разнообразные методы их решения, поэтому в работе рассмотрены общепринятые методы и наши.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Вывод формул органических веществ по продуктам сгорания табличным методом
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Вывод формул органических веществ по продуктам сгорания табличным методом »
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
2200 руб.
3140 руб.
1990 руб.
2840 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства
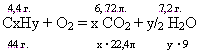
 44г 18г
44г 18г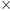 29 = 30
29 = 30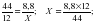 Х = 2,4г
Х = 2,4г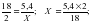 Х = 0,6
Х = 0,6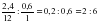 ;= С2Н6
;= С2Н6














