1 пара.
Все элементы делятся на металлы и неметаллы. Из 107 элементов 85
относятся к металлам. К неметаллам относят следующие элементы: гелий, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, йод, астат, кислород , сера, селен, теллур, азот, фосфор, мышьяк, углерод, кремний, бор, водород.
Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы –металлические свойства.
Неметаллических элементов по сравнению к металлическими элементами относительно немного.
Неметаллические элементы в основном расположены вправой верхней части периодической системы. Так как в периодах слева направо у атомов элементов увеличивается заряды ядер и уменьшаются атомные радиусы, а в группах сверху вниз атомные радиусы также возрастают, почему атому неметаллов сильнее, чем атомы металлов, притягивают наружные электроны. В связи с этим у неметаллов преобладают окислительные свойства. Особенно сильные окислительные свойства, т.е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-мпериодах VI-VII групп. Говоря об активности элементов, то самый активный неметалл это фтор, так как неметаллические свойства с лева направо увеличиваются, а сверху вниз уменьшаются. Радиус атомов неметалла наоборот сверху вниз увеличивается, так как увеличивается атомная масса элемента. Валентность элементов соответствует группе элементов.
Пример: Если углерод находится в четвертой группе, то и валентность элемента равна четырем.
. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличивается в следующем порядке:Si, B, H, P, C, S, I, N, Cl, O, F. Следовательно, энергичнее всего взаимодействует с водородом и металлами фтор:
H2 + F2 ( 2HF
Менее энергично реагирует кислород:
2H2 +O2 ( 2H2 О
Фтор – самый типичный неметалл, которому нехарактерны восстановительныесвойства, т.е. способность отдавать электроны в химических реакциях.
Кислород же, судя по его соединениям с фтором, может проявлять и
положительную степень окисления, т.е. являться восстановителем.
Все остальные неметаллы проявляют восстановительные свойства. Причемэти свойства постепенно возрастают от кислорода к кремнию: O, Cl, N, I, S,C, P, H, B, Si. Так, например, хлор непосредственно с кислородом несоединяется, но косвенным путем можно получить его оксиды (Cl2 O, ClO2 ,Cl2O2 ), в которых хлор проявляет положительную степень окисления. Азот привысокой температуре непосредственно соединяется с кислородом и,следовательно, проявляет восстановительные свойства. Еще легче с кислородомреагирует сера: она проявляет и окислительные свойства.
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуюткак одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не
реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это H2, F2, Cl2, Br2,I2 (элементы VII группы Периодической системы ), а также кислород O2 и азотN2. Из трехатомных молекул состоит газ озон (O3).
2 пара.
Такие простые вещества, как озон (аллотропная модификация) и кислород, имеющие одинаковый качественный состав (оба состоят из одного и того же элемента - кислорода),
но различающиеся по числу атомов в молекуле, имеют различные свойства. Так,кислород запаха не имеет, в то время как озон обладает резким запахом,который мы ощущаем во время грозы. Свойства твердых неметаллов, графита и алмаза,(аллотропная модификация углерода) имеющих также одинаковый качественный состав, но разное строение, резко отличаются (графит хрупкий, алмаз твердый). Таким образом, свойства вещества определяются не только его качественным составом, но и тем, сколько атомов содержится в молекуле вещества и как они связаны между собой.
Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях: газы (благородные газы:He, Ne, Ar, Kr, Xe, Rn;водород H2, кислород O2, азот N2, фтор F2, хлор Cl2.), жидкость (бром Br2) , твердые вещества( йод I2, углерод C, кремний Si, сера S, фосфор P и др.). Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью.
3 пара.
1. Окислительные свойства неметаллов проявляются при взаимодействии с металлами
4Al + 3C = Al4C3
2. Неметаллы играют роль окислителя при взаимодействии с водородом
H2 + F2 = 2HF
3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО
2P + 5S = P2S5
4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами
CH4 + 2O2 = CO2 + 2H2O
5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами
2FeCl2 + Cl2 = 2FeCl3
6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом
4P + 5O2 = 2P2O5
7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями
S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
8. Наиболее сильные восстановительные свойства имеют углерод и водород
ZnO + C = Zn + CO;
CuO + H2 = Cu + H2O
9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования)
Cl2 + H2O =HCl + HClO
Сера
Сера является жизненно важным элементом для живых организмов, является составной частью белка. Он способствует нейтрализации в организме ядовитых веществ, роста хрящевой и костной тканей, кожи, волос, ногтей. Вместе с другими компонентами участвует в формировании структуры соединительной ткани. Обеспечивает ее эластичность, улучшает проницаемость клеточных мембран. Дефицит серы может привести к нарушению синтеза инсулина. Кожа становится сухой, морщинистой, появляются трещины, наступает раннее старение организма. Серу используют для извлечения серной кислоты, изготовление резины из каучука, производства спичек, черного пороха, лекарственных препаратов.
Азот
Азот используют для наполнения электролампочек, создания инертной среды при сварке металлов, в вакуумных установках, глубокого охлаждения и замораживания, добыча аммиака, азотной кислоты, нитратов
Фосфор
Фосфор в организме является источником энергии. В промышленности для создания моющих средств, для смягчения воды. Фосфорорганические соединения для борьбы с сорняками. Фосфиды — как полупроводники. Образование красок (грунтовка). Белый фосфор для производства авиабомб, снарядов, раньше изготавливали статуэтки, в часах, добыча Н3РО4, добыча твердого сплава фосфористой бронзы. Красный фосфор для изготовления спичек, дымовых завес, фосфорорганических соединений, полимеров, против коррозии, полупроводников, для уничтожения насекомых.
Уголь
Уголь для выплавки чугуна и стали, производство черного пороха, красок, для поглощения газов, очистки их. Активированный уголь — в медицине в качестве адсорбента, для изготовления противогазов, как катализатор, для очистки сахара от примесей, улавливания ценных органических растворителей
Хлор
Хлор применяют для производства соляной кислоты, винилхлорида, каучука и многих органических веществ и пластмасс, в текстильной и бумажной промышленности используют в качестве отбеливающего средства, в быту – для обеззараживания питьевой воды.
Кремний
Кремний в электронике и электротехнике для изготовления диодов, фотоэлементов, транзисторов, сплавов. Кремний оксид широко используется в строительстве, для производства цемента, керамики, стекла.
6 пара
Задание № 2. Дайте характеристику сере по плану
А) химический знак..
Б) порядковый номер
В) атомная масса
Г) период (малый, большой
Д) группа (подгруппа: главная или побочная
Е) Строение атома (заряд ядра, число протонов, электронов, нейтронов, электронная формула).
И) формула оксида
К) формула летучие водородные соединения
5 пара
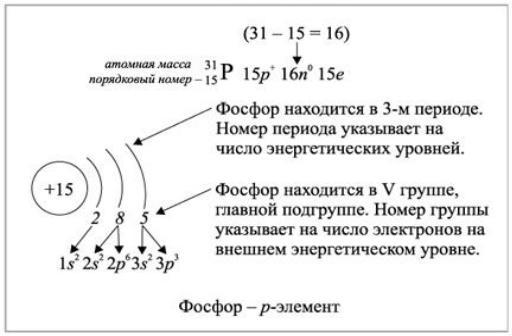
Задание № 1. Написать схему электронного строения атомов неметаллов S, N
































