Развернутый конспект урока
Учитель химии: Калеева Светлана Вениаминовна
№ урока
Класс: 9 А
Тип урока: урок изучения нового материала и совершенствование основных знаний, умений, навыков.
Тема « Фосфор- элемент жизни и мысли»
Цели: А. Образовательные
Способствовать формированию умения учащихся давать сравнительную характеристику элементов с помощью периодической систему Д.И. Менделеева.
Продолжить формирование понятия аллотропия (на примере аллотропных модификаций фосфора)
Продолжить формирование умения учащихся давать характеристику окислительно-восстановительных свойств элементов на основании строения атомов этих элементов. (На примере фосфора)
Познакомить учащихся с биологическим значением фосфора в жизни растений, животных и человека.
Б. Развивающие
Способствовать формированию учебно-познавательных компетенций, (способность самостоятельно планировать и организовывать свою деятельность, приобретать знания из различных источников;
умение структурировать информацию), навыков логического мышления (умения сравнивать, обобщать, делать выводы)
Способствовать формированию информационных компетенций (самостоятельно искать, извлекать , анализировать и отбирать информацию ).
Способствовать формированию критичности мышления.
В. Воспитательные
Формирование устойчивой положительной мотивации к изучению химии
Формирование здоровьесберегающей компетенции: позитивно относиться к своему здоровью;
Технологии:
коммуникативный метод обучения
технология обучения в сотрудничестве;
информационная образовательная;
Методы обучения: проблемно-коммуникативный
Методические приёмы: групповой, творческий, интерактивный
Оборудование и материалы: интерактивная доска, проектор, презентация Power Point, раздаточный материал, реактивы (соль фосфорной кислоты, соли серебра), периодическая система Д. И. Менделеева, видеомагнитофон, Фильм «Фосфор»
Повторение прошлого материала: (вопросы на слайде №1)
1.Как изменяются неметаллические свойства в группе: А)усиливаются, Б)ослабевают,
В)не изменяются,
2.Выбрать элемент, который проявляет больше неметаллические свойства: А)фосфор, Б)азот,
В) мышьяк
3. С увеличением порядкового номера в пределах главной подгруппы электроотрицательность:
А) уменьшается, Б)не изменяется, В) Увеличивается
4.Неметаллы в большей степени проявляют свойства: А) восстановительные, Б) окислительные,
В) нейтральные
5.Химическая активность у неметаллов в группе : А) снижается, Б) повышается, В) не изменяется
I. Мотивация учащихся
Учитель химии: Здравствуйте, ребята! Мне приятно видеть вас сегодня на уроке, где нам предстоит познакомиться с веществом, его соединениями, существование которых долгое время было окутано тайной. Но прежде чем открыть тайну, хотелось бы знать ваше настроение в начале урока и после изучения материала. Для этого обозначьте любой цветовой карточкой свое восприятие начала урока (учитель комментирует результаты и сообщает, что настроение у ребят такое хорошее, что на уроке все должно получиться также хорошо).
Мы продолжаем изучение главы “Неметаллы”. И тема нашего урока – “Фосфор”.
Обратите внимание на эпиграф: “Фосфор – элемент жизни и мысли”. Академик А.Е.Ферсман.
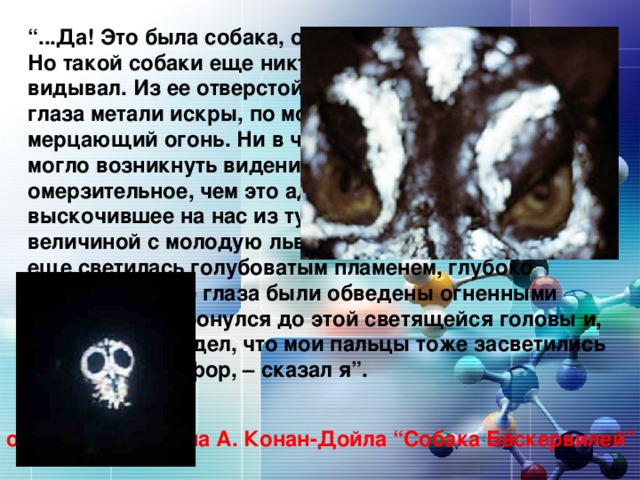
Учитель :давайте просмотри отрывок из фильма собака баскервили!
зачитывает отрывок из романа А.Конан-Дойла “Собака Баскервилей”.
“...Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее отверстой пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьем воспаленном мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана... Страшный пес, величиной с молодую львицу. Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор, – сказал я”.
Изучение нового материала:
Итак, увы сейчас делитесь на группы: используем учебник станица № 58 §18
1 Группа: творческое задание ( Опережающее)-историческое открытие-Бухарина Ирина- Показ слайдов
2 группа: Строение атома, степень окисления.
3 группа: Распространение в природе (месторождение в РК) карта,атлас.
4 группа: Физиологическое значение для организма –опережающее задание ( слайды)
5 группа: Получение (уравнение на доске написать)
6 группа: физические свойства белого фосфора (заполнение таблицы)
7 группа: физические свойства красного фосфора (заполнение таблицы)
8 группа: Химические свойства фосфора (уравнения)
9 группа: качественная реакция на фосфат –ионы. (опыты с уравнениями)
10 группа: применение –опережающее задание ( слайды)
Открытие фосфора
Фосфор открывали несколько раз. Причем всякий раз получали его из … мочи. Есть упоминания о том, что первооткрывателем фосфора был арабский алхимик Альхильд Бехиль (XII век), перегонявший мочу с глиной, известью и углем. Но все же годом открытия фосфора считается 1669-й.
Гамбургский алхимик-любитель Хеннинг Бранд, разорившийся купец, хотел с помощью алхимии поправить свои дела и в поисках “философского камня” и проводил опыты с разными веществами. Он собрал около тонны мочи из солдатских казарм, выпарил, затем перегнал до образования твердого остатка, при нагревании которого образовалось вещество, ярко светившееся в темноте. Бранд назвал его фосфором, что в переводе с греческого означает “светоносец”. Способ получения фосфора держался в секрете. В третий раз фосфор открыл Р.Бойль в 1680 году.
В 1847 году А. Шреттер получил красный фосфор, нагревая белый фосфор без доступа воздуха до 300 °C, который в отличие от белого, не был ядовит и не воспламенялся на воздухе. В 1934 году Л. Бриджмен, подвергнув фосфор нагреванию при значительном давлении, получил третью модификацию – черный фосфор.
Строение атома фосфора: Вспомним все, что мы знаем об элементе фосфоре, исходя из его положения в Периодической системе химических элементов Д.И.Менделеева.
Работая с ПСХЭ,учащиеся характеризуют фосфор и приходят к выводу: Р- неметалл 5 группы и 3 периода, имеющий 5 валентных электронов на внешнем энергетическом уровне. Ему соответствует высший оксид кислотного характера Р2О5 и летучее водородное соединение фосфин РН3. Высшая и низшая степени окисления +5 и -3 соответственно, следовательно, проявляет как окислительные, так и восстановительные свойства. Самая устойчивая степень окисления в соединениях +5.
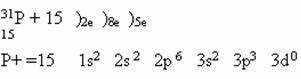
Распространение в природе:
в земной коре – 0,1%, важнейшие минералы – фосфорит (Са5(РО4)3(ОН,СО3)), апатит (Са5(РО4)3(F,Cl));
в растительности – в белках семян;
в животных организмах:
Месторождение в РК
В 1935 году в горах Каратау Жамбылской области было обнаружено богатое месторождение фосфорных соединений.
В Казахстане работают фосфорные заводы в Таразе, Шымкенте, в Актюбинской области.
Физиологическое значение на организм человека:
Р - фосфор - содержится 780 г (70кг) суточная доза 2 г.
Биологическая роль:
1. В состав скелета, зубов. 1,4 кг – в костях,130 г – в мышцах,13 г в нервной ткани.
2. Участвует в обмене энергии.
3. Он нужен для нормальной мышечной и умственной деятельности.
Источники: рыба, хлеб, молоко, сыр, мясо, бобовые (горох, фасоль, крупы). В растениях меньше.
СЕМЕНА ПОДСОЛНУХА(30 г — 21%)
ЦЫПЛЯТА (100 г — 20%)
ЯЙЦА 2 штуки (100 г) — 17%)
ГОВЯЖЬЯ ПЕЧЕНЬ (100 г — 29%)
Недостаток: развивается рахит, снижение умственной и мышечной деятельности.
Избыток: мочекаменная болезнь, соединения токсичны, очень опасные ожоги, возникающие при горении фосфора.
3) Фосфор как простое вещество. Аллотропные возможности фосфора
(работа с учебником в 3 вариантах по характеристике 3 аллотропных модификаций фосфора – красного, белого и черного)
Красный фосфор – темный красно-малиновый порошок. Не растворяется ни в воде, ни в органических растворителях. На воздухе окисляется медленно и не самовоспламеняется. Не ядовит и не светится в темноте.
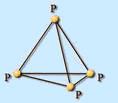
Белый фосфор – вещество с молекулярной кристаллической решеткой, состоящей из 4-х атомов в молекуле: P4. Нерастворим в воде, хорошо растворяется в органических растворителях. На воздухе легко окисляется, а в порошкообразном состоянии воспламеняется. Очень ядовит. Светится в темноте. Хранят его под водой.
Черный фосфор –самая малоизученная модификация, имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, является полупроводником. Не ядовит, не светится в темноте.
По химической активности можно выстроить три разновидности в порядке возрастания чёрный фосфор – красный фосфор – белый фосфор.
Химические свойства фосфора.
На основе строения атома мы выяснили, что простое вещество – фосфор – довольно активный неметалл способен проявлять как окислительные, так и восстановительные свойства. Какими веществами и почему он проявляется себя в разных «лицах»
| Фосфор-восстановитель | Фосфор-окислитель |
| 1. Р+ О2 - Р2О5 | 1. Мg + P - Mg3P2 |
| 2. Р + Cl2 - PCl5 | 2. Na + P - Na3P |
| 3. P + KClO3 - Р2О5 + KCl | |
Задание: рассмотреть стр 58 уравнение в таблице с позиций окислительно-восстановительных реакций. Указать элемент окислитель и восстановитель.(проверка с использованием интерактивной доски)
Выводы формулируют сами учащиеся на основе полученного материала.
В качестве доказательства химической активности фосфора учитель демонстрирует опыт « Сжигание красного фосфора и исследование продуктов его сгорания» (Опыт)
Фосфор сжигается в ложечке, которая вносится в коническую колбу, заполняя ее густым белым дымом твердых частичек P2O5, затем приливается в нее вода и, закрыв пробкой, взбалтывается до полного растворения оксида фосфора (V) . Полученный раствор испытывается метиловым оранжевым или лакмусом, чем и доказывается образование в колбе фосфорной кислоты.
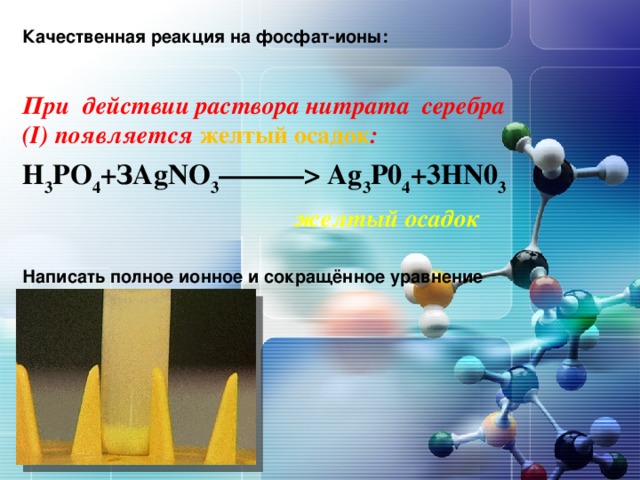
Для определения фосфат-ионов существует качественная реакция с использованием нитрата серебра, при этом выпадает осадок жёлтого цвета, который хорошо растворяется в сильных кислотах. Демонстрация опыта учителем.Запись уравнения реакции на доске (ученик):
Н3РО4 + AgNO3 = Ag3РО4 v + Н NO3
3Ag + + РО4 3- = Ag3РО4 v жёлтый фосфат серебра
Мечтая раздобыть свой философский камень,
Способный приоткрыть златые ворота,
Алхимик Бранд увидел синий пламень
И фосфором нарек его тогда.
Он “элементом мысли” будет назван,
Плодоношенье трав определит.
И даст начало удобреньям разным:
Природный фосфорит и апатит.
Двуликий фосфор: миф о нем развеян.
Он даст завесы дым – лишь только тронь.
Или в компании с стеклом и клеем
На спичке в коробке смирит огонь.
Применение:
1.Сельское хозяйство
2.пиротехника
3.изготовление спичек
4.органический синтез
Релаксация: на разноцветных листиках на писать телеграмму (по одному слову)
5. Фармацевтическое производство
6.Металлургическая промышленность
7.Производство минеральных удобрений
| Домашнее задание: §18 упр № 7
Тест по теме "Фосфор и его соединения" Вариант 1 1.Фосфор находится в группе номер: 2. Высшая степень окисления у фосфора равна: 3. Какие свойства у фосфора выражены сильнее: 4. Фосфор является восстановителем в реакции с: 5.Красный фосфор: яд неядовит растворим в воде светится в темноте
|
Тест по теме "Фосфор и его соединения" Вариант 2 1.На последнем внешнем энергетическом уровне у фосфора электронов: 2. Низшая степень окисления у фосфора равна: 3. Какие свойства у фосфора выражены слабее:
4. Фосфор является окислителем в реакции с: кислородом натрием хлором 5. Формулы высшего оксида и летучего водородного соединения элемента №15: ЭО2 и ЭН4 Э2О5 и ЭН3 ЭО3 и Н2Э Э2О7 и НЭ
|
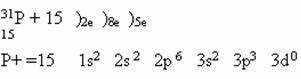












 Ag 3 P 0 4 +3 HN 0 3 желтый осадок Написать полное ионное и сокращённое уравнение" width="640"
Ag 3 P 0 4 +3 HN 0 3 желтый осадок Написать полное ионное и сокращённое уравнение" width="640"




















