Учебно-методический комплекс по химии на тему: «Металлы. Их свойства, значение и применение».
- Меню
- Главная
- Дошкольное образование
- Начальные классы
- Астрономия
- Биология
- География
- Информатика
- Математика
- Алгебра
- Геометрия
- Химия
- Физика
- Русский язык
- Английский язык
- Немецкий язык
- Французский язык
- История
- Естествознание
- Всемирная история
- Всеобщая история
- История России
- Право
- Окружающий мир
- Обществознание
- Экология
- Искусство
- Литература
- Музыка
- Технология (мальчики)
- Технология (девочки)
- Труд (технология)
- Физкультура
- ИЗО
- МХК
- ОБЗР (ОБЖ)
- Внеурочная работа
- ОРК
- Директору
- Завучу
- Классному руководителю
- Экономика
- Финансовая грамотность
- Психологу
- ОРКиСЭ
- Школьному библиотекарю
- Логопедия
- Коррекционная школа
- Всем учителям
- Прочее
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
- Главная
- Химия
- Уроки
- Учебно-методический комплекс по химии на тему: «Металлы. Их свойства, значение и применение».
Учебно-методический комплекс по химии на тему: «Металлы. Их свойства, значение и применение».
Просмотр содержимого документа
«Учебно-методический комплекс по химии на тему: «Металлы. Их свойства, значение и применение».»
Тема: «Химия металлов»
Технологическая карта комплекса
Цели: Образовательные: сформировать представления о металлах как химических элементах и металлах как простых веществах. Познакомить учащихся со строением и общими свойствами металлов, исходя из положения их в ПСХЭ и строения атомов.
Дать понятия о металлической связи и металлической кристаллической решетки, некоторые способы получения металлов. Обобщить знания учащихся о физических и химических свойствах металлов. Рассмотреть деление металлов на группы, изучить особенности свойств элементов первых трёх главных подгрупп (щелочных, щёлочноземельных и алюминий), а так же металлических d – элементов побочных подгрупп (на примере железа, марганца и хрома).
Развивающие: совершенствовать умения учащихся обобщать, делать выводы, анализировать, сравнивать, устанавливать причинно-следственную зависимость между составом, строением и свойствами веществ.
Воспитательные: создание условий для осознания необходимости грамотного отношения к своему здоровью и окружающей среде.
Межпредметные связи. Биология. Тема: «Неорганические вещества в клетке».
Химия в медицине. Тема: «Влияние тяжелых металлов на здоровье»
Методы: словесный, наглядный, проблемно-поисковый, контроль знаний.
Обеспечение занятия.
Наглядные пособия: таблица «Периодическая таблица», «Вытеснительный ряд металлов», образцы металлов, модели кристаллических решёток
Раздаточный материал: дидактические карточки, тестовые задания.
Оборудование: учебник, компьютер, мультимедиапрезентации, видеоролики.
Литератур основная:
1. О. Е. Саенко. Химия для колледжей: учебник .Ростов на Дону: Феникс, 2008
О. С. Габриелян, И. Г. Остроумов. Химия: учебник для студентов сред. Проф. Учебных заведений. М.: «Академия», 2008.
Литература дополнительная:
Н.Е. Кузьменко , В.В.Еремин, В.А. Попков Химия. Для школьников старших классов и поступающих в вузы: Учебное пособие. М.: Дрофа, 1999.
С.А.Пузаков , В.А.Попков. Пособие по химии для поступающих в вузы. М.:, Высшая школа, 2001.
М. А. Рябова, Р. В. Линко. Тесты по химии. М. : «Экзамен», 2006.
Интернет ресурсы
Студент должен знать: положение металлов в периодической системе, особенности строения их атомов; состав, свойства, получение и применение важнейших химических соединений металлов; общие и специфические свойства металлов главных подгрупп I — III групп; свойства представителей металлов побочных подгрупп периодической системы - железа, марганца и хрома; понятие о коррозии и способы защиты металлов от коррозии.
Студент должен уметь: составлять электронные формулы атомов металлов малыx и больших периодов; определять свойства металла в зависимости от его положения в электрохимическом ряду напряжений; находить сходство и различие в свойствах металлов одной группы; объяснять явление амфотерности на примере оксидов и гидроксидов алюминия; применять понятия: кристаллические решетки металлов, электрохимический ряд напряжений металлов; выполнять химические опыты, подтверждающие свойства изученных металлов и их важнейших соединений.
Распределение занятий по темам:
Положение металлов в периодической системе и особенности электронного строения их атомов. Физические и химические свойства металлов. Оксиды и гидроксиды металлов.
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И.Менделеева. Характеристика простых веществ и их соединений: натрий, кальций, алюминий.
Металлы побочных подгрупп (хром, марганец, железо). Свойства химических элементов. Характеристика важнейших соединений хрома, марганца, железа. Важнейшие сплавы железа: чугун, сталь.
Практическое занятие 5. Составление уравнений окислительно-восстановительных реакций с участием соединений алюминия, меди, железа, хрома, марганце. Расчетные задачи.
Химическая и электрохимическая коррозия металлов. Защита от коррозии.
Практическое занятие 6. Решение экспериментальных задач по теме "Металлы".
Содержание программы: Положение металлов в периодической системе и особенности электронного строения их атомов. Физические и химические свойства металлов. Оксиды и гидроксиды металлов. Химическая и электрохимическая коррозия металлов. Защита от коррозии. Общая характеристика металлов главных подгрупп I-III групп периодической системы химических элементов Д.И.Менделеева. Характеристика простых веществ и их соединений: натрий, кальций, алюминий. Природные соединения металлов 1-3 группы главных подгрупп и их применение. Металлы побочных подгрупп (хром, марганец, железо). Свойства химических элементов. Характеристика важнейших соединений хрома, марганца, железа. Их участие в окислительно-восстановительных реакциях. Важнейшие сплавы железа: чугун, сталь.
Самостоятельная работа:
Аудиторная форма работы:
отработка навыков составления конспекта;
формирование умения работать с учебной литературой, тестами, карточками;
составление уравнений химических реакций.
Внеаудиторная форма работы:
работа с конспектом лекций и текстом учебника;
работа с дополнительной литературой;
подготовка сообщений на темы:
Щелочные металлы. Алюминий. Медь. Хром. Железо.
Роль металлов в жизнедеятельности организма.
Роль металлов и сплавов в научно-техническом прогрессе.
Химия металлов в моей профессиональной деятельности.
Роль металлов в истории человеческой цивилизации.
Урок №
Тема: «Общие сведения о металлах»
План лекции
Положение металлов в периодической системе.
Особенности электронного строения их атомов.
Металлическая химическая связь. Металлическая кристаллическая решётка.
Физические свойства металлов
Химические свойства металлов.
Способы получения металлов.
Особенности электронного строения металлов.
Металлы - это химические элементы, атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя, превращаясь в положительные ионы. Металлы – восстановители Ме0 – nе = Меn+. Это обусловлено небольшим числом электронов внешнего слоя (в основном 1 - 3), большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Положение металлов в ПСХЭ.
Легко увидеть, что большинство элементов ПСХЭ – металлы (92 из 114).
Металлы размещены в левом нижнем углу ПСХЭ. Это все элементы, расположенные ниже диагонали В – Аt, даже те у которых на внешнем слое 4 электрона ( Je, Sn, Pb), 5 электронов ( Sb, Di), 6 электронов ( Po), так как они отличаются большим радиусом. 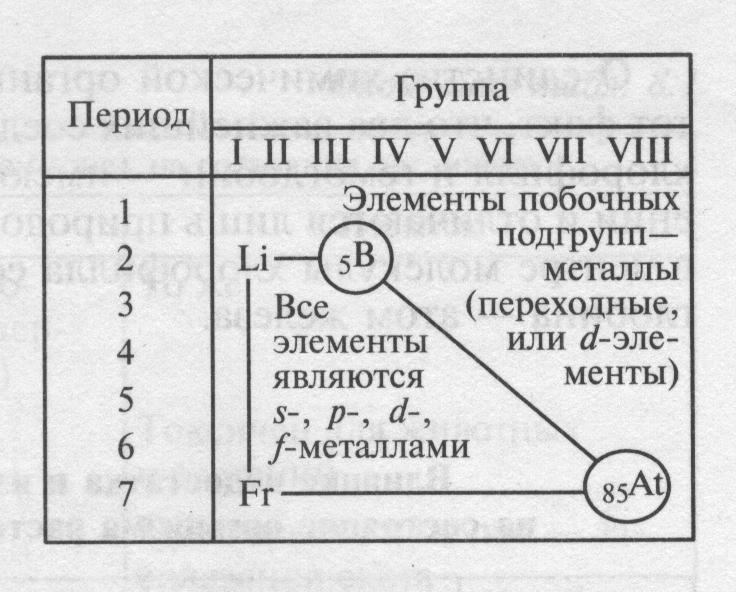 Среди них есть s и p-элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы.
Среди них есть s и p-элементы – металлы главных подгрупп, а также d и f металлы, образующие побочные подгруппы.
В соответствии с местом, занимаемым в периодической системе, различают переходные (элементы побочных подгрупп) и непереходные металлы (элементы главных подгрупп). Металлы главных подгрупп характеризуются тем, что в их атомах происходит последовательное заполнение электронных s- и р-подуровней. В атомах металлов побочных подгрупп происходит достраивание d- и f-подуровней.
Закономерности в изменении свойств элементов – металлов.
| Признаки сравнения
| В главной подгруппе | В периоде |
| Число электронов на внешнем слое | не изменяется | увеличивается |
| Радиус атома | увеличивается | уменьшается |
| Электроотрицательность | уменьшается | увеличивается |
| Восстановительные свойства | усиливаются | уменьшаются |
| Металлические свойства | усиливаются | уменьшаются |
У элементов – металлов побочных подгрупп свойства чуть-чуть другие.
В побочных подгруппах (Cu, Ag, Au) – активность элементов – металлов падает. Эта закономерность наблюдается и у элементов второй побочной подгруппы Zn, Cd, Hg. У элементов побочных подгрупп – это элементы 4-7 периодов – с увеличением порядкового элемента радиус атомов изменятся мало, а величина заряда ядра увеличивается значительно, поэтому прочность связи валентных электронов с ядром усиливается, восстановительные свойства ослабевают.
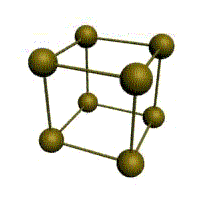
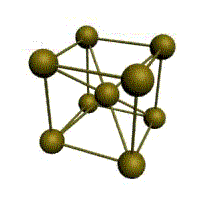
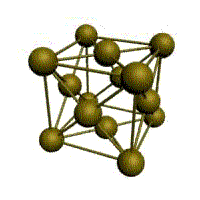
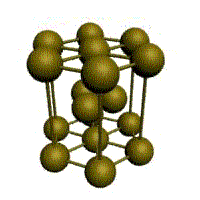
Металлическая химическая связь. Кристаллические решетки.
Связь в металлах между («атом-ионами» ) посредством (большого количества не связанных с ядрами подвижных электронов) называется (металлической связью).
Все металлы являются кристаллическими телами, имеющими определенный тип кристаллической решетки, состоящей из малоподвижных положительно заряженных ионов, между которыми движутся свободные электроны (так называемый электронный газ). Такой тип структуры называется металлической связью.
Тип решетки определяется формой элементарного геометрического тела, многократное повторение которого по трем пространственным осям образует решетку данного кристаллического тела.
| | | | |
| кубическая (1 атом на ячейку)
а) | объемно-центрированная кубическая (ОЦК) (2 атома на ячейку) б) | гранецентрированная кубическая (ГЦК) (4 атома на ячейку) в) | гексагональная плотноупакованная (ГП) (6 атомов на ячейку) г) |
Рис. Основные типы кристаллических решеток металлов
Обобщим сведения о типе химической связи, образуемой атомами металлов и строение кристаллической решетки:
- сравнительно небольшое количество электронов одновременно связывают множество ядер, связь делаколизована;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направляемостью и насыщенностью.
Физические свойства металлов
В соответствие именно с таким строением металлы характеризуются общими физическими свойствами.
а) твердость – все металлы кроме ртути, при обычных условиях твердые вещества. Самые мягкие – натрий, калий. Их можно резать ножом; самый твердый хром – царапает стекло.
б) плотность. Металлы делятся на мягкие (5г/см³) и тяжелые (меньше 5г/см³).
в) плавкость. Металлы делятся на легкоплавкие и тугоплавкие.
г) электропроводность, теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.
При повышении температуры амплитуда движения атомов и ионов, находящихся в узлах кристаллической решетки резко возрастает, и это мешает движению электронов, и электропроводность металлов падает.
д) металлический блеск – электроны, заполняющие межатомное пространство отражают световые лучи, а не пропускают как стекло. Поэтому все металлы в кристаллическом состоянии имеют металлический блеск. Для большинства металлов в ровной степени рассеиваются все лучи видимой части спектра, поэтому они имеют серебристо-белый цвет. Только золото и медь в большой степени поглощают короткие волны и отражают длинные волны светового спектра, поэтому имеют желтый цвет. Самые блестящие металлы – ртуть, серебро, палладий. В порошке все металлы, кроме Al и Mg, теряют блеск и имеют черный или темно-серый цвет.
е) пластичность. Механическое воздействие на кристалл с металлической решеткой вызывает только смещение слоев атомов и не сопровождается разрывом связи, и поэтому металл характеризуется высокой пластичностью.
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
Х
 имические свойства металлов.
имические свойства металлов.
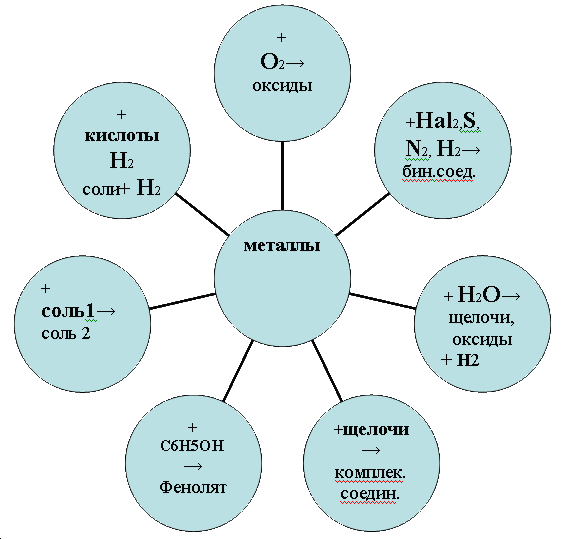
Ряд напряжений характеризует химические свойства металлов: чем меньше электродный потенциал металла, тем больше его восстановительная способность.
А) Взаимодействие с неметаллами (в названиях полученных веществ окончание
-иды)
2Mg0+O20—2Mg2+O2- (оксид магния) Mg0-2e– —Mg2+ 2 восстановитель
2O0+4e– —2O2– 1 окислитель
Fe0+S0—Fe2+S2- (сульфид железа II)
Fe0-2e– —Fe2+ 1 восстановитель
S0+2e– —S2– 1 окислитель
Б) Взаимодействие с водой Самые активные металлы реагируют с водой при обычных условиях, и в результате этих реакций образуются растворимые в воде основания и выделяется водород
2Na + 2HOH = 2NaOH + H2
2Li0+2H2+O2– — 2Li+O2-H+ + H20
Li0-1e– —Li+ 2 восстановитель
2H++2e– —2H0 1 окислитель
Li – восстановитель.
Менее активные металлы реагируют с водой при повышенной температуре с выделением водорода и образованием оксида соответствующего металла Zn + H2O = ZnO +H2
В) Взаимодействие с растворами кислот. Происходит при соблюдении ряда условий
Металл должен находиться левее в ряду напряжений металлов;
В результате реакции должна образовываться растворимая соль, иначе металл покроется осадком и доступ кислоты к металлу прекратиться;
Для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе кислоты;
По особому взаимодействуют с металлами концентрированные азотная и серная кислоты;
2H+Cl– +Zn0 —Zn2+Cl2- +H20
H++1e– —H0 2 окислитель
Zn0-2e– —Zn2+ восстановитель
Г) Взаимодействие с растворами солей. При этом соблюдаются следующие условия
Металл должен находиться в ряду напряжений левее металла, образующего соль;
В результате реакции должна образовываться растворимая соль, иначе металл покроется осадком и доступ кислоты к металлу прекратиться;
Для этих реакций не рекомендуется использовать щелочные металлы, так как они взаимодействуют с водой в растворе соли;
Fe0+Cu2+Cl2– —Fe2+Cl2– +Cu0
Fe0-2e– —Fe2+ восстановитель
Д) Взаимодействие со щелочами (только амфотерные)
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
Магний и щелочноземельные металлы с щелочами не реагируют.
Е) Взаимодействие с оксидами металлов (металлотермия).
Некоторые активные металлы способны вытеснять другие металлы из их оксидов при поджигании смеси.
2Al0 + Fe2O3 = Al2O3 +2Fe0
Ж) Коррозия (будет рассмотрена на другом занятии).
Способы получения металлов
Существуют несколько основных способов получения — металлов.
а) Пирометаллургия – это получение металлов из их соединений при высоких температурах с помощью различных восстановителей (C, CO, H2, Al, Mg и др.).
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия
4Аl + ЗМnО2 = 2А12О3 + ЗМn
б) Гидрометаллургия – это получение металлов, которое состоит из двух процессов: сначала природное соединение металла (оксид) растворяют в кислоте, в результате чего получают соль металла. Затем из полученного раствора необходимый металл вытесняют более активным металлом. Например:
CuO + H2SO4 = CuSO4 + H2O,
CuSO4 + Zn = ZnSO4 + Cu.
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем):
2ZnS + ЗО2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
в) Электрометаллургия – это получение металлов при электролизе растворов или расплавов их соединений. Роль восстановителя при этом играет электрический ток.
СuСl2 — Сu2+ 2Сl-
Катод (восстановление): Сu2+ - 2е- = Сu0
Анод (окисление): 2Cl- - 2е- = Сl°2
Закрепление знаний
Контрольные вопросы
1. Где расположены металлы в периодической системе химических элементов Д.И.Менделеева?
2. Каковы особенности строения атомов металлов?
3. В чём различие в строении внешнего энергетического уровня у металлов и неметаллов?
4. Сколько наружных электронов имеют атомы металлов главных и побочных подгрупп?
5. В каких формах могут находиться металлы в природе?
6. Как устроена кристаллическая решетка металлов?
7. Каковы физические свойства металлов?
8. Как можно получить металлы из их соединений?
9. Как ведут себя атомы металлов в химических реакциях и почему?
10. Какие свойства – окислителей или восстановителей – проявляют металлы в химических реакциях?
11. Расскажите об электрохимическом ряде напряжений металлов.
12. Перечислите реакции, в которые могут вступать металлы.
13. Каково значение металлов в жизни человека?
Задания и задачи
1. Написать уравнения реакций взаимодействия между веществами:
а) Li, Na, Ca, Fe c O2, Cl2, S, N2, C:
б) Na, Ca, Al c H2O;
в) Zn c H2SO4; Al c HCl;
г) Zn c CuSO4; Al c NaOH; Be c KOH.
2. Расставить коэффициенты, найти окислитель и восстановитель в уравнениях реакций:
Cu + HNO3 (P) — Cu (NO3)2 + NO + H2O
Cu + HNO3 (K) — Cu (NO3)2 + NO2 + H2O
Na + HNO3 — NaNO3 + N2O + H2O
3.Задача: Смесь порошков железа и меди массой 10 г обработали раствором НСl, при этом выделился газ объёмом 2,24 л. Определите массовую долю металлов в смеси.
4. Задача: К раствору содержащему 27 г CuCl2 добавили 14 г железных опилок. Найти массу меди которая выделилась в результате реакции.
Решение:
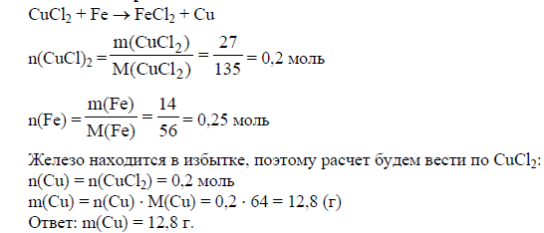
5.Задача: Какую массу сульфата цинка можно получить при взаимодействии избытка цинка с 500 мл 20% раствора серной кислоты, плотностью 1,14 г/мл?
Решение:
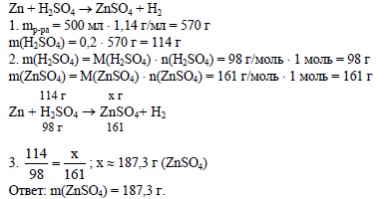
Химический диктант
Один студент работает у доски (но до момента проверки его ответы не видны), остальные обучающиеся группы выполняют работу в тетрадях.
Варианты вопросов:
1. Способность вещества изменять форму под внешним воздействием и сохранять ее после прекращения воздействия? (пластичность);
2. Тип химической связи в металлах? (металлическая);
3. Какие подвижные частицы кристаллической решетки обеспечивают физические свойства металлов? (электроны);
4. Какую плотность имеют легкие металлы (менее 5 г/см3);
5. Самый легкий металл? (литий);
6. Лучшие проводники электричества среди металлов? (серебро и медь);
7. Название известного сплава на основе алюминия (дюралюминий);
8. Важнейшие сплавы на основе железа? (чугун и сталь);
9.Какой неметалл входит в состав сплавов железа (углерод);
10. Укажите не менее трех металлов, которые могут выступать в качестве легирующих добавок? (хром, никель, молибден)
Тест по теме «Общая характеристика металлов.
Электрохимический ряд напряжений»
Выбери один или несколько правильных ответов
1. Какая из следующих групп химических элементов содержит только металлы?
а) Cs, Be, B; б) K, Ca, Sr;
в) H, Li, Na; г) Bi, W, Po.
2. Какое физическое свойство не является общим для всех металлов?
а) электропроводность;
б) теплопроводность;
в) твердое агрегатное состояние при стандартных условиях;
г) металлический блеск.
3. Натрий и калий можно хранить под слоем керосина, а литий – только под слоем вазелинового масла, т.к.:
а) литий реагирует с керосином;
б) в ряду напряжений литий находится левее натрия и калия;
в) литий более активен, чем калий и натрий;
г) плотность лития меньше плотности керосина.
4. При электролизе водного раствора хлорида натрия на катоде выделяется:
а) натрий; б) хлор;
в) водород; г) кислород.
5. Сильнее восстановительные свойства выражены у :
а) Ca; б) Mg; в) Si; г) O.
6. Масса карбида кальция, в которой содержится 5,418•1024 атомов всех образующих это соединение элементов, составляет (в г):
а) 19,2; б) 192; в) 57,6; г) 576.
7. Какие из перечисленных веществ реагируют с водой с образованием раствора сильного электролита, в котором лакмус приобретает синюю окраску?
а) Na; б) SO3; в) KH; г) Mg.
8. Какое из соединений кальция входит в состав земной коры?
а) Оксид; б) нитрид; в) карбид; г) карбонат.
9. Какой объем (л) газа (н.у.) выделится при взаимодействии 6,48 г серебра с избытком разбавленной азотной кислоты?
а) 4,032; б)1,344; в) 0,448; г) 22,4.
10. Какой металл нельзя получить электролизом водного раствора его соли?
а) Цинк; б) калий; в) медь; г) литий.
Ключ к тесту
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| б, г | в | г | в | а | б | а, в | г | в | б, г |
Это интересно!
Человек использовал металлы с древних времен.
1.В начале был век медный.
К концу каменного века человек открыл возможность использования металлов для изготовления орудий труда. Первым таким металлом был медь.
Период распространения медных орудий называют энеолитом или халколитом, что в переводе с греческого означает «медь». Медь обрабатывалась с помощью каменных орудий методом холодной ковки. Самородки меди превращались в изделия под тяжёлыми ударами молота. В начале медного века из меди делали лишь мягкие орудия, украшения, предметы домашней утвари. Именно с открытием меди и других металлов стала зарождаться профессия кузнеца.
Позже появились литья, а потом человек стал добавлять к меди олово или сурьму, делать бронзу, более долговечную, прочную, легкоплавкую.
II. Далее идёт век бронзовый.
Бронза - сплав меди и олова. Хронологические границы бронзового века датируются в начале 3-го тысячелетия до н. э. до начала 1-го тысячелетия до н.э. Большими преимуществами бронзы в сравнений с медью и другими известными металлами являются более низкая анализы показали, что в составе железных метеоритов на долю железа приходится 91% . Начало производства железа из его руд в Древнем Египте, потом в Индии и в других странах. Температура плавления ( 700° - 900° ) и высокие литейные качества и большая прочность.
III. Далее идет железный век.
Третий и последний период первобытной эпохи характеризуется распространением железной металлургии и железных орудий и знаменует собой железный век. В современном значении этот термин был введен в употребление в середине IX века датским археологом К.Ю. Томсоном и вскоре распространился в литературе наряду с терминами « каменный век» и « бронзовый век».
В отличие от других металлов железо, кроме метеоритного не встречается в чистом виде. Ученые предполагают, что первое железо, попавшее в руки человека, было метеоритного происхождения, и не зря железо именуется «небесным камнем». Самый крупный метеорит нашли в Африке, он весил около шестидесяти тонн. А во льдах Гренландии нашли железный метеорит весом тридцать три тонны.
В настоящее время продолжается железный век. Ведь в настоящее время железные сплавы составляют почти 90% всего количества металлов и металлических сплавов.
Карточки задания для индивидуальной работы
| Карточка №1 1) Электронная формула кальция. а) 1S² 2S² 2P 3S¹ б) 1S² 2S²2P 3S² в) 1S² 2S² 2P 3S² 3P 4S¹ г) 1S² 2S² 2P 3S ²3P 4S² 2) Электронную формулу 1S²2S² 2P 3S² 3P 4S² имеет атом: а)Na б)Са в)Cu г)Zn а) 1S² 2S² б) 1S² 2S² 2P 3S² в) 1S² 2S² 2P 3S² 3P 3d 4S² г) 1S² 2S² 2P 3S² 3P 4S² 4) Металлы при взаимодействий с неметаллами проявляют свойства: а) окислительные; б) восстановительные; в) и окислительные, и восстановительные; г) не участвуют в окислительно-восстановительных реакциях 5) В периодической системе типичные металлы расположены в: а) верхней части б) нижней части в) правом верхнем углу г) левом нижнем углу |
| Карточка №2 1. Группа элементов, содержащая только металлы: а) Li, Be, В; б) К, Са, Sr; в) Н, Na, Си; г) Se, Те, Ро. 2. В ряду элементов Ва—Sr—Са—Mg восстановительные свойства: а) усиливаются; б) ослабевают; в) не изменяются; г) сначала усиливаются, затем ослабевают. 3. Электронная конфигурация внешнего энергетического уровня атома алюминия: а) 3s23pl б) 3s23p2 в) 3 s24p1 г) 4р3 4. Кальций может взаимодействовать с каждым веществом пары: а) сера и гидроксид натрия б) вода и кислород в) углерод и магний г) хлорид калия и серная кислота |
| Карточка №3 1. Группа элементов, содержащая только металлы: а) В, С, N; б) Fe, Со, С1; в) Na, Mg, AI; г) W, Zn, Se. 2. В ряду элементов Na—Mg—Al—Si восстановительные свойства: а) усиливаются; б) ослабевают; в) не изменяются; г) сначала усиливаются, затем ослабевают. 3. Металл, имеющий конфигурацию валентных электронов 3d14s2, — это: а) скандий; б) галлий; в) цинк; г) алюминий. 4. Магний может взаимодействовать с каждым веществом пары: а) бром и гидроксид натрия б) соляная кислота и кислород в) вода и сульфат кальция г) хлорид калия и серная кислота |
| Карточка №4 1. Группа элементов, содержащая только металлы: а) Н, Li, В; б) Al, Са, Si; в) Мп, Сг, Си; г) CI, Br, I. 2. В ряду элементов Li—Na—К—Rb восстановительные свойства: а) усиливаются; б) ослабевают; в) не изменяются; г) сначала усиливаются, затем ослабевают. 3. Электронная конфигурация внешнего энергетического уровня атома стронция: а) 6s2; б) 5s2; в) 5sl5pl; г) 6р2. 4. Натрий получают из хлорида натрия: а) электролизом расплава NaCl б) электролизом раствора NaCl в) восстановлением с помощью магния г) восстановлением с помощью водорода |
| Карточка №5 1. Группа элементов, содержащая только металлы: а) Са, Sc, Ti; б) Ag, Au, As; в) N, О, Al; г) Pb, Sn, Si. 2. С водой взаимодействует оксид, формула которого: а) СаО; б) СuО; в) Fe2O3; г) ZnO. 3. Наиболее сильные основные свойства проявляет гидроксид: а) алюминия; б) магния; в) натрия; г) калия. 4. Не является амфотерным гидроксидом вещество, формула которого: а) Сг(ОН)3; б) А1(0Н)3; в) Мn(ОН)2; г) Ве(ОН)2.
|
| Карточка №6 1.В ряду элементов С—В—Be—Li восстановительные свойства: а) усиливаются; б) ослабевают; в) не изменяются; г) сначала усиливаются, затем ослабевают. 2. Оксид кальция не взаимодействует: а) с серной кислотой; б) гидроксидом натрия; в) оксидом углерода(IV); г) водой. 3. Едкие щелочи могут разрушать растительные и животные ткани. Таким свойством не обладает вещество, формула которого: а) NaOH; б) КОН; в) Сu(ОН)2; г) Ва(ОН)2. 4. Амфотерным гидроксидом является вещество, формула которого: а) Са(ОН)2; б) Ва(ОН)2; в) Zn(OH)2; г) Mg(OH)2.
|
| Карточка № 7 Закончите уравнения реакций: 1) Mg+ H2SO4→ 2) CaO+ H2O → 3) KOH+SO2 → 4) K2CO3 +HNO3 → |
| Карточка № 8 Закончите уравнения реакций: 1) Na+ H2O → 2) NaOH+ H3PO4 → 3) Zn+Pb(NO3)2 → 4) K2SO4 +BaCl2 → |
| Карточка №9 Закончите уравнения реакций: 1) Zn+ HCl → 2) LiCl+ AgNO3 → 3) HCl+Fe(OH)3 → 4) H2SO4 +Mg(OH)2 → |
| Карточка № 10 Закончите уравнения реакций: 1) NaOH+ HNO3 → 2) Mg+ O2 → 3) HCl+Fe(OH)3 → 4) Fe2O3 +Al → |
| Карточка № 11 Закончите уравнения реакций: 1) CuO+ H2 → 2) HCl+ Cu(OH)2 → 3) Cu+AgNO3 → 4) H2O +Ca → |
Урок №
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И.Менделеева. Характеристика простых веществ и их соединений: натрий, кальций, алюминий.
Характеристика металлов главной подгруппы I группы.
Главную подгруппу I группы периодической системы составляют:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Все щелочные металлы имеют один s-электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1. Поэтому щелочные металлы являются сильными восстановителями. Радиусы их атомов возрастают от лития к францию. Электрон внешнего слоя с возрастанием радиуса атома находится все дальше от ядра, силы притяжения ослабевают и, следовательно, увеличивается способность к отдаче этого электрона, т.е. химическая активность. В электрохимическом ряду напряжений металлов все щелочные металлы стоят левее водорода.
Все щелочные металлы в твердом состоянии хорошо проводят электрический ток. Они легкоплавки, быстро окисляются на воздухе, поэтому их хранят без доступа воздуха и влаги, чаще всего под керосином. Щелочные металлы образуют соединения с преимущественно ионной связью.
Оксиды щелочных металлов - твердые гигроскопичные вещества, легко взаимодействующие с водой. При этом образуются гидроксиды - твердые вещества, хорошо растворимые в воде. Соли щелочных металлов, как правило, тоже хорошо растворяются в воде.
Химические свойства
1. Активно взаимодействуют с водой:
2Na + 2H2O ![]() 2NaOH + H2
2NaOH + H2
2Li + 2H2O ![]() 2LiOH + H2
2LiOH + H2
2. Реакция с кислотами:
2Na + 2HCl ![]() 2NaCl + H2
2NaCl + H2
3. Реакция с кислородом: На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
4Li + O2 ![]() 2Li2O(оксид лития)
2Li2O(оксид лития)
2Na + O2 ![]() Na2O2(пероксид натрия)
Na2O2(пероксид натрия)
K + O2 ![]() KO2(надпероксид калия)
KO2(надпероксид калия)
4. В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2 = 2LiCl(галогениды)
2Na + S = Na2S(сульфиды)
2Na + H2 = 2NaH(гидриды)
6Li + N2 = 2Li3N(нитриды)
2Li + 2C = 2Li2C2(карбиды)
5. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета:
Li+ - карминово-красный
Na+ - желтый
K+, Rb+ и Cs+ - фиолетовый
Реагируют со спиртами и галогенопроизводными углеводородов (смотри "Органическую химию")
Урок №
Характеристика элементов главной подгруппы II группы.
Главную подгруппу II группы Периодической системы элементов составляют: бериллий Be, магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra. Они называются щелочноземельными металлами.
Атомы этих элементов имеют на внешнем электронном уровне два s-электрона: ns2. В хим. реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.
В свободном состоянии эти металлы в природе не встречаются. К числу наиболее распространенных элементов относятся кальций и магний. Основными кальцийсодержащими минералами являются кальцит CaCO3 (его разновидности - известняк, мел, мрамор), ангидрит CaSO4, гипс CaSO4 · 2H2O , флюорит CaF2 и фторапатит Ca5(PO4)3F. Магний входит в состав минералов магнезита MgCO3, доломита MgCO3 · CaCO3, карналлита KCl · MgCl2 · 6H2O. Соединения магния в больших количествах содержатся в морской воде.
Физические свойства. Бериллий, магний, кальций, барий и радий - металлы серебристо-белого цвета. Стронций имеет золотистый цвет. Эти металлы легкие, особенно низкие плотности имеют кальций, магний, бериллий. Радий является радиоактивным химическим элементом.
Бериллий, магний и особенно щелочноземельные элементы - химически активные металлы. Они являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки.
Химические свойства
Взаимодействие с простыми веществами.
Все легко взаимодействуют с кислородом и серой, образуя оксиды и сульфаты:
2Be + O2 = 2BeO
Ca + S = CaS
Бериллий и магний реагируют с кислородом и серой при нагревании, остальные металлы - при обычных условиях.
Все металлы этой группы легко реагируют с галогенами:
Mg + Cl2 = MgCl2
При нагревании все реагируют с водородом, азотом, углеродом, кремнием и другими неметаллами:
Ca + H2 = CaH2 (гидрид кальция)
3Mg + N2 = Mg3N2 (нитрид магния)
Ca + 2C = CaC2 (карбид кальция)
Карибид кальция - бесцветное кристаллическое вещество. Технический карбид, содержащий различные примеси, может иметь цвет серый, коричневый и даже черный. Карбид кальция разлагается водой с образованием газа ацетилена - важного продукта хим. промышленности:
CaC2 + 2H2O = CaOH)2 + C2H2
Взаимодействуют с водой.
Бериллий с водой не взаимодействует, т.к. реакции препятствует защитная пленка оксида на поверхности металла. Магний реагирует с водой при нагревании:
Mg + 2H2O = Mg(OH)2 + H2
Остальные металлы активно взаимодействуют с водой при обычных условиях:
Ca + 2H2O = Ca(OH)2 + H2
Взаимодействие с кислотами.
Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода:
Be + 2HCl = BeCl2 + H2
Разбавленную азотную кислоту металлы восстанавливают главным образом до аммиака или нитрата аммония:
2Ca + 10HNO3(разб.) = 4Ca(NO3)2 + NH4NO3 + 3H2O
В концентрированных азотной и серной кислотах (без нагревания) бериллий пассивирует, остальные металлы реагируют с этими кислотами.
Взаимодействие с щелочами.
Бериллий взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2
Остальные металлы II группы с щелочами не реагируют.
Взаимодействие с оксидами и солями металлов.
Магний и щелочноземельные металлы могут восстанавливать многие металлы из их оксидов и солей:
TiCl4 + 2Mg = Ti + 2MgCl2
V2O5 + 5Ca = 2V + 5CaO
Бериллий, магний и щелочноземельные металлы получают электролизом расплавов их хлоридов или термическим восстановлением их соединений:
BeF2 + Mg = Be + MgF2
MgO + C = Mg + CO
3CaO + 2Al = 2Ca + Al2O3
3BaO + 2Al = 3Ba + Al2O3
Характеристика элементов главной подгруппы III группы. Алюминий.
Алюминий находится в главной подгруппе III группы периодической системы. На внешнем энергетическом уровне атома алюминия имеются свободные р-орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.
Алюминий является самым распространенным металлом на Земле: его массовая доля в земной коре составляет 8,8%. Основная масса природного алюминия входит в состав алюмосиликатов - веществ, главными компонентами которых являются оксиды кремния и алюминия.
Алюминий - легкий металл серебристо-белого цвета, плавится при 600°C, очень пластичен, легко вытягивается в проволоку и прокатывается в листы и фольгу. По электропроводности алюминий уступает лишь серебру и меди.
Взаимодействие с простыми веществами:
с галогенами:
2Al + 3Cl2 = 2AlCl3
с кислородом:
4Al + 3O2 = 2Al2O3
с серой:
2Al + 3S = Al2S3
с азотом:
2Al + N2 = AlN
С водородом алюминий непосредственно не реагирует, но его гидрид AlH3 получен косвенным путем.
Взаимодействие со сложными веществами:
с кислотами:
2Al + 6HCl = 2AlCl3 + 3H2
со щелочами:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Если NaOH в твердом состоянии:
2Al + 2NaOH + 6H2O = 2NaAlO2 + 3H2
с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2
Свойства оксида и гидроксида алюминия: оксид алюминия, или глинозем, Al2O3 представляет собой белый порошок. Оксид алюминия можно получить, сжигая металл или прокаливая гидроксид алюминия:
2Al(OH)3 = Al2O3 + 3H2O
Оксид алюминия практически не растворяется в воде. Соответствующий этому оксиду гидроксид Al(OH)3 получают действием гидроксида аммония или растворов щелочей, взятых в недостатке, на растворы солей алюминия:
AlCl3 + 3NH3 · H2O = Al(OH)3 + 3NH4Cl
Оксид и гидроксид этого металла являются амфотерными, т.е. проявляют как основные, так и кислотные свойства.
Основные свойства:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Кислотные свойства:
Al2O3 + 6KOH +3H2O = 2K3[Al(OH)6]
2Al(OH)3 + 6KOH = K3[Al(OH)6]
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Алюминий получают электролитическим методом. Он не может быть выделен из водных растворов солей, т.к. является очень активным металлом. Поэтому основным промышленным методом получения металлического алюминия является электролиз расплава, содержащего оксид алюминия и криолит.
Металлический алюминий широко используется в промышленности, по объему производства занимает второе место после железа. Основная масса алюминия идет на изготовление сплавов:
Дуралюмин - сплав алюминия, содержащий медь и небольшое количество магния, марганца и других компонентов. Дуралюмины - легкие прочные и коррозионностойкие сплавы. Используют в авиа- и машиностроении.
Магналин - сплав алюминия с магнием. Используют в авиа- и машиностроении, в строительстве. Стоек к коррозии в морской воде, поэтому его применяют в судостроении. Силумин - сплав алюминия, содержащий кремний. Хорошо подвергается литью. Этот сплав используют в автомобиле-, авиа- и машиностроении, производстве точных приборов. Алюминий - пластичный металл, поэтому из него изготавливают тонкую фольгу, используемую в производстве радиотехнических изделий и для упаковки товаров. Из алюминия делают провода, краски «под серебро».
Строение атомов металлов изученных групп
| Металлы I А группы Щелочные металлы литий натрий калий рубидий цезий франций На внешнем уровне 1 электрон S-элемены | Металлы IIАгруппы Щелочноземельные металлы Бериллий, магний, кальций, стронций барий, радий На внешнем уровне 2 электрона s-элементы | Алюминий III A группа На внешнем уровне 3 электрона P-элемент |
Физические свойства:
| I А группа | II А группа | алюминий |
| Низкая температура плавления, плотность меньше чем у воды, низкая температура плавления, серебристо–белые, хранятся под слоем керосина | Твердые, хрупкие, низкая пластичность Серебристо-белые Хранятся под слоем керосина | Мягкий пластичный, серебристо-белый, электро- и теплопроводный легкий, невысокая температура плавления |
Общие химические свойства
|
| I А группа | II А группа | алюминий |
| О2 | 4 Na + О2 = 2 Na2O | 2 Ca + О2 = 2 CaO | 4Al + 3О2 = 2 Al2O3 |
| Hal2 | Na + Cl2 = 2 NaCl | Ca + Cl2 = CaCl2 | 2Al + 3Cl2 = 2 AlCl3 |
| вода | 2 Na + 2Н 2О = 2 NaOН + Н2 | Са+ 2Н 2О = Сa(OН)2 + Н2 | 2Аl +6H2O=2Al(OH)3 + 3H2 ( очищенный от оксидной пленки) |
Встречаемость в природе
| I А группа | II А группа | алюминий |
| Поваренная соль Сильвинит Карналлит галит | Берилл Аквамарин Изумруд Барит Известняк, мел, мрамор, фосфорит | Боксит Каолинит Корунд криолит |
Применение
| I А группа | II А группа | Алюминий |
| Соединения элементов группы применяются 1.Для фейерверков 2. В пищевой промышленности 3. Получение -металлов, - щелочей этих металлов (едкого натра и калия), -калийные удобрения, сильвинит, -в медицине, -производство соды | Соединения элементов группы применяются 1. Для фейерверков 2. В медицине (хлористый кальций и магний, магнезия) 3. Производство строительных вяжущих материалов 4. Получение металлов 5. Получение известковой, баритовой воды 6. Производство минеральных удобрений | 1.Строительство 2.Судостроение 3.Упаковочный материал 4. Химическое машиностроение 5.Ракетостроение 6.Производство пеноалюминия 7.Провода электропередач 8.Самолетостроение 9.Автомобильная промышленность 10.Производство посуды |
Закрепление и проверка знаний
Контрольные вопросы
Перечислите щелочные металлы. Почему они так называются?
Каковы особенности строения атомов щелочных металлов?
Какова степень окисления щелочного металла в соединении? Почему?
Каковы физические свойства щелочных металлов?
Какой из щелочных металлов наиболее активен и почему?
Какие реакции характерны для щелочных металлов?
Какие оксиды и пероксиды получаются при окислении щелочных металлов?
Как окрашивают пламя атомы и ионы щелочных металлов?
Какие химические связи образуют щелочные металлы с неметаллами?
Как можно получить щелочные металлы?
Где применяются щелочные металлы?
Какие элементы образуют щелочноземельных металлов?
Где в периодической системе расположены эти элементы?
Каковы особенности строения атомов этих металлов?
Какая степень окисления характерна щелочно-емельных элементов в соединениях?
Каковы физические свойства кальция, магния?
Как нужно хранить эти металлы?
Как можно получить эти металлы?
Перечислите реакции, характерные для этих металлов.
Каково строение атома алюминия?
Какова степень окисления алюминия в соединениях? Почему?
Назовите важнейшие природные соединения алюминия.
Каковы физические свойства алюминия?
Как ведет себя алюминий в химических реакциях? Почему?
С какими кислотами алюминий не взаимодействует?
Как алюминий взаимодействует с щелочами?
Какие металлы алюминий может восстановить из солей или оксидов?
Какие реакции доказывают амфотерность оксида и гидроксида алюминия?
Что происходит с гидроксидом алюминия при нагревании?
Упражнения и задачи для закрепления и проверки знаний
С какими из перечисленных веществ будет реагировать гидроксид натрия: с соляной кислотой, оксидом магния, оксидом углерода (IV), гидроксидом цинка, гидроксидом кальция? Приведите уравнения реакций.
С какими из перечисленных ниже растворов будет реагировать металлический кальций: HNO3, KOH, FeSO4, HBr ? Напишите уравнения происходящих реакций.
Задача: При обработке 8г смеси магния и оксида магния соляной кислотой выделилось 5,6 л водорода(н.у.). Какова массовая доля (в %) магния в исходной смеси?
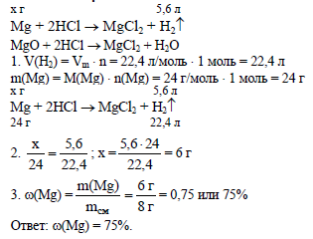
Задача: Калий массой 3,9 г растворили в воде массой 206,2 г. Определите массовую долю полученного раствора.
Задача: Металл массой 0,86 г при реакции с водой вытесняет газ объёмом 246,4 мл (н.у.). Какой это металл?
Задача: Порошок магния массой 40 г поместили в 596 г раствора сульфата цинка. Затем порошок отфильтровали и высушили. Его масса увеличилась на 16 г. Определить состав конечного раствора (массовую долю сульфата магния).
Дано:
m0(Mg) = 40 г,
m(р-ра ZnSO4) = 596 г,
![]() m = 16 г.
m = 16 г.
Найти:
![]() (MgSO4).
(MgSO4).
Решение: ZnSO4 + Mg = MgSO4 + Zn.
Изменение массы порошка в смеси: ![]() m = m(Zn) + m(Mg).
m = m(Zn) + m(Mg).
Пусть ![]() (Zn) =
(Zn) = ![]() (Mg) = х моль, тогда
(Mg) = х моль, тогда ![]() m = 65х – 24х = 16 г.
m = 65х – 24х = 16 г.
Отсюда х = 0,39 моль. Массовая доля сульфата магния в конечном растворе:
![]() (MgSO4) = m(MgSO4)/m1(р-ра) = 0,39•120/(596 – 16) = 0,0807, или 8,07%.
(MgSO4) = m(MgSO4)/m1(р-ра) = 0,39•120/(596 – 16) = 0,0807, или 8,07%.
Ответ. ![]() (MgSO4) = 8,07%.
(MgSO4) = 8,07%.
Напишите уравнения реакций, соответствующие цепочкам превращения:
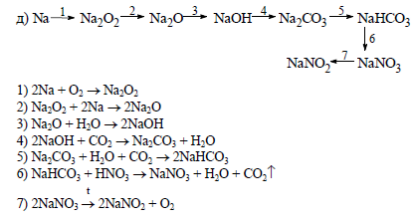
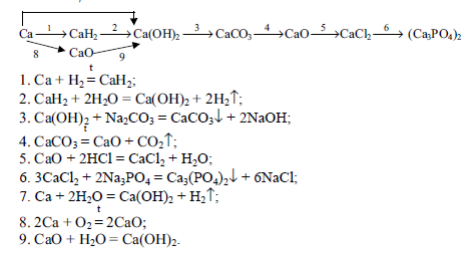
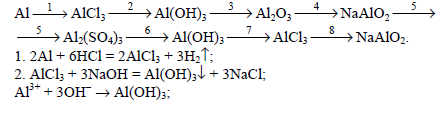
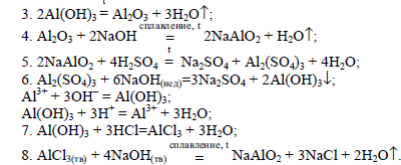
| Тест "Металлы" |
| 1.Исключите лишний элемент: |
| 2.Какая из перечисленных групп элементов содержит только металлы: |
| 3) Металлами являются : |
| 4.Какое свойство не является общим для всех металлов: |
|
|
|
|
| 5) Верны ли следующие суждения о щелочных металлах? |
| 6)Хлорид железа(II) не может быть получен взаимодействием: |
| 7)Какой из оксидов является кислотным: |
| 8)К реакциям горения не относится: |
| 9)Какое из природных веществ можно назвать рудой: |
| 10)Исключите лишний элемент в ряду: |
| 11) Какая из следующих групп в Периодической системе содержит только неметаллы : |
| 12)Выберите верное утверждение: "Все простые вещества неметаллы: |
Урок №
Металлы побочных подгрупп (переходные металлы). Свойства химических элементов. Характеристика важнейших соединений хрома, марганца, железа. Важнейшие сплавы железа: чугун, сталь.
Общий обзор металлических элементов побочных подгрупп.
Металлические элементы побочных подгрупп являются d – элементами. У их атомов на наружном энергетическом уровне сохраняются s – электроны, а очередные электроны помещаются не на наружных, а на предпоследних энергетических уровнях.
В образовании связей у металлов побочных подгрупп, кроме ns – электронов наружного слоя, принимают участие (n – 1) d – электроны. Причём s – электроны легче образуют связи и наличие d – электронов незначительно влияет на свойства.
Более устойчивыми являются состояния d0, d5, d10.
Например, у хрома и меди происходит «провал» электрона с наружного слоя на d – подуровень.
d – элементы проявляют широкий спектр валентных возможностей. Минимальная степень окисления у этих элементов в соединениях соответствует количеству s – электронов на внешнем слое, а максимальная соответствует числу номера группы.
Например, марганец образует оксиды, в которых степень окисления :
+2 МnO, +4 MnO2, +6 MnO3, +7 Mn2O7.
! При этом важно запомнить правило: с увеличением степени окисления атомов металлов побочных подгрупп основные свойства их оксидов и гидроксидов уменьшаются, а кислотные усиливаются.
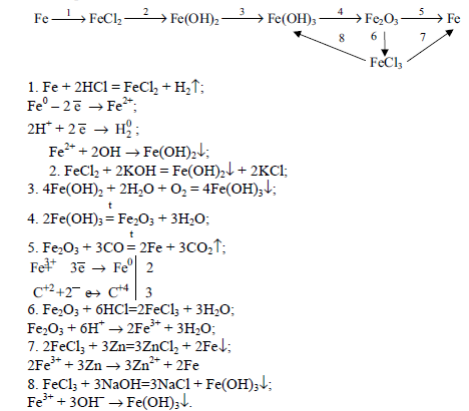
Железо.
 В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы.
В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы.
Порядковый номер - 26, электронная формула 1s2 2s2 2p6 3d6 4s2.
Валентные электроны у атома железа находятся на последнем электронном слое (4s2) и предпоследнем (3d6). В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и, иногда, +6.
Железо является вторым по распространенности металлом в природе (после алюминия). Наиболее важные природные соединения: Fe2O3x3H2O - бурый железняк;Fe2O3 - красный железняк;Fe3O4(FeO Fe2O3) - магнитный железняк;FeS2 - железный колчедан (пирит). Соединения железа входят в состав живых организмов.
Железо - серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами. Плотность железа - 7,87 г/см3, температура плавления 1539С.
Получение железа
В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II) в доменных печах.
Химизм доменного процесса следующий:
C + O2 = CO2,
CO2 + C = 2CO.
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 3FeO + CO2,
FeO + CO = Fe + CO2.
В реакциях железо является восстановителем. Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними:
2Fe + 3Cl2 = 2FeCl3 Хлорид железа (III)
3Fe + 2O2 = Fe3O4(FeO x Fe2O3) Оксид железа (II,III)
Fe + S = FeS Сульфид железа (II)
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe3C Карбид железа (цементит)
3Fe + Si = Fe3Si Силицид железа
3Fe + 2P = Fe3P2 Фосфид железа (II)
Во влажном воздухе железо быстро окисляется (коррозирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3,
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой:
3Fe + 4H2O = Fe3O4 + 4H2
Железо реагирует с разбавленными серной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl2 + H2
Fe + H2SO4 = FeSO4 + H2
При обычной температуре железо не взаимодействует с концентрированной серной кислотой, так как пассивируется ею. При нагревании концентрированная H2SO4 окисляет железо до сульфита железа (III):
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O.
Разбавленная азотная кислота окисляет железо до нитрата железа (III):
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
Концентрированная азотная кислота пассивирует железо.
Из растворов солей железо вытесняет металлы, которые расположены правее его в электрохимическом ряду напряжений:
Fe + CuSO4 = FeSO4 + Cu
Оксид железа (II) FeO - основной оксид, легко реагирует с кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl2 + H2O
FeO + 2H+ = Fe2+ + H2O
Гидроксид железа (II) Fe(OH)2 - порошок белого цвета, не растворяется в воде. Получают его из солей железа (II) при взаимодействии их со щелочами:
FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4,
Fe(OH)2 проявляет свойства основания, легко реагирует с кислотами:
Fe(OH)2 + 2HCl = FeCl2 + 2H2O,
Fe(OH)2 + 2H+ = Fe2+ + 2H2O.
При нагревании гидроксид железа (II) разлагается:
Fe(OH)2 = FeO + H2O.
Соединения со степенью окисления железа +2 проявляют восстановительные свойства, так как Fe2+ легко окисляются до Fe+3: Fe+2 - 1e = Fe+3
Так, свежеполученный зеленоватый осадок Fe(OH)2 на воздухе очень быстро изменяет окраску - буреет. Изменение окраски объясняется окислением Fe(OH)2 в Fe(OH)3 кислородом воздуха:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Оксид железа (III) Fe2O3 - порошок бурого цвета, не растворяется в воде.
Оксид железа (III) получают разложением гидроксида железа (III):
2Fe(OH)3 = Fe2O3 + 3H2O
Оксид железа (III) проявляет амфотерные свойства:
взаимодействует с кислотами и твердыми щелочами NaOH и KOH , а также с карбонатами натрия и калия при высокой температуре:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O,
Fe2O3 + 2OH- = 2FeO2- + H2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
Феррит натрия
Гидроксид железа (III) получают из солей железа (III) при взаимодействии их со щелочами:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl,
Гидроксид железа (III) является более слабым основанием, чем Fe(OH)2, и проявляет амфотерные свойства (с преобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH)3 легко образует соответствующие соли:
Fe(OH)3 + 3HCl = FeCl3 + H2O
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 6H2O
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании.:
Fe(ОН)3 + КОН = К[Fe(ОН)4]
Соединения со степенью окисления железа +3 проявляют окислительные свойства, так как под действием восстановителей Fe+3 превращается в Fe+2: Fe+3 + 1e = Fe+2.
Так, например, хлорид железа (III) окисляет йодид калия до свободного йода:
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I20
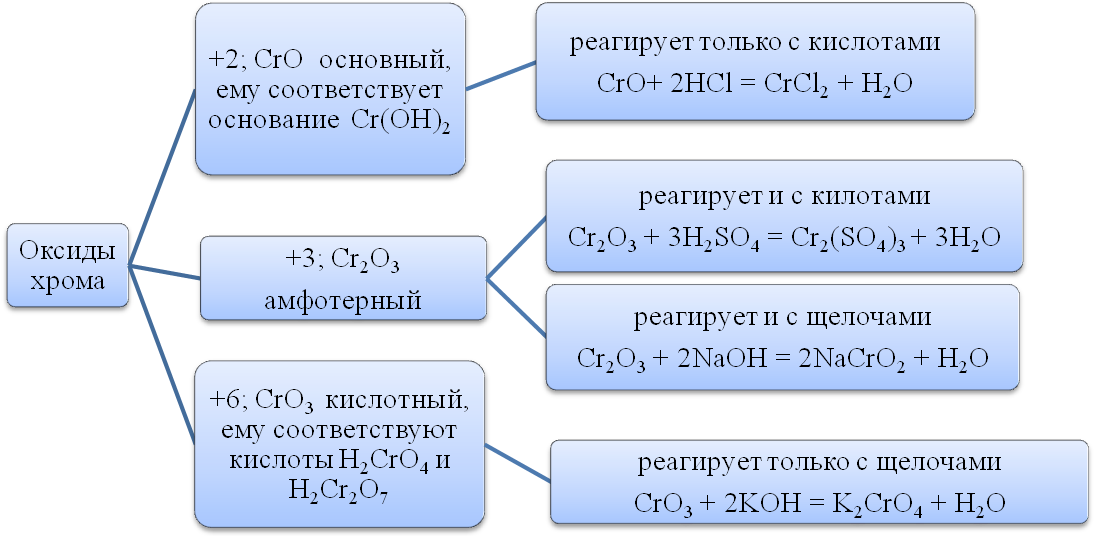
Хром.
 Хром находится в побочной подгруппе VI группы Периодической системы. Строение электронной оболочки хрома: Cr 3d54s1. Степени окисления от +1 до +6, но наиболее устойчивые +2, +3, +6.
Хром находится в побочной подгруппе VI группы Периодической системы. Строение электронной оболочки хрома: Cr 3d54s1. Степени окисления от +1 до +6, но наиболее устойчивые +2, +3, +6.
Массовая доля хрома в земной коре составляет 0,02%. Важнейшими минералами, входящими в состав хромовых руд, являются хромит, или хромистый железняк, и его разновидности, в которых железо частично заменено на магний, а хром - на алюминий.
Хром - серебристо серый металл. Чистый хром достаточно пластичный, а технический самый твердый из всех металлов.
Хром химически малоактивен. В обычных условиях он реагирует только с фтором (из неметаллов), образуя смесь фторидов. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором:
t°
4Cr + 3O2 = 2Cr2O3
t°
2Cr + 3Cl2 = 2CrCl3
t°
2Cr + N2 = 2CrN
t°
2Cr + 3S = Cr2S3
В азотной и концентрированной серной кислотах он пассивирует, покрываясь защитной оксидной пленкой. В хлороводородной и разбавленной серной кислотах растворяется, при этом, если кислота полностью освобождена от растворенного кислорода, получаются соли хрома(II), а если реакция протекает на воздухе - соли хрома (III): Cr + 2HCl = CrCl2 + H2 ; 2Cr + 6HCl + O2 = 2CrCl3 + 2H2O + H2
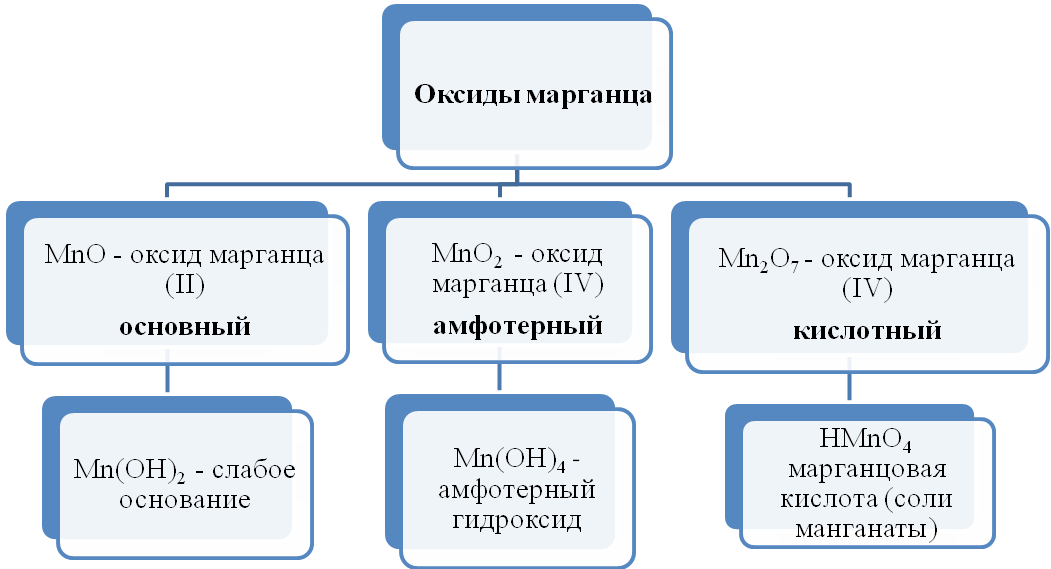
МАРГАНЕЦ
 Mn, химический элемент с атомным номером 25, атомная масса 54,9. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55Mn. Конфигурация двух внешних электронных слоев атома марганца 3s2p6d54s2. В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 до +7, наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Mn, химический элемент с атомным номером 25, атомная масса 54,9. Химический символ элемента Mn произносится так же, как и название самого элемента. Природный марганец состоит только из нуклида 55Mn. Конфигурация двух внешних электронных слоев атома марганца 3s2p6d54s2. В периодической системе Д. И. Менделеева марганец входит в группу VIIВ, и располагается в 4-м периоде. Образует соединения в степенях окисления от +2 до +7, наиболее устойчивы степени окисления +2 и +7. У марганца, как и у многих других переходных металлов, известны также соединения, содержащие атомы марганца в степени окисления 0.
Марганец в компактном виде — твердый серебристо-белый, хрупкий металл.
Химические свойства
Марганец – активный металл.
Взаимодействие с неметаллами
При взаимодействии металлического марганца с различными неметаллами образуются соединения марганца (II):
Мn + С2 = МnСl2 (хлорид марганца (II));
Mn + S = МnS (cулъфид марганца (II));
3Мn + 2 Р = Мn3Р2 (фосфид марганца (II));
3Mn + N2 = Мn3N2 (нитрид марганца (II));
2Mn + N2 = Мn2Si (силицид марганца (II)).
Взаимодействие с водой
При комнатной температуре очень медленно взаимодействует с водой, при нагревании с умеренной скоростью:
Mn + 2H2O = MnO2 + 2H2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов марганец находится до водорода, он вытесняет водород из растворов неокисляющих кислот, при этом образуются соли марганца (II):
Mn + 2HCl = MnCl2 + H2;
Mn + H2SO4 = MnSO4 + H2;
с разбавленной азотной кислотой образует нитрат марганца (II) и оксид азота (II):
3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
Концентрированная азотная и серная кислоты пассивируют марганец. Марганец растворяется в них лишь при нагревании, образуются соли марганца (II) и продукты восстановления кислоты:
Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O;
Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O
Восстановление металлов из оксидов
Марганец – активный металл, способен вытеснять металлы из их оксидов:
5Mn + Nb2O5 = 5MnO + 2Nb.
Если к перманганату калия KMnO4 добавить концентрированную серную кислоту, то образуется кислотный оксид Mn2O7, обладающий сильными окислительными свойствами:
2KMnO4 + 2H2SO4 = 2KHSO4 + Mn2O7 + H2O.
Марганцу отвечает несколько кислот, из которых наиболее важны сильные неустойчивые марганцоватая кислота H2MnO4 и марганцовая кислота HMnO4, соли которых — соответственно, манганаты (например, манганат натрия Na2MnO4) и перманганаты (например, перманганат калия KMnO4).
Манганаты (известны манганаты только щелочных металлов и бария) могут проявлять свойства как окислителей (чаще) 2NaI + Na2MnO4 + 2H2O = MnO2 + I2 + 4NaOH, так и восстановителей 2K2MnO4 + Cl2 = 2KMnO4 + 2KCl.
Перманганаты — сильные окислители. Например, перманганат калия KMnO4 в кислой среде окисляет сернистый газ SO2 до сульфата:
2KMnO4 + 5SO2 +2H2O = K2SO4 + 2MnSO4 + 2H2SO4.
Применение: более 90% производимого марганца идет в черную металлургию. Марганец используют как добавку к сталям для их раскисления, десульфурации (при этом происходит удаление из стали нежелательных примесей — кислорода, серы и других), а также для легирования сталей, т. е. улучшения их механических и коррозионных свойств. Марганец применяется также в медных, алюминиевых и магниевых сплавах. Покрытия из марганца на металлических поверхностях обеспечивают их антикоррозионную защиту. Для нанесения тонких покрытий из марганца используют легко летучий и термически нестабильный биядерный декакарбонил Mn2(CO)10.
Понятие о сплавах.
Характерной особенностью металлов является их способность образовывать друг с другом или с неметаллами сплавы. Чтобы получить сплав, смесь металлов обычно подвергают плавлению, а затем охлаждают с различной скоростью, которая определяется природой компонентов и изменением характера их взаимодействия в зависимости от температуры. Иногда сплавы получают спеканием тонких порошков металлов, не прибегая к плавлению (порошковая металлургия). Итак сплавы - это продукты химического взаимодействия металлов.
Кристаллическая структура сплавов во многом подобна чистым металлам, которые, взаимодействуя друг с другом при плавлении и последующей кристаллизации, образуют: а) химические соединения, называемые интерметаллидами; б) твердые растворы; в) механическую смесь кристаллов компонентов.
Современная техника использует огромное число сплавов, причем в подавляющем большинстве случаев они состоят не из двух, а из трех, четырех и большего числа металлов. Интересно, что свойства сплавов часто резко отличаются от свойств индивидуальных металлов, которыми они образованы. Так, сплав, содержащий 50% висмута, 25% свинца, 12,5% олова и 12,5% кадмия, плавится всего при 60,5 градусах Цельсия, в то время как компоненты сплава имеют соответственно температуры плавления 271, 327, 232 и 321 градус Цельсия. Твердость оловянной бронзы (90% меди и 10% олова) втрое больше, чем у чистой меди, а коэффициент линейного расширения сплавов железа и никеля в 10 раз меньше, чем у чистых компонентов.
Однако некоторые примеси ухудшают качество металлов и сплавов. Известно, например, что чугун (сплав железа и углерода) не обладает той прочностью и твердостью, которые характерны для стали. Помимо углерода, на свойства стали влияют добавки серы и фосфора, увеличивающие ее хрупкость.
Среди свойств сплавов наиболее важными для практического применения являются жаропрочность, коррозионная стойкость, механическая прочность и др. Для авиации большое значение имеют легкие сплавы на основе магния, титана или алюминия, для металлообрабатывающей промышленности - специальные сплавы, содержащие вольфрам, кобальт, никель. В электронной технике применяют сплавы, основным компонентом которых является медь. Сверхмощные магниты удалось получить, используя продукты взаимодействия кобальта, самария и других редкоземельных элементов, а сверхпроводящие при низких температурах сплавы - на основе интерметаллидов, образуемых ниобием с оловом и др.
Задания для закрепления и проверки знаний
Контрольные вопросы:
Как определить степени окисления металлов побочных подгрупп?
Какие степени окисления наиболее характерны для железа?
Назовите формулы оксидов и соответствующих им гидроксидов железа.
Охарактеризуйте кислотно-основные свойства гидроксидов железа (II) и железа
(III)?
Какие степени окисления характерны для хрома? Какие из них наиболее устойчивы?
Назовите формулы оксидов и гидроксидов хрома и охарактеризуйте их кислотно-основные свойства.
Как меняются окислительно-восстановительные свойства соединений хрома с
увеличением степени его окисления?
Напишите формулы хромовой и дихромовой кислот.
Какие степени окисления проявляет марганец в соединениях? Какие из них наиболее устойчивы?
Напишите формулы оксидов и гидроксидов хрома и охарактеризуйте их кислотно-основные свойства и окислительно-восстановительные свойства.
Как меняются окислительно-восстановительные свойства соединений марганца с увеличением степени его окисления?
Решение задач
Задачи первого уровня сложности
(оцениваются в 3 балла)
Сколько литров водорода (н. у.) потребуется для восстановления 6,4 г меди из оксида меди (II)?
Сколько граммов сульфида железа(II) образуется при взаимодействии 5,6 г железа с избытком серы?
Определите массу цинка, необходимого для взаимодействия с раствором, который содержит 19,6 г серной кислоты.
Задачи второго уровня сложности
(оцениваются в 4 балла)
Какой объем оксида углерода(II) (н.у.) потребуется для восстановления 4 г оксида железа(III)?
Определите массу алюминия, который потребуется для получения 78 г хрома из оксида хрома(III) алюминотермическим методом.
Какой объем оксида углерода (II) (н.у.) потребуется для восстановления 320 т оксида железа(III) до железа?
Задачи третьего уровня сложности
(оцениваются в 5 баллов)
Какой объем водорода (н.у.) выделится при взаимодействии 137 г цинка, содержащего 5 % примесей, с соляной кислотой?
Определите массу осадка, который образуется при взаимодействии растворов, один из которых содержит 9,8 г серной кислоты, а другой — 31,2 г хлорида бария.
Определите объем водорода (н.у.), который выделится при взаимодействии 230 г натрия с водой, если выход газа составляет 90 % (по объему).
Напишите уравнения реакций, соответствующие цепочкам превращения:
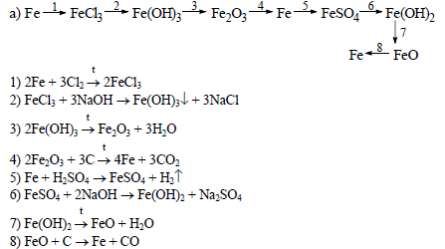
Запишите уравнения практически осуществимых реакций. Если реакция не протекает , укажите причину. Из букв, соответствующих правильным ответам, вы составите название планеты, с которой в древности соотносили железо.
а) Mg + НС1 → M
б) Zn+ H3P04→ Е
в) А1+ H2S04(pa36) → А
г) Ag + НС1 → Л
д) Fe + НС1 → Р
е) Pb+ H2S04(pa36) → К
ж) Al + НС1 → С
Составьте уравнения практически осуществимых реакций между веществами:
а) А1+ Hg(N03)2(p.p) →….
б) Zn + MgCl2(p.p→)
в) Fe+ ZnCl2(p.p) →
г) Zn+ Pb(N03)2(p.p) →….
Выберите химический элемент-металл из списка: натрий, литий, магний, калий, кальций, алюминий. Дайте его характеристику, вписав в текст пропущенные слова, цифры, знаки.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТА-МЕТАЛЛА НА ПРИМЕРЕ
Положение в Периодической системе.
… (порядковый номер… ) — это элемент периода,……подгруппы……группы Периодической системы.
Строение атома, его свойства.
Число протонов в атоме………равно……, число электронов —......, число нейтронов в изотопе —……, заряд ядра , электронная формул……, электронно-графическая формула внешнего слоя……………………………..
Атомы проявляют свойства.
Простое вещество. …… — это………………….
Высший оксид, его характер.
………образует высший оксид, формула которого……….
По свойствам это…………………
Высший гидроксид, его характер.
………образует высший гидроксид, формула которого……….
По свойствам это………….
Карточки задания по теме «Металлы»
| Вариант 1. Выбрать номера правильных утверждений:
|
| Вариант 2. Выбрать номера правильных утверждений:
|
| Вариант 3. Выбрать номера правильных утверждений:
|
| Вариант 4. Выбрать номера правильных утверждений:
|
| Вариант 5. Выбрать номера правильных утверждений:
|
Ответы во всех вариантах под номерами 1, 4, 5, 7.
| Карточка №1 1. С водой не взаимодействует оксид, формула которого: а) СаО; б) К2О; в) FeO; г) SrO. 2. Основные свойства в ряду Сг(ОН)2—Сг(ОН)3—Н2СЮ4: а) усиливаются; б) ослабевают; в) не изменяются; г) сначала усиливаются, затем ослабевают. 3. И с кислотой, и с основанием взаимодействует гидроксид: а) калия; б) магния; в) лития; г) алюминия. |
| Карточка №2 1. Оксид хрома(II) может взаимодействовать: а) с серной кислотой; б) гидроксидом калия; в) оксидом натрия; г) водой. 2. Наиболее слабые основные свойства проявляет гидроксид: а) алюминия; б) магния; в) натрия; г) калия. 3. Формулы веществ, которые взаимодействуют с гидроксидом цинка, образуют пару: а) Cu(OH)2, HC1; б) NaOH, K2SO4; в) HNO3, КОН; г) MgCl2, H2SO4
|
|
|
Тест по теме «Металлы»
Вариант 1
Определите какая из электронных формул отражает строение атома натрия:
А) 1s2 2s2 2p6 3s2 3p6 4s2
Б) 1s2 2s2 2p6 3s1
В) 1s2 2s2 2p6 3s2 3p6 3d5 4s1
Г) 1s2 2s1
2. Определите в каких парах обе реакции практически осуществимы:
А) Cu + Zn2+ → ; Fe3+ + K→
Б) Mg + Cu2+ → ; Cr + H+ →
В) Ca2+ + Zn → ; Al3+ + Na →
Г) Ca + H+ → ; Pb2+ + Cu →
3. В какой из групп все металлы растворяются в кислотах:
А) Al, Fe, Cu Б) Ag, K, Ba
В) Ca, Zn, Fe Г) Au, Mg, Na
4. В 4 пробирки налиты растворы солей. В каждой из них – кусочек цинка. В какой из пробирок будет идти реакция с раствором:
А) CaCl2 Б) CuSO4
В) Mg(NO3)2 Г) FeCl3
Вариант 2
Какой из металлов, электронные формулы которых записаны ниже, наиболее химически активен:
А) 1s2 2s2 2p6 3s1
Б) 1s2 2s2 2p6 3s2 3p6 3d10 4s2
В) 1s2 2s2 2p6 3s2 3p6 4s1
Г) 1s2 2s1
2. Проанализируйте, в каких группах все три металла могут вытеснять медь из раствора хлорида меди. Выберите правильный ответ:
А) Al, Zn, Na Б) Fe, Hg, Sr
В) Zn, Fe, Ca Г) Ag, Pb, Zn
3. Какие реакции практически осуществимы:
А) Cu + HCl → Б) Cu + AgCl →
В) Ca + H2O → Г) Zn + Pb(NO3)2 →
4. Какое из свойств наиболее характерно для всех металлов:
А) твердость Б) восстановительная активность
В) взаимодействие с водой Г) сильные окислительные свойства
Тест по теме «Металлы»
Вариант 3
Определите, какая из электронных формул отражает строение атома железа:
А) 1s2 2s2 2p6 3s2 3p6 3d5 4s1 Б) 1s2 2s2 2p6 3s2 3p6 4s2
В) 1s2 2s2 2p6 3s2 3p6 3d6 4s2 Г) 1s2 2s2 2p6 3s2 3p6 4s1
2. Укажите, в каких случаях железо и его соединения являются окислителями:
А) Fe0 → Fe2+ Б) Fe3+ → Fe2+
В) Fe2+ → Fe0 Г) Fe2+ → Fe3+
3. Определите, какие группы реакций показывают процессы, при которых медную пластинку можно превратить в черный порошок, а затем в голубой раствор:
А) Cu + H2O → ; CuCl2 + NaOH →
Б) Cu + O2 → ; CuO + HCl →
В) Cu + Cl2 → ; Cu + HgCl2 →
Г) Cu + O2 → ; CuO + H2O →
4. Чем объяснить, что металлы хорошо проводят электрический ток:
А) электропроводность металлов обусловлена свободным перемещением валентных электронов в кристаллической решетке
Б) не все металлы проводят электрический ток
В) металлы хорошо проводят электрический ток благодаря наличию s- электронов
Г) электропроводность металлов обусловлена низкой энергией отрыва валентных электронов
Вариант 4
Какой из металлов, электронная формула которого записана ниже, относится к d-элементам:
А) 1s2 2s2 2p6 3s2
Б) 1s2 2s2 2p6 3s2 3p6 3d1 4s1
В) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
Г) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d2 5s2
2. Определите в каких группах обе реакции практически осуществимы:
А) Cu + Hg2+ → ; H+ + K→ Б) Mg + Pb2+ → ; Al + H+ →
В) Ca2+ + Zn → ; Fe2+ + Cu → Г) Na + Cu2+ → ; Na+ + Fe →
3. В какой из групп все металлы растворяются в кислотах:
А) Mg, Al, Cu Б) Au, K, Fe
В) Zn, Ca, Cr Г) Ag, Sn, Pb
4. В какой группе ПСХЭ находятся самые активные металлы:
А) седьмой группе, побочной подгруппе
Б) первой группе, главной подгруппе
В) второй группе, побочной подгруппе
Г) пятой группе, главной подгруппе
Тест
Вариант 1
Часть А. Выберите правильный ответ
А1. Атом магния имеет электронную конфигурацию:
1)1S22S22P63S2 ,
2) 1S22S2 ,
3) 1S22S22P63P2,
4) 1S22S22P2
А2. Тип химической связи в простом веществе меди:
1) ковалентная полярная,
2) ковалентная неполярная,
3) ионная,
4) металлическая.
А3. Из перечисленных ниже физических свойств общими для большинства металлов являются:
1) электропроводность,
2) теплопроводность,
3) металлический блеск ,
4) все приведенные выше ответы верны.
А4. Какой из металлов встречается в земной коре в свободном состоянии?
1) цинк,
2) медь,
3) кобальт,
4) алюминий.
А5. Восстановление металлов из руд используется в процессе :
1) пирометаллургии,
2) гидрометаллургии,
3) электрометаллургии,
4) все предыдущие ответы верны.
А6. Химическое взаимодействие возможно между:
1) оловом и хлоридом магния,
2) серебром и сульфатом меди (II),
3) магнием и бромидом натрия,
4) медью и нитратом ртути (II)
А7. Какой из перечисленных металлов наиболее подвержен химической коррозии?
1) свинец,
2) кальций,
3) алюминий,
4) железо
А8. Какой из оксидов, формулы которых перечислены ниже, реагирует с водой?
1) CuO ,
2) BaO ,
3) Ag2O ,
4) Cr2O3
Часть В. Ответом к заданиям этой части является набор букв, которые следует записать в бланк ответов
В1. Установите соответствие.
С увеличением порядкового номера элемента в главной подгруппе II группы Периодической системы свойства элементов и образуемых ими веществ изменяются следующим образом:
СВОЙСТВА ИЗМЕНЕНИЯ
1) восстановительные свойства А) усиливаются
2) радиус атома Б) увеличивается
3) электроотрицательность В) уменьшается
4) число электронов на внешнем уровне Г) не изменяется
| 1 | 2 | 3 | 4 |
|
|
|
|
|
В2. С какими из перечисленных веществ в соответствующих условиях реагирует алюминий:
А) кислород,
Б) оксид калия,
В) гидроксид натрия,
Г) концентрированная азотная кислота (без нагревания),
Д) сульфат натрия,
Е) сера,
Ж) гидрокисид железа (III),
З) хлорид меди (II),
И) уксусная кислота,
К) оксид азота (II)?
Ответ : _______________.
Вариант 2
Часть А Выберите правильный ответ
А1. Электронная конфигурация внешнего энергетического уровня атома свинца:
1) 6S26Р2 ,
2) 5S25Р2 ,
3) 6P2,
г) 6P4
А2. Тип химической связи в простом веществе цезии:
1) ковалентная полярная,
2) ковалентная неполярная,
3) ионная,
4) металлическая.
А3. Какое физическое свойство не является общими для всех металлов:
1) электропроводность,
2) теплопроводность,
3) твердое агрегатное состояние при нормальных условиях,
4) металлический блеск
А4. Какой процесс является химической основой металлургии?
1) восстановление,
2) окисление,
3) диспропорционирование,
4) верного ответа среди перечисленных нет.
А5. В промышленности электролизом получают :
1) железо,
2) цинк,
3) свинец,
4) алюминий
А6. Какой из перечисленных ионов является наиболее сильным окислителем?
1) Cu2+ ,
2) Mg2+ ,
3) Na+ ,
4) Ca2+
А7. Химическое взаимодействие возможно между :
1) серебром и хлороводородной кислотой,
2) кобальтом и хлоридом магния,
3) цинком и нитратом олова (II),
4) свинцом и раствором серной кислоты.
А8. Какой из оксидов, формулы которых перечислены ниже, является кислотным?
1) MnO ,
2) Mn2O3 ,
3) MnO2 ,
4) Mn2O7
Часть В. Ответом к заданиям этой части является набор букв, которые следует записать в бланк ответов
В1. Установите соответствие.
В ряду элементов Ba -Sr - Ca - Mg наблюдается следующее изменение свойств:
СВОЙСТВО ИЗМЕНЕНИЕ
1) восстановительные свойства А) усиливаются
2) число энергетических уровней Б) увеличивается
3) электроотрицательность В) уменьшается
4) число валентных электронов Г) не изменяется
| 1 | 2 | 3 | 4 |
|
|
|
|
|
В2. С какими из перечисленных веществ в соответствующих условиях реагирует медь: А) кислород,
Б) вода,
В) оксид железа (III),
Г) гидроксид натрия,
Д) концентрированная азотная кислота ,
Е) соляная кислота,
Ж) нитрат серебра,
З) оксид углерода (IV),
И) хлор,
К) сульфат хрома (III)?
Ответ : _____________ .
Часть С. Решите задачи
I уровень
1. При электролизе расплава хлорида калия на катоде получили металл массой 7,8 г. Объем хлора, выделившегося (н.у.) на аноде, равен ________ г.
(Запишите число с точностью до десятых.)
2. При взаимодействии 200 г 40 %-го раствора сульфата меди (II) с магнием получили медь количеством вещества _________ моль.
(Запишите число с точностью до десятых.)
3. Масса соли, образовавшейся при взаимодействии 64 г серы и 56 г железа, равна
____ г.
(Запишите число с точностью до десятых.)
4. Объем водорода, выделившегося при взаимодействии натрия с водой составил 1,12 л. Масса натрия, вступившего в реакцию, равна _______ г.
(Запишите число с точностью до десятых.)
5. Объем угарного газа, необходимого для восстановления железа из оксида железа (III) массой 40 г, равен ________ л. (Запишите число с точностью до десятых.)
II уровень
1. При обработке 6 г чугуна соляной кислотой выделилось 3,36 л газа (н.у.). Определите содержание железа в чугуне (в %).
2. Определите массовую долю щелочи в растворе, полученном при взаимодействии
23 г натрия с 78 г воды.
3. Рассчитайте массу сульфата цинка, полученного при взаимодействии избытка цинка со 100 мл 20 %-го раствора серной кислоты плотностью 1,14 г/мл.
4. Железную пластинку массой 10 г выдержали в 10 % растворе сульфата меди (II)массой 160 г до полного окончания реакции. Определите массу пластинки после реакции.
5. Смешали 110 г 15%-го раствора гидроксида натрия и 157,5 г 10% раствора соляной кислоты. Определите среду полученного раствора и массу соли в нем.
Контрольные вопросы, задания и тест для отработки НБ по теме:
«Химия металлов»
1) Положение химических элементов металлов в ПСХЭ. Нахождение металлов в
природе.
2) Положение металлов в ПСХЭ и особенности строения их атомов.
3) Давать сравнительную характеристику металлов по положению в ПС.
4)
Какова распространенность металлов в природе?
Как изменяется восстановительная способность металлов в периодах, в главных подгруппах? Почему?
Чем отличаются металлические кристаллические решетки от ионных, атомных?
1 ) Металлы – простые вещества. Получение металлов в промышленности,
) Металлы – простые вещества. Получение металлов в промышленности,
физические свойства металлов.
2) Основные физические свойства простых веществ – металлов. Способы получения, важнейшие восстановители металлов.
3) Описывать физические свойства металлов и объяснять их. Называть способы
получения металлов в промышленности.
4)
В виде каких соединений встречаются в природе хром, свинец? Приведите уравнения реакций получения этих металлов.
Чем объясняется сходство физических свойств металлов?
1 ) Металлы – простые вещества. Химические свойства металлов.
) Металлы – простые вещества. Химические свойства металлов.
2) Важнейшие химические свойства металлов.
3) Составлять уравнения химических реакций, составлять электронный баланс для ОВР.
4)
При взаимодействии 3,45 г щелочного металла с водой образовалось 5,6 л
( н.у) водорода. Назовите щелочной металл.
При взаимодействии 12,4 г оксида одновалентного металла с водой образуется 16 г его гидроксида. Определите металл.
Тест «Химия металлов»
Часть А (задания с выбором ответа)
А1. В Периодической таблице элементов металлами являются все элементы
основных подгрупп III и IV групп
основных подгрупп VII и VIII групп
основных подгрупп IV и V групп
побочных подгрупп
А2. Металлы в свободном состоянии в ходе химических реакций проявляют
только окислительные свойства
только восстановительные свойства
и окислительные свойства, и восстановительные свойства
не проявляют таких свойств
A3. В каком ряду металлические свойства простых веществ ослабевают?
натрий, магний, бериллий
калий, литий, натрий
магний, алюминий, кальций
барий, кальций, калий
А4. Укажите вещество, используемое на подводных лодках для регенерации кислорода из углекислого газа
пероксид натрия
гидроксид натрия
оксид натрия
карбонат натрия
А5. Укажите два металла, каждый из которых реагирует с водой при обычных условиях
1) натрий и серебро 2) калий и цинк
3) кальций и натрий 4) олово и свинец
А6. Укажите металл, который реагирует с водой с образованием щелочи
1) алюминий 2) барий
3) магний 4) серебро
А7. Укажите вещество, при взаимодействии которого с железом образуется FeCl3
1) соляная кислота 2) хлорид натрия
3) хлорид меди(И) 4) хлор
А8. Какое вещество образуется при горении железа в кислороде
1) FeO 2) Fe203
3) Fe304 4) Fe03
A9. Укажите металл, который реагирует и с раствором соляной кислоты, и с раствором хлорида цинка
1) магний 2) медь
3) олово 4) железо
А10. Укажите два металл, каждый из которых не взаимодействует при обычных условиях с разбавленной соляной кислотой
1) медь и магний 2) свинец и серебро
3) цинк и золото 4) олово и железо
A11. Вещество состава C2H5ONa образуется при взаимодействии натрия с
1) хлорэтаном 2) уксусной кислотой
3) фенолом 4) этиловым спиртом
А12. Железо реагирует с каждым из двух веществ:
кислородом и соляной кислотой
водой и хлоридом калия
хлором и оксидом алюминия
серой и сульфатом калия
А13. Укажите металл, способный вытеснить железо из рас-
твора сульфата железа(П)
1) олово 2) медь
3) цинк 4) серебро
А14. Для осуществления превращений: Fe → FeCl2 → FeCl3 → Fe(OH)3 → Fe(NО3)3 использовались следующие реактивы:
А) азотная кислота Б) соляная кислота В) гидроксид натрия Г) хлор.
Укажите правильную последовательность использования этих реактивов.
1) ГБВА 2) БГВА
3) БГАВ 4) БВГА
А15. Определите объем водорода (н.у.), который образуется
при взаимодействии 11,7 г калия с избытком воды
1) 3,36 л 2) 4,48 л
3) 5,6 л 4) 6,72 л
Часть В (задания с кратким ответом)
В1. Установите соответствие между металлом и общей формулой соединения, образующегося при горении этого металла. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
МЕТАЛЛ ОБЩАЯ ФОРМУЛА
А) Li 1) Э3О4
Б) Na 2) Э2О3
B) Мg 3) ЭО2
Г) Al 4) Э2О
Д) Fe 5) ЭО
6) Э2О2
В2. Установите соответствие между веществом, с которым взаимодействует железо, и формулой образующегося при этом продукта. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
ВЕЩЕСТВО ФОРМУЛА ПРОДУКТА
А) сера 1) FeCl2
Б) кислород 2) FeCl3
В) хлор 3) FeS
Г) соляная кислота 4) Fe2S3
5) FeO
6) Fe3O4
В3. Определите вещества А—Г в схеме превращений:
+О2 +Na +H2О +Н2SO4
Na → A → Б → В → Г
Среди нижеперечисленных соединений выберите правильную последовательность веществ А—Г:
сульфит натрия 4) пероксид натрия
оксид натрия 5) сульфат натрия
карбонат натрия 6) гидроксид натрия
Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
В4. Установите соответствие между названием реагента, вступающего в реакцию с натрием, и названием основного продукта, образующегося в ходе этой реакции. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
РЕАГЕНТ ПРОДУКТ
A) этанол 1) этан
Б) фенол 2) ацетат натрия
B) вода 3) этилат натрия
Г) хлорэтан 4) фенолят натрия
бутан
гидроксид натрия
В5. Установите соответствие между двумя находящимися в водном растворе в контакте металлами и тем из них, который будет активно коррозировать. Ответ дайте в виде последовательности цифр, соответствующих буквам по алфавиту.
ДВА МЕТАЛЛА КОРРОЗИРУЮЩИЙ МЕТАЛЛ
Fe и Zn 1) медь
Б) Fe и Sn 2) магний
В) Zn и Mg 3) олово
Г) Cu и Sn 4) цинк
5) железо
Игровые задания
Загадки о металлах
Он в теченье многих лет был причиной многих бед. (Золото)
Был металл серебристо-белым, в соединении стал мелом. (Кальций)
Красит пламя в желтый цвет, в воду кинь – его уж нет. (Натрий)
К восьмой группе отнесен, в честь России назван он. (Рутений)
«Камнем» назван он людьми, но попробуй-ка возьми. (Литий)
Из него солдатик твой, не болеет он « чумой». (Олово)
В старину ценилась дорого,
Цветом красная, как золото,
Постоянно с ним дружна,В электротехнике очень нужна. (Медь)
Самый распространенный в земной коре металл. (Алюминий)
Металл, обнаруженный в упавших метеоритах. (Железо)
Металл, обладающий бактерицидными свойствами. (Серебро)
Металл, широко используемый в электротехнике. (Медь)
«Химические перевертыши»
Разговор - ртуть, крик - платина. ( Слово - серебро, молчание - золото).
Гладь металл, пока холодно. ( Куй железо, пока горячо).
Пролежал холод, сушь и оловянные трубы. (Прошел огонь, воду и медные трубы).
Не та грязь, что тусклая. ( Не то золото, что блестит).
Звери живут за неметалл. ( Люди гибнут за металл).
Викторина по теме «Металлы»
В каких пищевых продуктах содержится много железа?
Какой самый распространенный на Земле металл?
Какие металлы можно расплавить на ладони?
Какие элементы-металлы названы в честь стран?
Самый древний сплав.
Каким расплавленным металлом можно заморозить воду?
Какой металл и почему называют «металлом хирургов»?
Назовите первый искусственно полученный металл.
Какие элементы-металлы названы в честь частей света?
Какие вам известны металлы-микроэлементы, управляющие многими жизненно важными процессами, протекающими в живых организмах?
Какой элемент-металл назван по имени острова?
Какой металл используют для защиты от рентгеновского излучения?
Какой металл входит в состав хлорофилла?
Соли какого щелочного металла используют в производстве минеральных удобрений?
Какой металл называют металлом консервной банки?
Какой драгоценный металл является одним из самых лучших катализаторов для различных химических процессов?
Какой из элементов-металлов, существующих в природе, имеет самую большую атомную массу?
Без какого металла невозможна фотография?
В каких овощах и фруктах содержится много магния?
В 1889 г, когда Менделеев находился в Лондоне, ему в знак признания выдающихся заслуг в развитии химии был преподнесен ценный подарок – весы, сделанные из золота и второго металла. Назовите второй металл.
Некоторый металл на морозе «заболевает»: его серебристо-белые слитки сначала становятся тускло-серыми, а затем рассыпаются в серый порошок. Назовите металл. Как называют это «заболевание»?
Какой металл лучше других проводит тепло и электрический ток?
Ответы на вопросы викторины
1. Гречиха, соя, какао
2. Алюминий
3. Галлий и цезий
4. Рутений, полоний, германий, франций, галлий
5. Бронза
6. Ртутью, т.к. она плавится при температуре -39 0С
7. Тантал, т.к. у него высокая биологическая совместимость с живыми тканями
8. Технеций
9. Европий, америций
10. Железо, марганец, медь, цинк, молибден, кобальт
11. Медь
12. Свинец
13. Магний
14. Соли калия
15. Олово
16. Платина
17. Уран
18. Серебро
19. Абрикосы, персики, цветная капуста
20. Алюминий, т.к. в те годы его получали в микроколичествах, цены на него были высокими.
21. Олово, оловянная «чума»
22. Серебро
Определите металл
На доске записаны символы металлов:
Li, Na, A1, К, Fe, Co, Ni, Zn, Ga, Ag, Sn, Cs, Та, W, Os, Pt, Au, Pb, Hg
Выберите среди них те, о которых идет речь в следующих сообщениях.
Этот металл самый распространенный в земной коре, но из руды его выделили только примерно 150 лет назад, и в течение последующих 60 лет он был большой редкостью и ценился дороже золота. В 1854 г. стоимость 1 кг этого металла составляла 1200 рублей (в 270 раз дороже серебра), а в 1899 г. — 1 рубль. Также известно, что у наследника русского царя была погремушка, сделанная из этого металла. (Аl)
Долгое время считали, что этого металла очень мало в природе. С созданием спектроскопа появилась возможность обнаруживать присутствие ничтожно малых количеств вещества. И вот тогда этот металл стали находить в самых неожиданных местах: в граните, соленой воде Атлантического океана, чае, молоке, табачной золе и даже в человеческой крови. Этот металл самый легкий, если бы из него удалось сделать самолет, то два человека легко подняли бы его. (Li)
Этот металл используют при изготовлении электрических контактов, а его оксид применяют при лечении артритов. Он обладает самой высокой плотностью, т. е. он самый тяжелый. (Os)
Этот металл используют для борьбы с коррозией, так как он не взаимодействует с кислотами и щелочами. Например, на заводах, производящих соляную кислоту, аппаратура, изготовленная из этого металла, служит 20-25 лет. Этот металл используется и в хирургии для замены костей, например из него изготавливают черепные пластинки, поэтому его иногда называют металлом хирургов. (Та)
С этим металлом связано происхождение некоторых слов. В Древней Руси мерой стоимости различных товаров служили бруски этого металла. Если тот или иной предмет стоил дешевле, чем целый брусок, то от бруска отрубали куски соответствующего размера. Отрубленные части именовались рублями. От них и пошло название основной денежной единицы, принятой в нашей стране. Латинское название этого металла носит одно из государств в Южной Америке. Этот металл применяется в фотографии, для получения зеркальных поверхностей. (Ag)
Этот металл обладает любопытными свойствами: плавится от тепла ладони, воспламеняется на воздухе, взрывается при соприкосновении с водой, бурно реагирует со многими веществами. Химики используют эти качества. Так, при создании вакуума в приборах в них вводят небольшой кусочек этого металла, и он мгновенно поглощает остатки воздуха, которые нельзя было выкачать насосом. (Cs)
Этот металл используют в производстве различных физических приборов, взрывчатых веществ, его соединения применяют при пломбировании зубов. Если взять этот металл в твердом виде, то им можно заморозить воду. (Hg)
Этот металл входит в состав типографского сплава, его оксид используют как добавку при производстве хрустального стекла, главные потребители этого металла — аккумуляторная и кабельная промышленность. Кроме того, его используют для защиты от рентгеновского излучения. (Рb)
Роберт Вуд, знаменитый американский физик и великий любитель всяческих проделок, направлялся из лаборатории домой на обед. Дорога шла через негритянский квартал. Была зимняя оттепель, и огромная лужа распростерлась по мостовой между тротуарами, на которых толпились негры, вышедшие погреться на солнышке. Проходя мимо них, Вуд громко закашлял и на виду у всех плюнул в лужу, незаметно бросив в том же направлении кусок вещества величиной с грецкий орех. Прогремел взрыв, полетели искры, большое желтое пламя поднялось над поверхностью воды. Затем раздались вопли, молитвы и один голос громче, чем все остальные, вместе взятые, пробасил: «Спасайся кто может! Этот человек плюнул огнем! На вид он молодой, но только сам старый дьявол умеет это делать!» Какой металл упомянут в рассказе? (Na)
Учебно-методический комплекс по химии на тему: «Металлы. Их свойства, значение и применение».
Подтверждение авторства
Пожалуйста, введите ваш Email.
Если вы хотите увидеть все свои работы, то вам необходимо войти или зарегистрироваться
Полезное для учителя
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт