Тема уроку: Йонні рівняння. Складання йонних рівнянь
Цілі уроку: закріпити навички й уміння складати йонні рівняння в розчинах електролітів; розвивати навички проведення хімічного експерименту на прикладі реакцій у розчинах електролітів.
Тип уроку: застосування знань, умінь і навичок.
Форми роботи: лабораторна робота, тренувальні вправи.
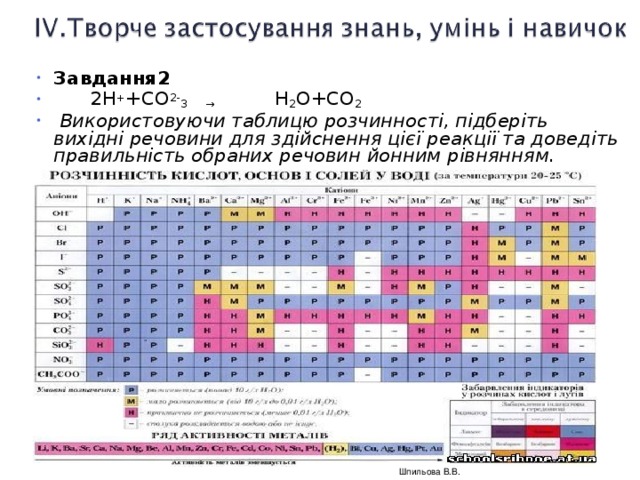
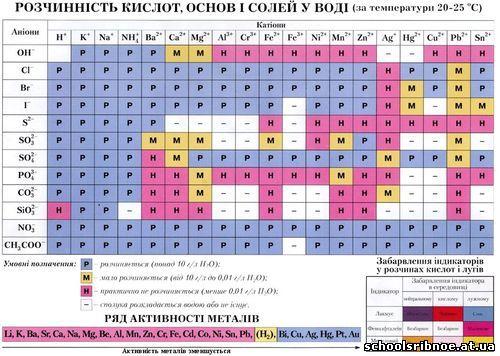
Обладнання: підручник, таблиця розчинності, лабораторне устаткування й хімічні реактиви: AgNO2, NaCl , BaCl2, Na2SO4, Na2CO3, HCl, NaOH, H2SO4, Ca(OH)2, ПК чи ноутбук.
ХІД УРОКУ
І. Організація класу.
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань.
(З основами бесіди).
Учні записуюсь на дошці підібрані ними пари електролітів по ланцюжку, наступні складають йонне рівняння і пропонують своє завдання.
Фронтально з’ясовуємо:
у яких реакціях виконуються умови незворотного протікання реакцій;
виправляємо помилки й коригуємо відповіді;
пригадуємо визначення кислоти, основи, солі з погляду електролітичної дисоціації;
пригадуємо поняття « рівняння дисоціації»;
пригадуємо алгоритм складання рівняння дисоціації;
ІІІ. Вивчення нового матеріалу.
Вчитель оголошує тему уроку та пояснює новий матеріал.
Учні записують тему та основні поняття, терміни, реакції в зошиті.
Йонне рівняння – тип хімічного рівняння, в якому реагенти і продукти реакції записані в йонному вигляді.
Умови, за яких йонні реакції йдуть до кінця
(За допомогою ПК чи ноутбука учням демонструються слайди із рівняннями реакцій .):
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + 2Cl‾ + 2Na+ + SO42‾ = BaSO4↓ + 2N+ + 2Cl‾
Ba2+ + SO42‾ = BaSO4↓
(Якісна реакція на йони SO42-)
Висновок: реакції йонного обміну відбуваються до кінця, якщо утворюється осад.
СаСО3 + 2НCl = СаСl2 + CO2↑ + H2O
СаСО3 + 2Н+ + 2Cl‾ = Са2+ + 2Сl‾ + CO2↑ + H2O
СаСО3 + 2Н+ = Са2+ + CO2↑ + H2O
Висновок: реакції йонного обміну відбуваються до кінця, якщо виділяється газ.
NaOH + HCl = NaCl + H2O
Na+ + OH‾ + H+ + Cl‾ = Na+ + Cl‾ + H2O
OH‾ + H+ = H2O
Висновок : реакції йонного обміну відбуваються до кінця, якщо утворюється вода.
Щоб переконатися в сказаному виконаємо лабораторні досліди та запишемо рівняння реакцій у йонній повній та скороченій формах.
Перед виконанням дослідів наголошується увага на правила ТБ та інструкції виконання .
Сьогодні вам доведеться працювати з досить небезпечними речовинами. Пригадаємо деякі правила поводження з ними. Вони сформульовані у вигляді вірша. Давайте прочитаємо їх.
Учні читають вірш .
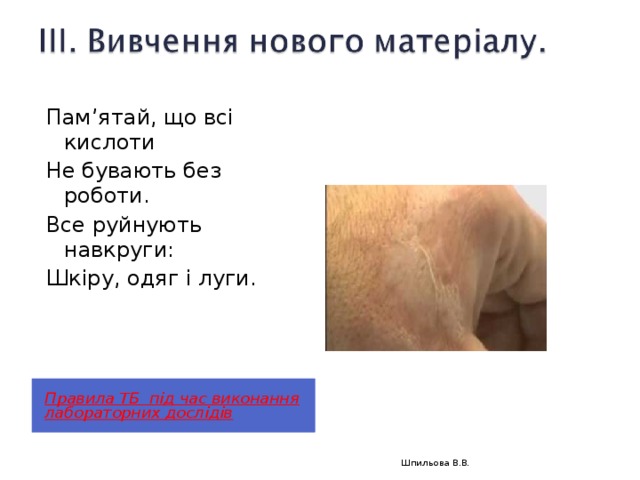
Пам’ятай, що всі кислоти
Не бувають без роботи.
Все руйнують навкруги:
Шкіру, одяг і луги.
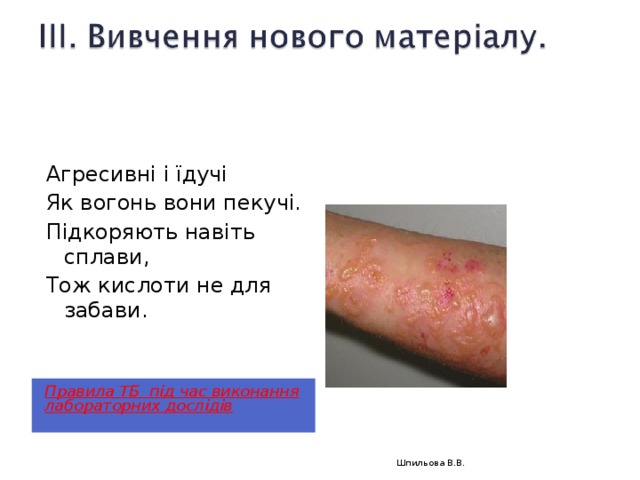
Агресивні і їдучі
Як вогонь вони пекучі.
Підкоряють навіть сплави,
Тож кислоти не для забави.
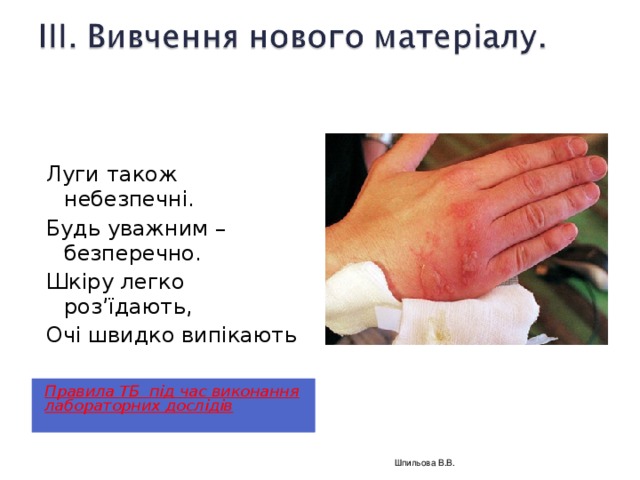
Луги також небезпечні.
Будь уважним – безперечно.
Шкіру легко роз’їдають,
Очі швидко випікають
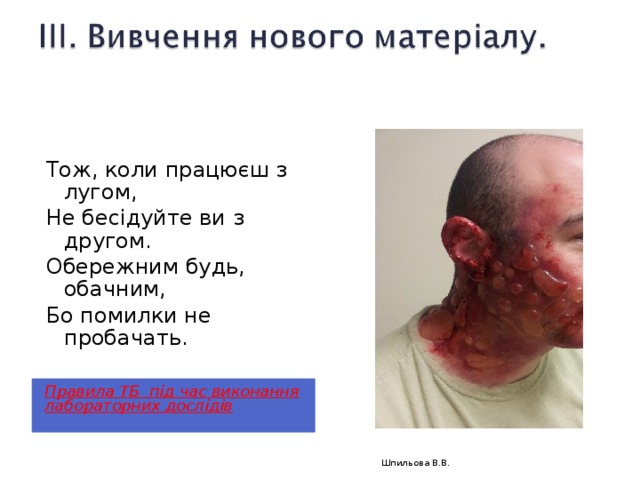
Тож, коли працюєш з лугом,
Не бесідуйте ви з другом.
Обережним будь, обачним,
Бо помилки не пробачать.
Закінчимо повторення правил ТБ такою вправою. Я пропоную уважно простежити за моїми діями і сказати, які правила ТБ я порушила.
Знайдіть помилки з Т.Б.
налити розчин – етикетка не під рукою.
Затиснути тримач майже біля дна.
Нагрівати на спиртівці – отвір пробірки на себе.
Понюхати – отвір прямо до отвору пробірки.
Лабораторний дослід №2.
Реакції обміну в розчинах електролітів з випадання осаду
Виконати експеримент і записати у йонній формі рівняння реакцій.
Завдання. Здійсніть реакцію між речовинами, запишіть рівняння у молекулярній та йонних формах:

AgNO2+NaCl
(Згадуємо, що це якісна реакція на йони Cl- )
Лабораторний дослід №3.
Реакція обміну в розчинах електролітів з виділенням газу

Na2CO3+HCl
(Якісна реакція на йони CO32-)
Лабораторний дослід №4.
Реакції обміну в розчинах електролітів з утворенням води

NaOH+H2SO4

Ca(OH)2+HCl
ІV. Творче застосування знань, умінь і навичок (практика на прикладах), експрес опитування. (Перелік завдань дивитись додатки, ).
Ми провели експеримент.
Завдання 1
Запишіть рівняння:

AgNO3+NaCl


AgNO3+HCl

AgNO3+CaCl2
Чим відрізняються ці три рівняння?
Що в них загального?

Ag++Cl- AgCl
Завдання2
Аналогічно сутність досліду 2
 2H++CO2-3 H2O+CO2
2H++CO2-3 H2O+CO2
Використовуючи таблицю розчинності, підберіть вихідні речовини для здійснення цієї реакції та доведіть правильність обраних речовин йонним рівнянням.
Завдання 3
Підберіть вихідні речовини для здійснення реакцій .
Запропонуйте кілька реакцій за йонним рівнянням.
(самостійна робота виконується під контролем учителя, варіанти роздаються вчителем на заздалегідь приготовлених картках)
Варіант І
 Hg+2+S2- HgS
Hg+2+S2- HgS
 2H++SiO2-3 H 2SiO3
2H++SiO2-3 H 2SiO3
Варіант ІІ
 Ca2++CO2-3 CaCO3
Ca2++CO2-3 CaCO3
 Fe3++3OH- Fe(OH)3
Fe3++3OH- Fe(OH)3
Варіант ІІІ
 Al3++3OH- Al(OH)3
Al3++3OH- Al(OH)3
 Zn2++S2- ZnS
Zn2++S2- ZnS
Завдання 4.
Експрес опитування (тестова робота ) на виявлення засвоєння матеріалу .
Тестові завдання роздаються учням на підготовлених аркушах. Учні виконують завдання, що їм під силу.
Роботи аналізуються вчителем на уроці при наявності часу, а якщо часу не вистачає , то вчитель використовує аналіз робіт для розробки наступного уроку (Використовуються аналогічні завдання чи завдання в яких найбільше виникло трудностей , вони пояснюються вчителем. А також виконані роботи оцінюються і за вибором учня отримані бали можуть бути виставлені на наступному уроці).
(дивитись додаток 1).
Перевірка експрес-опитування виконується учнями обмінявшись роботами, а ключі-відповіді вчитель записує на дошці.
Відповіді : варіант № 1 1-В, 2-А, 3-Б, 4-Г, 5-Б, 6-Г, 7-Б, 8-В, 9-В, 10-Г, 11-А, 12-А.
варіант № 2 1-Б, 2-В, 3-А, 4-Г, 5-А, 6-Г, 7-А, 8-Б, 9-В, 10-Б, 11-Г, 12-Г.
Завдання 5.
Робота з підручником.
Виконання вправ та завдань підручника (Г.А. Лашевська, ст.86-88)
ІV. Підбиття підсумків уроку
Учитель підбиває підсумки уроку, оцінює роботу учнів.
V.Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи, підготуватися до практичної роботи №2.
Література:
Г.А. Лашевська «Хімія» 9 клас.
І.Ю. Старовойтова, О.В. Люсай «Усі уроки хімії 9клас».
О. Дубовик, Р.Сергуніна «Робочий зошит з хімії 9 клас».
В.І. Гордієнко ,навчально-методичний посібник «Хімія 9 клас».
Л.В. Турищева, наочний довідник «Хімія».
Київський університет імені Бориса Грінченка
Інститут післядипломної педагогічної освіти
КМЦ природничо-математичної освіти
Йонні рівняння. Складання йонних рівнянь.
Роботу виконала
Вчитель хімії гімназії «Грейс»
Романюк Галина Василівна
2012 рік
Додаток №1.
Варіант № 1.
1. Вкажіть речовину А, яка бере участь у реакції, що відповідає скороченому йонному рівнянню А + 2Н+ → SO2↑ + H2O + Ca2+ :
A. CaO Б. CaSO4 В. CaSO3 Г. CaCO3
2. Вкажіть йони, які взаємодіють, якщо до розчину барій нітрату долити розчин натрій сульфату:
А. Вa2+ і SO42- Б. Na+ і NO3- В. Ba2+ і Na+ Г. SO42- і NO3-
3. Вкажіть реагенти в реакції, яка відповідає скороченому йонному рівнянню Mg2+ + 2F- → MgF2↓:
A. Mg3(PO4)2 , HF Б. MgCL2 , NaF В. Mg3(OH)2 , HF Г. MgCO3 , KF
4. Вкажіть пару йонів, які можуть одночасно міститися в розчині:
А. Cu2+ і OH- Б. Cu2+ і S2- В. Cu2+ і CO32- Г. Cu2+ і CL-
5. Вкажіть реагенти в реакції, яка відповідає скороченому йонному рівнянню H+ + OH- → H2O:
A. H2SO4 , Ba(OH)2 Б. HNO3 , Sr(OH)2 В. AL(OH)3 , HCL Г. HNO3 , Na2O
6. Вкажіть скорочене йонне рівняння, що відповідає реакції
Fe2O3 + 6HCL → 2FeCL3 + 3H2O:
А. 2Fe3+ + 6H+ → 2Fe3+ + 3H2O
Б. 2Fe3+ + 6H+ → 2Fe3+ + 6CL- + 3H2O
В. 3O2- + 6H+ → 3H2O
Г. Fe2O3 + 6H+→2Fe3+ + 3H2O
7. Вкажіть речовини А і D , які беруть участь у реакції, що відповідає скороченому йонному рівнянню А + D → 2Na+ + 2OН- :
А. Na , H2O Б. Na2O , H2O В. NaCL , H2O Г. NaH , H2O
8. Вкажіть пару йонів, які не можуть одночасно міститися у розчині:
А. Ag+ і NO3- Б. K+ і PO43- В. Ag + і PO43- Г. K+ і NO3-
9. Вкажіть схему реакції йонного обміну, яка перебуває у розчині практично до кінця:
А. FeCL2+ H2SO4 → В. FeCL2+ KOH→
Б. Fe(NO3)2 + KCL→ Г. FeSO4 + KNO3→
10. Вкажіть формули електролітів, при дисоціації яких утворюються йони Zn2+, K+, CL- , CO32-:
А. KCL , ZnCL2 , ZnCO3 В. K2 CO3, ZnCO3 , KCL
Б. ZnCO3, KCL, KHCO3 Г. KCL , K2 CO3, ZnCL2
11. Вкажіть йони, які взаємодіють під час хімічної реакції між магній хлоридом і натрій ортофосфатом:
А. Mg2+ і PO43- Б. Na+ і Mg2+ В. CL- і PO43- Г. Na+ і CL-
12. Вкажіть формули реагентів у реакції, яка відповідає скороченому йонному рівнянню S2-+ 2H+→H2S↑:
А. Na2S і HCL Б. ZnS і HCL В. FeS і H2PO4 Г. PbS і H2PO4
Варіант № 2.
1. Вкажіть речовину А, яка бере участь у реакції, що відповідає скороченому йонному рівнянню А + 3Н+ → AL3+ + 3H2O:
A. ALCL3 Б. AL(OH)4 В. AL(NO3)3 Г. AL2O3
2. Вкажіть йони, які взаємодіють, якщо до розчину калій карбонату долити розчин кальцій хлориду:
А. K+ і CL- Б. CL- і CO32- В. CO2- і Ca2+ Г. Ca2+ і K+
3. Вкажіть реагенти в реакції, яка відповідає скороченому йонному рівнянню H+ + OH- → H2O:
A. Ba(OH)2 i HCL Б. HBr i Cu(OH)2 B . AL(OH)3 i HCL Г. NaOH i H2SiO3
4. Вкажіть пару йонів, які можуть одночасно міститися в розчині:
А. Cr3+ і CL- Б. Cr3+ і NO3- В. Cr3+ і SO42- Г. Cr3+ і OH-
5. Вкажіть реагенти в реакції, яка відповідає скороченому йонному рівнянню 2H+ + SO32- → SO2 ↑+ H2O:
A. K2SO3 , HNO3 Б. ZnSO3 , HCL В. CuSO3 , HBr Г. MgSO3 , H2SO4
6. Вкажіть скорочене йонне рівняння, що відповідає реакції
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O:
А. H+ + OH- → H2O
Б. Cu2+ + SO42- → CuSO4
В. Cu2+ + 2H+ → CuSO4 + H2O
Г. Cu(OH)2 + 2H+→Cu2+ + 2H2O
7. Вкажіть речовини А і D , які беруть участь у реакції, що відповідає скороченому йонному рівнянню А + D → 2H+ + SO42- :
А. SO3 , H2O Б. SO2 , H2O В. H2SO3 , H2O Г. Na2SO4 , H2O
8. Вкажіть пару йонів, які можуть одночасно міститися у розчині:
А. Fe3+ і OH- Б. Fe3+ і CL- В. Fe3+ і PO43- Г. і Fe3+ i S2-
9. Вкажіть схему реакції йонного обміну, яка перебуває у розчині практично до кінця:
А. K2CO3 + NaCL → В. H2SO4 + Na2CO3 →
Б. NaCL + H2SO4→ Г. NaNO3 + K2SO4→
10. Вкажіть формули електролітів, при дисоціації яких утворюються йони Cu2+, Na+, S2- , NO3-:
А. CuS , Cu(NO3)2 , Na2S В. Cu(NO3)2 , NaHS, CuS
Б. Na2S, NaNO3, Cu(NO3)2 Г. CuS , NaNO3 , Na2S
11. Вкажіть йони, які взаємодіють під час хімічної реакції між натрій сульфітом і нітратною кислотою:
А. Na+ і NO3- Б. NO3- i SO32- В. Na+ i H+ Г. H + і SO32-
12. Вкажіть формули реагентів у реакції, яка відповідає скороченому йонному рівнянню 3Ag+ + PO43-→ Ag3PO4↓:
А. AgBr і H3PO4 Б. AgCL i K3PO4 В. Ag2S і Na3PO4 Г. AgNO3 і K3PO4
Додаток № 2.
Завдання № 1.
Запишіть у молекулярній і йонній формах рівняння реакцій, що відбуваються в розчині між електролітами, вкажіть ознаки проходження кожної з них:
HNO3+ Ba(OH)2→
AgNO3+ K3PO4→
CaCO3+ H2SO4→
Завдання № 3.
Складіть йонно-молекулярні рівняння реакцій, що відбуваються в розчині між такими електролітами:
А) ферум (ІІІ) нітрат і натрій гідроксид;
Б) цинк сульфат і барій хлорид;
В) калій гідроксид і сульфатна кислота;
Г) літій сульфід і хлоридна кислота.
Завдання №4.
Вкажіть, з якими із перерахованих речовин може взаємодіяти сульфатна кислота:
А. SO3, Б. MgO , В. CuCL2 , Г. Zn(OH)2, Д. H2O, Е. K2CO3, Є. NaOH
Завдання №5.
Напишіть рівняння реакцій у молекулярному та йонному вигляді між речовинами, що взаємодіють одна з одною:
BaCL2 , HCL, K2O, NaOH, K2CO3, Ca.
Завдання №6.
Закінчіть рівняння реакцій та складать йoнні рівняння:
___ Fe(NO3)3+ _______________= ___ Fe(OH)3↓+ ___________________
___BaS + _________________=___BaSO4↓+ _______________________
___MgSO4+ _______________=___Mg3(PO4)2↓ + ____________________
Урок № 2
Тема: Йонні рівняння реакцій. Складання йонних рівнянь.
Мета: Закріпити й удосконалити навички і вміння складати йонні рівняння реакцій в розчинах електролітів; розвивати навички проведення хімічного експерименту на прикладі реакцій в розчинах електролітів. Виховувати охайність, бережливе ставлення до шкільного майна.
Обладнання: таблиця розчинності, лист з віршами про ТБ.
Вчителю: пробірка, затискач, спиртівка, реактиви, ті що й учням. Дві пронумеровані пробірки з HCl і NaOH, лакмус, фенолфталеїн, FeCl2, NaOH, Na2CO3, H2SO4. Кубик, слайди із рівняннями реакцій, відео програма «Хімія 9 кл»,
Учням: Na2SO4, BaCl2, CaCO3, HCl, NaOH, фенолфталеїн, 3 пробірки.
Тип уроку: урок формування вмінь і навичок.
Методи і прийоми: репродуктивна бесіда, «слайд – шоу», проблемне питання, виконання лабораторних дослідів, відео-тестування (за ПК), створення нестандартних ситуацій.
Хід уроку
І. Актуалізація опорних знань. Перевірка домашнього завдання.
1. Перевірка Д/з №3 ст. 77 (2учня біля дошки)
№ 5 ст 78 (1 учень біля дошки)
2. Репродуктивна бесіда
- Які реакції називаються реакціями йонного обміну?
- При яких умовах реакції йонного обміну відбуваються до кінця? (один учень – одна умова)
- Які речовини не розпадаються на йони і записуються в рівняннях йонного обміну в молекулярному вигляді?
3. «Слайд-шоу»
Завдання: Які реакції йонного обміну відбуваються до кінця?
(За допомогою ПК чи ноутбука учням демонструються слайди із рівняннями реакцій . Учні повинні плеснути в долоні, якщо побачать можливі реакцію йонного обміну)
MgCl2 + 2AgNO3 = Mg(NO3)2 + 2AgCl↓
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Ca(OH)2 + 2NaCl = CaCl2 + 2NaOH
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Na2SO4 + BaCl2 = 2NaCl + BaSO4↓
Na2SO4 + FeCl2 = 2NaCl + FeSO4
4.Проблемне питання.
Чому під час печії люди вживають розчин питної соди?
ІІ. Мотивація навчальної діяльності.
Ви вже знаєте, що таке йонні рівняння реакції, знаєте як складати ці рівняння. Але практика без теорії сліпа, а теорія без практики мертва. Тому, пропоную вам сьогодні підтвердити теоретичні знання отримані на попередньому уроці, виконанням лабораторних дослідів.
Мета уроку:
закріпити знання і удосконалити навички складання реакцій йонного обміну.
дослідити на практиці, коли реакції йонного обміну відбуваються до кінця.
ІІІ. Виконання лабораторних дослідів.
Інструктаж з ТБ.
На попередньому уроці ми з’ясували при яких умовах реакції йонного обміну відбуваються до кінця. Пригадайте ці умови.
Сьогодні я пропоную вам перевірити на практиці, чи дійсно це так.
Перед тим, як розпочати роботу пригадаємо правила техніки безпеки.
Перегляд відео «ТБ» Програма «Хімія 9 клас»
Сьогодні вам доведеться працювати з досить небезпечними речовинами. Пригадаємо деякі правила поводження з ними. Вони сформульовані у вигляді вірша. Давайте прочитаємо їх.
Учні читають вірш .
Пам’ятай, що всі кислоти
Не бувають без роботи.
Все руйнують навкруги:
Шкіру, одяг і луги.
Агресивні і їдучі
Як вогонь вони пекучі.
Підкоряють навіть сплави,
Тож кислоти не для забави.
Луги також небезпечні.
Будь уважним – безперечно.
Шкіру легко роз’їдають,
Очі швидко випікають
Тож, коли працюєш з лугом,
Не бесідуйте ви з другом.
Обережним будь, обачним,
Бо помилки не пробачать.
Закінчимо повторення правил Т.Б. такою вправою. Я пропоную уважно простежити за моїми діями і сказати, які правила ТБ я порушила.
Знайдіть помилки з Т.Б.
налити розчин – етикетка не під рукою.
Затиснути тримач майже біля дна.
Нагрівати на спиртівці – отвір пробірки на себе.
Понюхати – отвір прямо до отвору пробірки.
Виконання лабораторних дослідів. (висновок до лабораторного досліду формулюють учні)
Лабораторний дослід №2
Реакції обміну в розчинах електролітів з випаданням осаду.
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + 2Cl‾ + 2Na+ + SO42‾ = BaSO4↓ + 2N+ + 2Cl‾
Ba2+ + SO42‾ = BaSO4↓
Висновок: реакції йонного обміну відбуваються до кінця, якщо утворюється осад.
Лабораторний дослід №3
Реакції обміну в розчинах електролітів з виділенням газу.
СаСО3 + 2НCl = СаСl2 + CO2↑ + H2O
СаСО3 + 2Н+ + 2Cl‾ = Са2+ + 2Сl‾ + CO2↑ + H2O
СаСО3 + 2Н+ = Са2+ + CO2↑ + H2O
Висновок: реакції йонного обміну відбуваються до кінця, якщо виділяється газ.
Лабораторний дослід №4
Реакції обміну в розчинах електролітів з утворенням води.
NaOH + HCl = NaCl + H2O
Na+ + OH‾ + H+ + Cl‾ = Na+ + Cl‾ + H2O
OH‾ + H+ = H2O
Висновок: реакції йонного обміну відбуваються до кінця, якщо утворюється вода.
ІV. Виконання вправ на закріплення.
1. На уроці ми з вами складали йонні рівняння реакцій виходячи з молекулярного.
А зараз давайте спробуємо попрацювати навпаки.
Перед вами на дошці записане скорочене йонне рівняння реакції. Використовуючи реактивами, які ви бачите на столі у вчителя, складіть молекулярне рівняння реакції, яке б відповідало такому скороченому йонному рівнянню. (Учні пропонують реактиви, демонструють цю реакцію, складають повне йонне та молекулярне рівняння реакції)
Fe2+ + ОН‾ = Fe(ОН)2↓
СО32‾ + 2Н+ = CO2↑ + H2O
Відео – тести. Програма «Хімія 9 клас»
Експрес – тест. Йонні рівняння реакції.
Позначте скорочене йонне рівняння, яке відповідає реакції між ферум (ІІІ) нітратом і калій гідроксидом у розчині.
1) Fe3+ + 3OH¯ = Fe(OH)3↓
2) K+ + NO3¯ = KNO3
2. Позначте ту пару йонів, яка бере участь у хімічній реакції між MgSO4 і Ba(NO3)2 у розчині.
1) Mg2+ і NO3¯
2) Mg2+ і Ba2+
3) Ba2+ і SO42¯
4) NO3¯ і SO42¯
3. Позначте ту пару йонів, яка бере участь у хімічній реакції між KOH і HNO3 у розчині.
1) K+ і NO3¯
2) H+ і NO3¯
3) H+ і OH¯
4) K+ і OH¯
4. Позначте пари тих йонів, які не можуть одночасно перебувати в розчині.
1) Са2+ і РO43¯
2) Fe3+ і OH¯
3) СO32¯ і Сl¯
4) NO3¯ і Ba2+
5. Позначте пари тих йонів, які можуть одночасно перебувати в розчині.
1) Са2+ і Br¯
2) H+ і OH¯
3) СO32¯ і H+
4) NO3¯ і Zn2+
V. Підведення підсумку уроку. Виставлення оцінок.
Д/з. §12 (Н.М. Буринська)
Контрольні питання №3,4 ст. 12, 15, 17 (зошит Гога) -всім
Впр 7, 8* Ст. 78 ( Н.М. Буринська) –для учнів (для бажаючих)

 http://os1.i.ua/3/1
http://os1.i.ua/3/1 /9830348_caf44cc.jpg
/9830348_caf44cc.jpg


 http://os1.i.ua/3/1
http://os1.i.ua/3/1 /9830348_caf44cc.jpg
/9830348_caf44cc.jpg