
АЛКЕНЫ
Муковнина Елена Владимировна
МАОУ гимназия №69 имени
С. Есенина г. Липецка

Общая информация
Алке́ны ( олефины , этиленовые углеводороды ) — ациклические непредельные углеводороды с общей формулой C n H 2n .
В первые этилен был получен в 1669 году немецким химиком и врачом Бехером действием серной кислоты на этиловый спирт . Ученый установил, что его «воздух» более химически активен, чем метан, однако, идентифицировать полученный газ он не смог и названия ему не присвоил.
Александр Михайлович Бутлеров
Жан-Батист Андре Дюма
Иоганн Иоахим Бехер
Ю́стус фон Ли́бих
Йёнс Якоб Берце́лиус

Нахождение в природе и физиологическая роль
В природе ациклические алкены практически не встречаются .
Простейший представитель этого класса органических соединений — этилен (C 2 H 4 ) — является гормоном для растений и в незначительном количестве в них синтезируется.
Один из немногих природных алкенов — мускалур (цис- трикозен-9) является половым аттрактантом самки домашней мухи (Musca domestica).
Низшие алкены в высоких концентрациях обладают наркотическим эффектом . Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей.
Отдельные представители:
- Этилен — вызывает наркоз, обладает раздражающим и мутагенным действием.
- Пропилен — вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие.
- Бутен-2 — вызывает наркоз, обладает раздражающим действием.
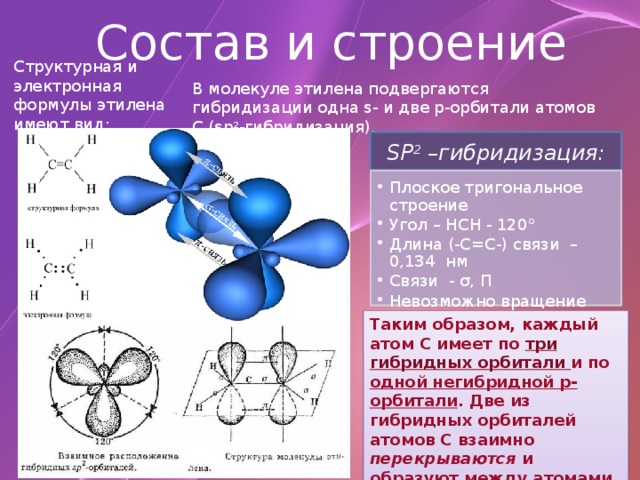
Состав и строение
Структурная и электронная формулы этилена имеют вид:
В молекуле этилена подвергаются гибридизации одна s- и две p-орбитали атомов C (sp 2 -гибридизация).
SP 2 –гибридизация:
- Плоское тригональное строение Угол – HCH - 120° Длина (-С=С-) связи – 0,134 нм Связи - σ, П Невозможно вращение относительно (-С=С-) связи
- Плоское тригональное строение
- Угол – HCH - 120°
- Длина (-С=С-) связи – 0,134 нм
- Связи - σ, П
- Невозможно вращение относительно (-С=С-) связи
Таким образом, каждый атом C имеет по три гибридных орбитали и по одной негибридной p-орбитали . Две из гибридных орбиталей атомов C взаимно перекрываются и образуют между атомами C

Изомерия
Для алкенов возможна структурная и геометрическая изомерия.
Геометрическая или цистрансизомерия.
Структурная изомерия бывает трех видов:
О заместителях, расположенных в плоскости молекулы по одну сторону от двойной связи, говорят, что они находятся в цисположении относительно друг друга, а по разные стороны — в трансположении.
- изомерия углеродного скелета:
- изомерия положения двойной связи:

Физические свойства
Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены:
- газы — с C 2 H 4 до C 4 H 8 ;
- Жидкости — с пентена C 5 H 10 до гексадецена C 17 H 34 включительно;
- твёрдые вещества — а начиная с октадецена C 18 H 36 .
Алкены не растворяются в воде , но хорошо растворяются в органических растворителях.

Химические свойства
Присоединение галогенов:
Присоединение галогеноводородов (HHal) и воды к несимметричным алкенам происходит по правилу В.В.Марковникова (1869). Водород кислоты Hhal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом С, при котором находится меньшее число атомов водорода.
Присоединение водорода (реакция гидрирования):
Присоединение воды (реакция гидратации)
![Химические свойства Горение алкенов на воздухе. При поджигании алкены горят на воздухе: 2СН 2 =СНСН 3 + 9О 2 → 6СО 2 + 6Н 2 О . С кислородом воздуха газообразные алкены [C 2 –C 4 ] образуют взрывчатые смеси . Алкены окисляются перманганатом калия в водной среде, что сопровождается обесцвечиванием раствора KMnO 4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах С). Этот процесс – гидроксилирование алкенов: Алкены окисляются кислородом воздуха в эпоксиды при нагревании в присутствии серебряных катализаторов: Полимеризация алкенов – связывание множества молекул алкена друг с другом. Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных -cвязей и образования новых межмолекулярных -cвязей:](https://fsd.kopilkaurokov.ru/uploads/user_file_562928681ef5e/img_user_file_562928681ef5e_0_7.jpg)
Химические свойства
Горение алкенов на воздухе. При поджигании алкены горят на воздухе:
2СН 2 =СНСН 3 + 9О 2 → 6СО 2 + 6Н 2 О .
С кислородом воздуха газообразные алкены [C 2 –C 4 ] образуют взрывчатые смеси . Алкены окисляются перманганатом калия в водной среде, что сопровождается обесцвечиванием раствора KMnO 4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах С). Этот процесс – гидроксилирование алкенов:
Алкены окисляются кислородом воздуха в эпоксиды
при нагревании в присутствии серебряных катализаторов:
Полимеризация алкенов –
связывание множества молекул алкена друг с другом. Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных -cвязей и образования новых межмолекулярных -cвязей:

Получение
Отщепление двух атомов галогена от дигалогеноалканов ,
содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.):
Дегидратация спиртов.
При действии на спирты водоотнимающих средств (концентрированной серной кислоты) или при нагревании 350 °С в присутствии катализаторов отщепляется вода и образуются алкены
Крекинг предельных углеводородов.
Так, при крекинге этана образуется смесь этилена и водорода:
Дегидратация пропанола над оксидом алюминия,
Таким способом в лаборатории получают этилен.
Дегидрохлорирование хлоралканов
проводят при действии на них раствора щелочи в спирте, т.к. в воде продуктами реакции оказываются не алкены, а спирты.

Применение
- получение горючего с высоким
октановым числом;
- пластмасс;
- взрывчатых веществ;
- антифризов;
- растворителей;
- для ускорения созревания плодов;
- получение ацетальдегида;
- синтетического каучука.







![Химические свойства Горение алкенов на воздухе. При поджигании алкены горят на воздухе: 2СН 2 =СНСН 3 + 9О 2 → 6СО 2 + 6Н 2 О . С кислородом воздуха газообразные алкены [C 2 –C 4 ] образуют взрывчатые смеси . Алкены окисляются перманганатом калия в водной среде, что сопровождается обесцвечиванием раствора KMnO 4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах С). Этот процесс – гидроксилирование алкенов: Алкены окисляются кислородом воздуха в эпоксиды при нагревании в присутствии серебряных катализаторов: Полимеризация алкенов – связывание множества молекул алкена друг с другом. Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путем расщепления внутримолекулярных -cвязей и образования новых межмолекулярных -cвязей:](https://fsd.kopilkaurokov.ru/uploads/user_file_562928681ef5e/img_user_file_562928681ef5e_0_7.jpg)


















