1. ИНФОРМАЦИЯ О РАЗРАБОТЧИКЕ ПЛАНА
2. ОБЩАЯ ИНФОРМАЦИЯ ПО УРОКУ
| Класс (укажите класс, к которому относится урок): | 10 класс |
| Место урока (по тематическому планированию ПРП) | Урок 16, в разделе3. Кислородсодержащие органические соединения (12 ч)1 урок из 12 |
| Тема урока | Предельные одноатомные спирты |
| Уровень изучения (укажите один или оба уровня изучения (базовый, углубленный), на которые рассчитан урок): | базовый |
| Тип урока (укажите тип урока): | ☐ урок-закрепление ☐ урок-повторение ☐ урок систематизации знаний и умений ☐ урок развивающего контроля ☐ комбинированный урок ☐ другой (впишите) |
| Планируемые результаты (по ПРП): |
| Личностные: готовности к совместной творческой деятельности при создании учебных проектов, решении учебных и познавательных задач, выполнении химических экспериментов; способности оценивать ситуации, связанные с химическими явлениями, и принимать осознанные решения, ориентируясь на морально-нравственные нормы и ценности; понимания ценностей здорового и безопасного образа жизни; необходимости ответственного отношения к собственному физическому и психическому здоровью; |
| Метапредметные: устанавливать причинно-следственные связи между изучаемыми явлениями; строить логические рассуждения (индуктивные, дедуктивные, по аналогии), выявлять закономерности и противоречия в рассматриваемых явлениях, формулировать выводы и заключения; владеть основами методов научного познания веществ и химических реакций; ориентироваться в различных источниках информации (научно-популярная литература химического содержания, справочные пособия, ресурсы Интернета), анализировать информацию различных видов и форм представления, критически оценивать её достоверность и непротиворечивость; задавать вопросы по существу обсуждаемой темы в ходе диалога и/или дискуссии, высказывать идеи, формулировать свои предложения относительно выполнения предложенной задачи; осуществлять самоконтроль своей деятельности на основе самоанализа и самооценки.
|
| Предметные: сформированность умений выявлять характерные признаки понятий, устанавливать их взаимосвязь, использовать соответствующие понятия при описании состава, строения и превращений органических соединений; сформированность умений характеризовать состав, строение, физические и химические свойства типичных представителей различных классов органических веществ (метанол, этанол); сформированность умений соблюдать правила экологически целесообразного поведения в быту и трудовой деятельности в целях сохранения своего здоровья и окружающей природной среды; осознавать опасность воздействия на живые организмы определённых органических веществ. |
| Ключевые слова (введите через запятую список ключевых слов, характеризующих урок): зависимость, метанол, этанол, одноатомные спирты, классификация спиртов |
| Краткое описание (введите аннотацию к уроку, укажите используемые материалы/оборудование/электронные образовательные ресурсы) На этом уроке учащиеся знакомятся с составом, строением, гомологией, изомерией предельных одноатомных спиртов, со свойствами и областью их применения. Оборудование: химическая посуда, склянки со спиртами (этиловым, амиловым (пентанолом)), водопроводная вода, фильтровальная бумага, медная проволока, спиртовка, плакат «Спирты. Метанол. Этанол». Электронные образовательные ресурсы: myschool.edu.ru, https://infourok.ru/tehnologicheskaya-karta
|
3. БЛОЧНО-МОДУЛЬНОЕ ОПИСАНИЕ УРОКА
| БЛОК 1. Вхождение в тему урока и создание условий для осознанного восприятия нового материала |
| Этап 1.1. Мотивирование на учебную деятельность |
| Укажите формы организации учебной деятельности на данном этапе урока. Опишите конкретную учебную установку, вопрос, задание, интересный факт, которые мотивируют мыслительную деятельность школьника (это интересно/знаешь ли ты, что) |
| Приветствие обучающихся. Формы организации учебной деятельности: Фронтальная. Решите задачу на определение формулы органического вещества
Спирты. Одноатомные спирты
Относительная плотность паров органического вещества по водороду равна 23.
Массовая доля углерода, водорода и кислорода в этом веществе соответственно 52,17%, 13,04%, 34,78%. Установите молекулярную формулу этого вещества.
Проверь себя. Решение: M(CxHyOz) = 2 * 23 = 46 г / моль
Пусть масса порции вещества (CxHyOz) равна 100 г. Тогда m(C) = 52,17 г, m(H) = 13,04 и m(O) = 34,78 г и
x : y : z = 52,17 / 12 : 13,04 / 1 : 34,78 / 16
x : y : z = 4,34 : 13,04 : 2,17
x : y : z = 2 : 6 : 1
Молекулярная формула вещества C2H6O
M(C2H6O) = 46 г / моль, следовательно это истинная формула вещества.
|
| Этап 1.2. Актуализация опорных знаний |
| Укажите формы организации учебной деятельности и учебные задания для актуализации опорных знаний, необходимых для изучения нового
|
|
Создание проблемной ситуации и актуализация знаний. Формы организации учебной деятельности: Фронтальная. Предельные одноатомные спирты Ознакомься с текстом задания. 1.Сформулируй и запиши определение класса предельных одноатомных спиртов.
Напиши общую формулу класса предельных одноатомных спиртов. 
2.Допиши гомологический ряд предельных одноатомных спиртов.
Докажи, что все вещества являются гомологами. 
3.Выполни задание.
Объясни решение. 
|
| Этап 1.3. Целеполагание |
| Назовите цель (стратегия успеха): ты узнаешь, ты научишься Организует фронтальную работу по формулировке цели урока - узнать, какие соединения имеют функциональную группу -ОН; - узнать, о физиологическом действии на организм метанола и этанола, об их применении; - научиться составлять структурные формулы спиртов и их изомеров, называть их по систематической номенклатуре; - научиться составлять уравнения реакций, подтверждающие свойства спиртов. |
|
|
| БЛОК 2. Освоение нового материала |
| Этап 2.1. Осуществление учебных действий по освоению нового материала |
| Укажите формы организации учебной деятельности, включая самостоятельную учебную деятельность учащихся (изучаем новое/открываем новое). Приведите учебные задания для самостоятельной работы с учебником, электронными образовательными материалам (рекомендуется обратить внимание учеников на необходимость двукратного прочтения, просмотра, прослушивания материала. 1) на общее понимание и мотивацию 2) на детали). Приведите задания по составлению плана, тезисов, резюме, аннотации, презентаций; по наблюдению за процессами, их объяснением, проведению эксперимента и интерпретации результатов, по построению гипотезы на основе анализа имеющихся данных и т.д.
|
| Организует работу с текстом, а далее фронтальную беседу Ознакомься с текстом кейса и ответь на вопросы. Поскольку в молекуле спирта появились полярные связи, он, в отличие от углеводородов, будет иметь более высокие температуры кипения и плавления (если сравнивать соединения с одинаковым числом атомов углерода). Это связано с тем, что полярные молекулы сильнее притягиваются друг к другу, и, для того чтобы оторвать их друг от друга (перевести жидкость в газ), нужно затратить много энергии — дополнительно нагреть. Кроме того, между молекулами спиртов возникают водородные связи (а), которые дополнительно притягивают молекулы друг к другу. Поэтому этиловый спирт — бесцветная жидкость (а этан и диметиловый эфир — газы!) с температурой кипипения 78 °C. Спирт хорошо растворим в воде, так как и с молекулами воды спирт образует водородные связи (б).

Водородные связи непрочные, поэтому низшие одноатомные спирты (мало атомов углерода в молекуле) — летучие жидкости с характерным запахом. | Ответь на вопросы и выполни задание: | Почему в гомологическом ряду спиртов нет газообразных веществ? Какая связь называется водородной? Почему спирты хорошо растворяются в воде? Приведите схему образования водородной связи между молекулами спиртов и молекулами воды. Приведите примеры неорганических веществ, в которых образуются межмолекулярные водородные связи.
|
| Этап 2.2. Проверка первичного усвоения |
| Укажите виды учебной деятельности, используйте соответствующие методические приемы. (Сформулируйте/Изложите факты/Проверьте себя/Дайте определение понятию/Установите, что (где, когда)/Сформулируйте главное (тезис, мысль, правило, закон) |
|
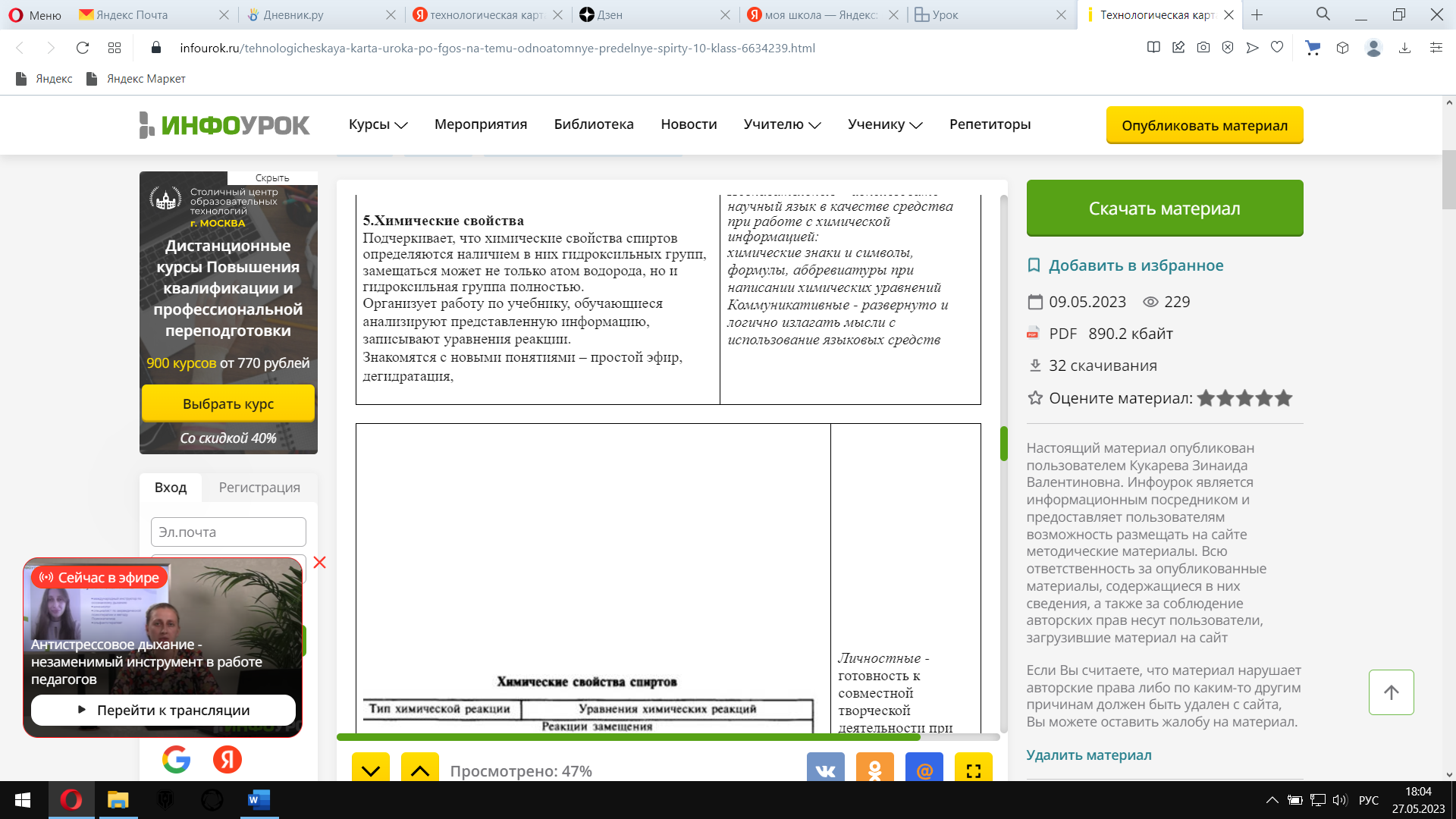
Предложите учащимся изучить схему реакции окисления этанола и расставить коэффициенты в уравнении реакции взаимодействия этанола с перманганатом калия в сернокислой среде методом электронного баланса, определить окислитель и восстановитель.(парная работа) Схема реакции взаимодействия этанола с перманганатом калия в серной кислоте
Изучи схему реакции. 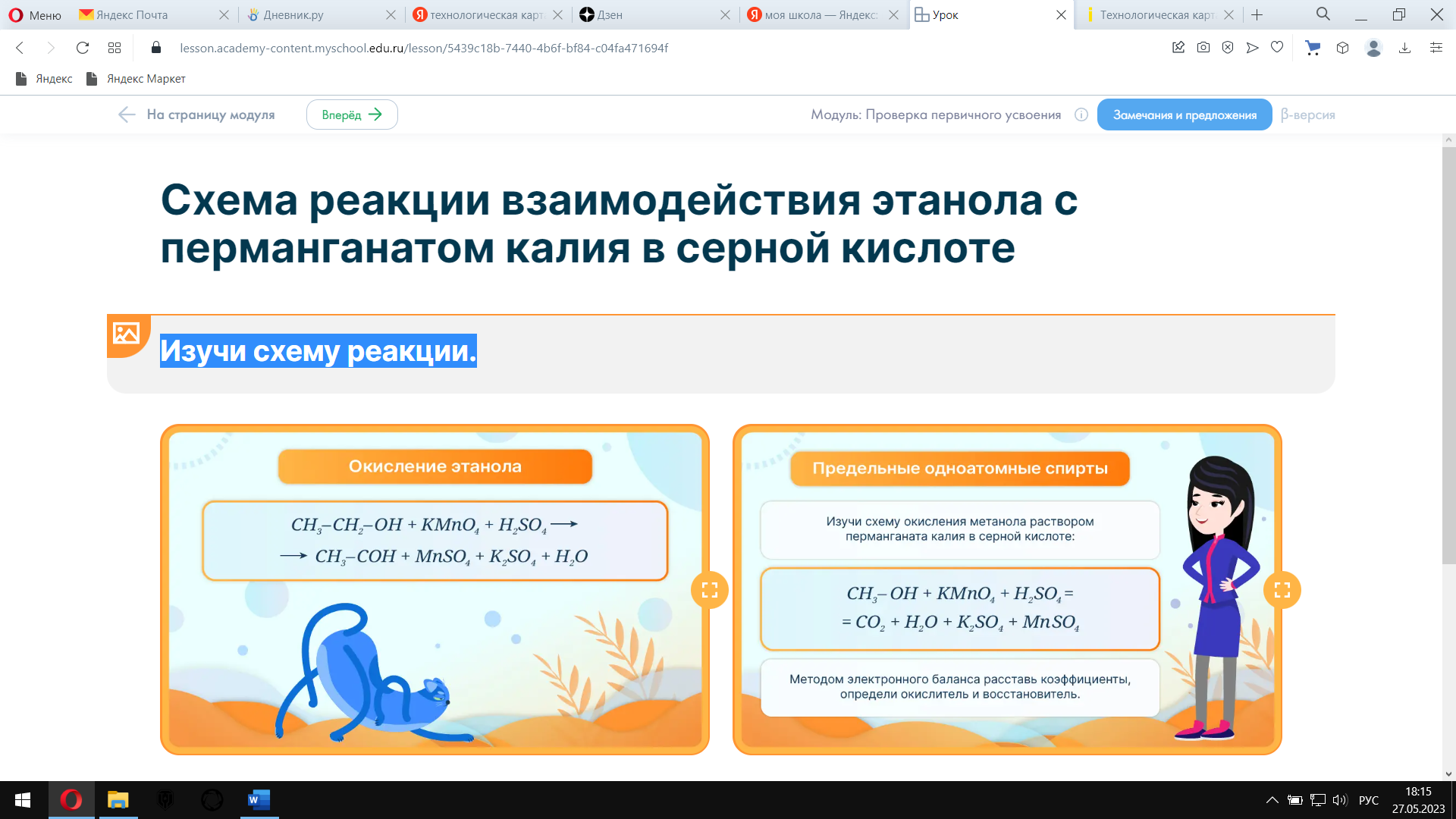
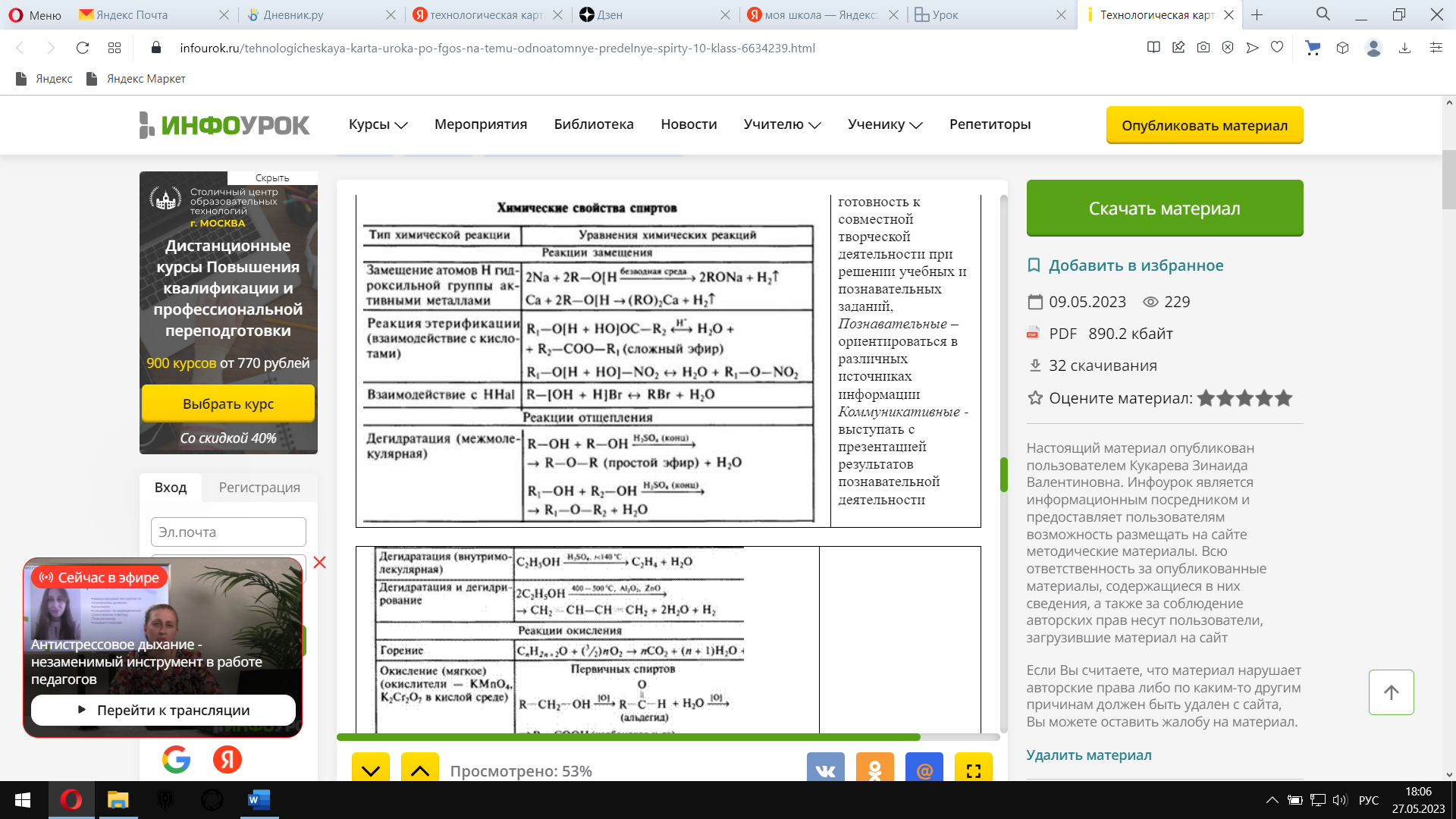
Изучи схему реакции окисления этанола перманганатом калия в серной кислоте. Определи окислитель и восстановитель. Методом электронного баланса расставь коэффициенты. Изучи схему реакции окисления метанола сернокислым раствором перманганата калия. Методом электронного баланса расставь коэффициенты. Укажи окислитель и восстановитель. Сравни характер продуктов реакции окисления. Предложите учащимся изучить схемы реакций, характеризующих химические свойства спиртов, и выполнить задание: написать уравнения реакций дегидратации, взаимодействия с металлическим натрием и с бромоводородом для пропанола-2. Химические свойства спиртов Изучи схемы реакции. 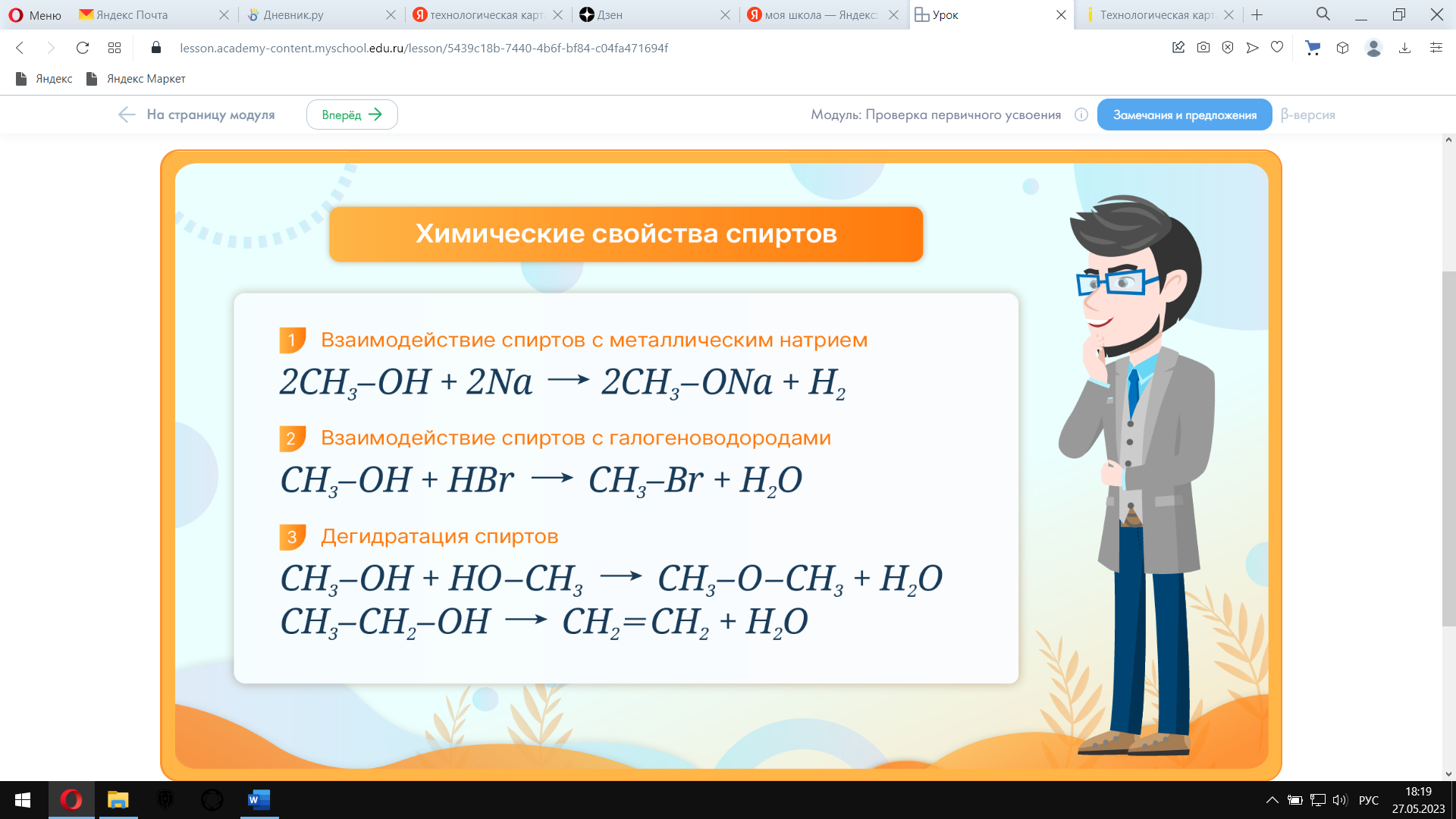
Напиши уравнения реакций дегидратации, взаимодействия с металлическим натрием и с бромоводородом для пропанола-2.
|
| БЛОК 3. Применение изученного материала |
| Этап 3.1. Применение знаний, в том числе в новых ситуациях |
| Укажите формы организации соответствующего этапа урока. Предложите виды деятельности (решение задач, выполнение заданий, выполнение лабораторных работ, выполнение работ практикума, проведение исследовательского эксперимента, моделирование и конструирование и пр.), используйте соответствующие методические приемы (используй правило/закон/формулу/теорию/идею/принцип и т.д.; докажите истинность/ложность утверждения и т.д.; аргументируйте собственное мнение; выполните задание; решите задачу; выполните/сделайте практическую/лабораторную работу и т.д.). |
| 1)К доске вызываю 2-х учащихся, им предлагается выполнить опыты. В стаканчиках одинаковые объемы этилового и амилового спиртов (по 5 мл). Прилить одинаковые объемы воды и отметить, что амиловый спирт растворяется не полностью.
Вывод: Предельные одноатомные спирты, имеющие до 11 атомов углерода, являются жидкостями, спирты с числом атомов углерода 12 и более являются твердыми веществами. Это можно объяснить наличием в молекулах спиртов водородных связей. Водородные связи способствуют хорошей растворимости веществ, повышению температуры плавления и кипения веществ, в результате объединения нескольких молекул. Т.е. она оказывает большое влияние на физические свойства соединений.
2)Работают в группах. Выполняют лабораторные опыты по инструктивным картам, готовят отчёт о проделанной работе. Инструкция по выполнению лабораторного опыта «Свойства этилового спирта» 1. Рассмотрите выданный вам в пробирке образец этилового спирта. Понюхайте его. В отдельную пробирку налейте несколько капель спирта и 2—3 мл воды. Взболтайте. Что вы можете сказать о растворимости спирта?
2. В пробирку налейте 1—2 мл воды, а во вторую — 1—2 мл спирта и добавьте по 2—3 капли растительного масла. Взболтайте. Что можно сказать о свойствах спирта как растворителя?
3. На фильтровальную бумагу капните 1 каплю воды и 1 каплю этилового спирта. Какая капля быстрее испарится? Сделайте вывод о свойствах спирта на основе этого опыта. 4. Накалите на пламени спиртовки свернутую в спираль медную проволоку и внесите ее в этиловый спирт. Зафиксируйте наблюдения. 5. Отчёт о проведении опыта оформите в виде выводов по каждому пункту.
3)Предложите учащимся прочитать текст «Промышленное получение метанола и этанола» и ответить на вопросы: Как в промышленности получают метанол и этанол? Почему получение метанола из синтез-газа ведут при высоком давлении? Какую роль при получении этанола гидратацией этилена играет концентрированная серная кислота? Что такое катализаторы? | Промышленные методы получения спиртов | В промышленности спирты получают при помощи химических либо биохимических методов производства. Единственным промышленно важным методом синтеза метанола является каталитическая реакция между оксидом углерода(II) и водородом. Сырьем в производстве метанола служит природный газ, который на первой стадии процесса подвергают очистке от соединений серы (сера является ядом для катализаторов, используемых на следующей стадии). Далее происходит паровая конверсия природного газа в синтез-газ (смесь окиси углерода CO и водорода), который после конденсации паров воды превращают в метанол на смешанном медно-цинко-хромовом катализаторе при температуре 250 °С и давлении до 10 МПа. Получаемый таким образом метанол содержит воду и примеси других спиртов (этанола, пропанола и более высших) и может быть очищен ректификацией. Мировое потребление метанола в 2015 году составило порядка 70 млн тонн.
 Этанол и пропанол-2 получают методом гидратации соответствующих алкенов — этилена и пропилена. В промышленности используют два варианта гидратации: сернокислотную и каталитическую. Сернокислотная гидратация включает в себя абсорбцию этилена концентрированной серной кислотой (94–98 %) при температуре 80 °С и давлении 1,3–1,5 МПа и последующий гидролиз образующихся сульфоэфиров водой. Второй метод гидратации основан на использовании фосфорной кислоты, нанесенной на силикагель или другую подложку, в качестве катализатора. Смесь деионизированной воды и этилена нагревают до температуры 300 °С под давлением 6—8 МПа, а полученный этанол очищают ректификацией. Данные методы позволяют получить этанол, содержащий 5 % воды по массе. Получение безводного этанола (99,9 %) основано на азеотропном удалении воды с бензолом. По данным на 2003 год, мировое производство этанола только гидратацией этилена составляет 6 млн тонн в год.
 Как в промышленности получают метанол и этанол? Почему получение метанола из синтез-газа ведут при высоком давлении? Какую роль при получении этанола гидратацией этилена играет концентрированная серная кислота? Что такое катализаторы? |
| Этап 3.2. Выполнение межпредметных заданий и заданий из реальной жизни |
| Подберите соответствующие учебные задания |
| При выполнении практической работы «Получение этилена» лопнула пробирка со смесью этилового спирта и концентрированной серной кислотой. Опишите ваши действия.
|
| Этап 3.3. Выполнение заданий в формате ГИА (ОГЭ, ЕГЭ) |
| Подберите соответствующие учебные задания |
| Тест содержит 4 задания: № 1–3 —базового уровня сложности, № 4 — повышенного уровня сложности. 
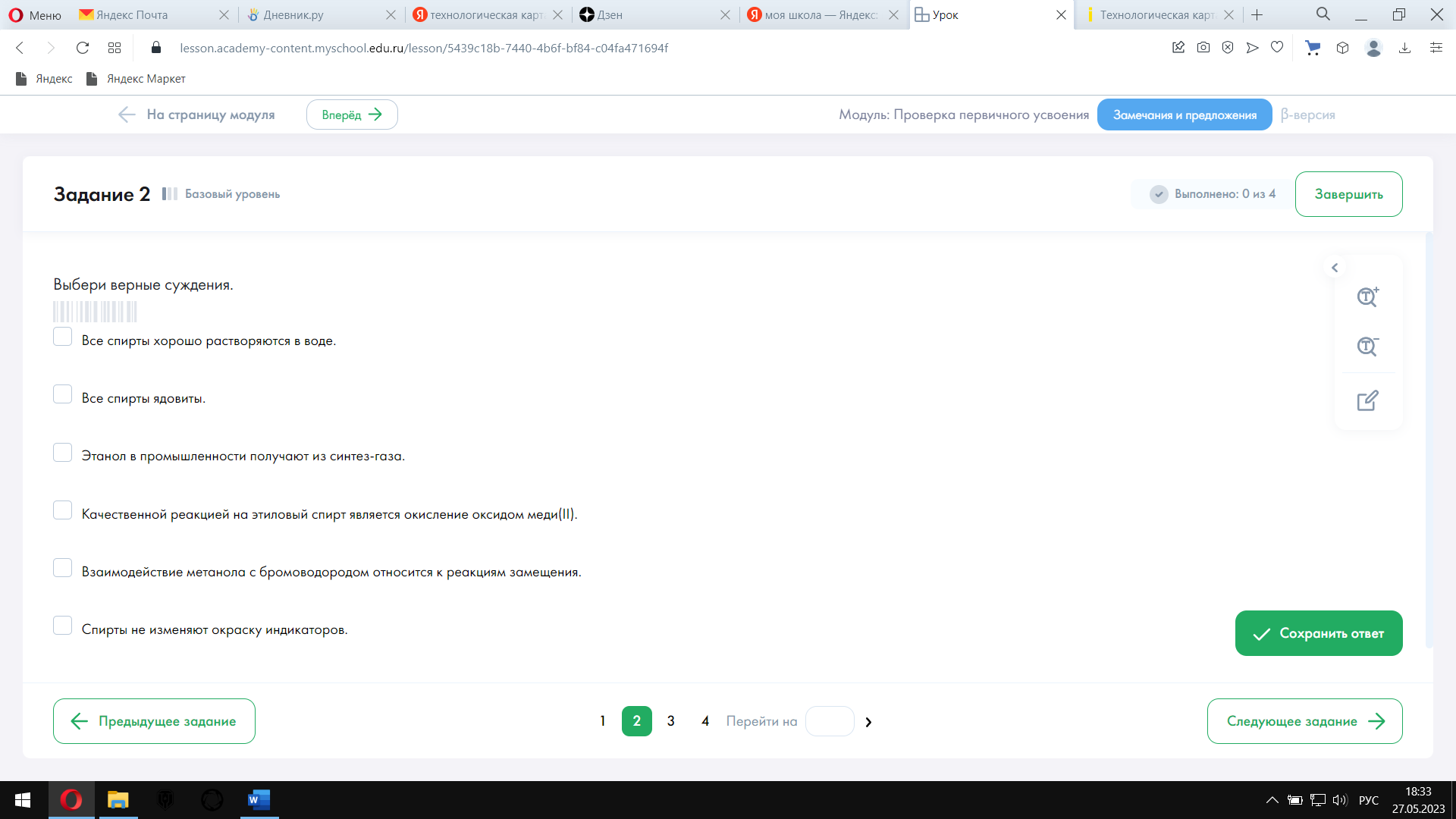
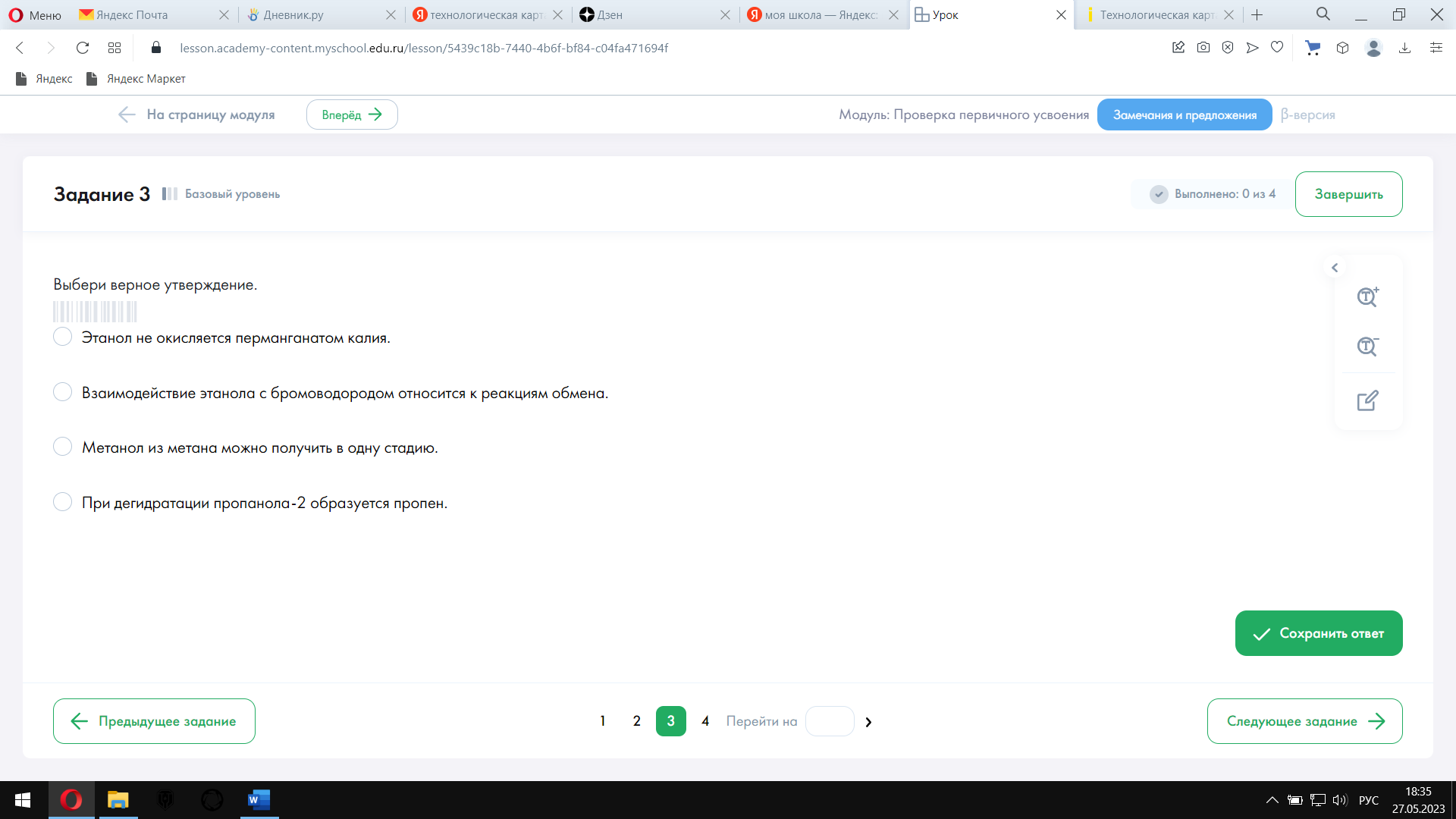
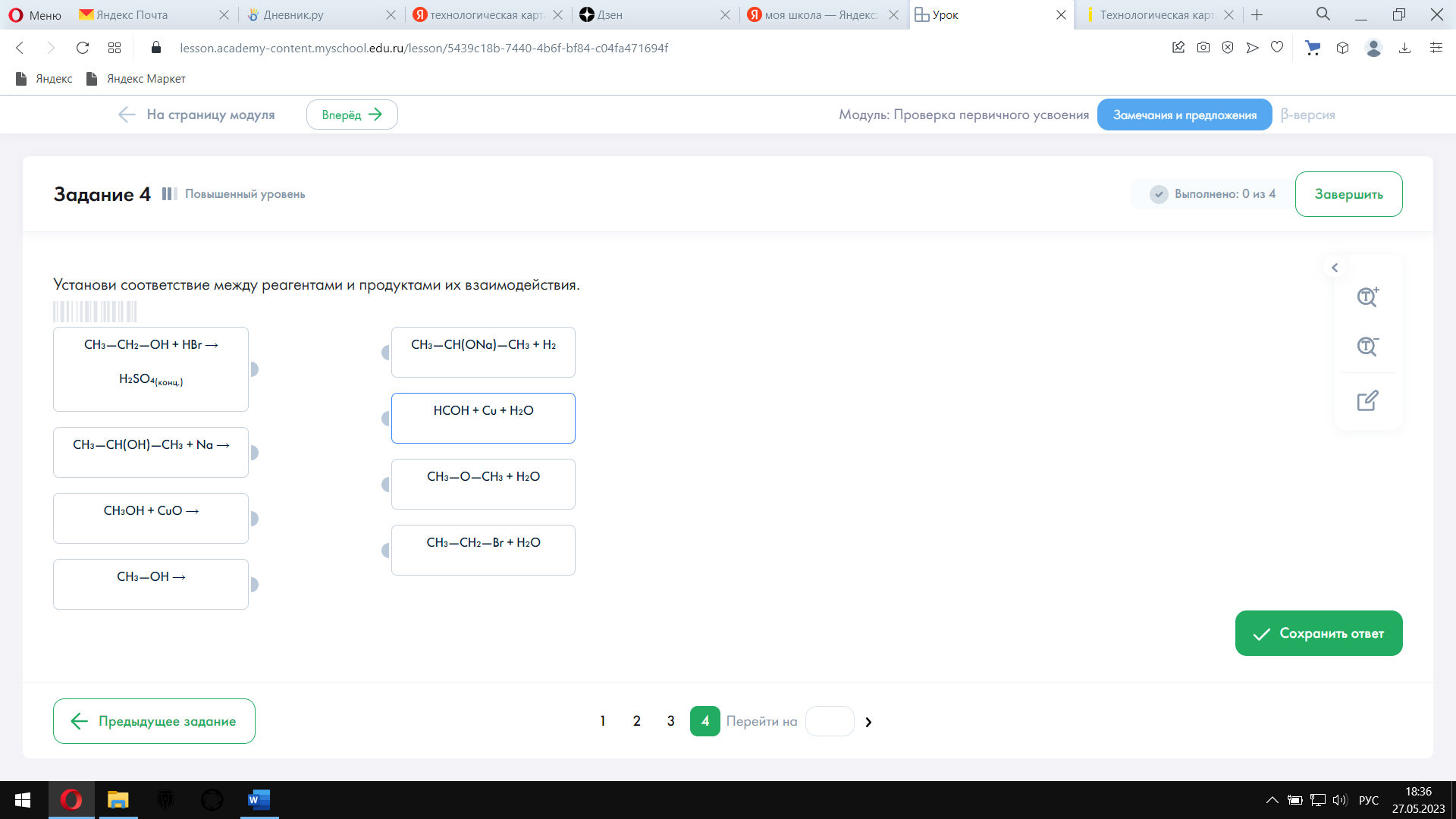
|
| Этап 3.4. Развитие функциональной грамотности |
| Подберите соответствующие учебные задания |
| Групповая работа Лосьоны для очистки кожи лица – один из самых распространенных косметических препаратов. Производители, рекламируя свой товар, уверяют, что он содержит уникальные вещества, обладающие особыми очищающими свойствами. На самом деле, основной компонент любого лосьона – спирт, и приготовить лосьоны можно самим. Состав простого лосьона для жирной кожи (в массовых долях): спирта – 20%, лимонной кислоты – 2%, ацетата алюминия – 0,3%, несколько капель духов и кипяченой воды до 100%. Спирт можно заменить водкой. Рассчитайте, сколько вам потребуется водки и других компонентов для приготовления 0,2 л такого лосьона (плотность раствора примите равной единице). Ответ: Водка содержит 40% спирта, следовательно, ее надо взять в 2,5 раза больше, чем чистого спирта. На 100 г раствора потребуется водки 20х2,5=50 г, лимонной кислоты 2 г, ацетета алюминия 0,3 г, остальное – кипяченая вода; на 200 г раствора необходимо: 100 г водки, 4 г лимонной кислоты, 0,6 г ацетата алюминия, остальное – кипяченая вода.
|
| Этап 3.5. Систематизация знаний и умений |
| Подберите учебные задания на выявление связи изученной на уроке темы с освоенным ранее материалом/другими предметами |
| Индивидуальная работа у доски, фронтальная работа Какие вещества называют спиртами? Что означает термин «предельный спирт»? Что означает термин «одноатомный спирт»? Написать структурную формулу у доски (все остальные работают в рабочих тетрадях) предельного, одноатомного, первичного спирта (содержащего 7 атомов углерода) 5. Какие виды изомерии возможны у предельных одноатомных спиртов? 6. Почему уже первые члены гомологического ряда предельных одноатомных спиртов являются жидкостями? 7.Какой спирт обладает большей растворимостью пропанол или октанол и почему?
|
| БЛОК 4. Проверка приобретенных знаний, умений и навыков |
| Этап 4.1. Диагностика/самодиагностика |
| Укажите формы организации и поддержки самостоятельной учебной деятельности ученика, критерии оценивания |
| Индивидуальная работа Тест по теме «Спирты» 1. Общая формула предельных одноатомных спиртов: 1) СnН2n+1ОН. 3) СnН2n-1ОН. 2) СnН2n-2(ОН)2. 4) СnН2n02. 2. Среди утверждений: А. Спирты относятся к кислородсодержащим органическим соединениям Б. Между молекулами спиртов образуются водородные связи 1) верно только А 2) верно только Б 3) верны оба утверждения 4) оба утверждения неверны 3. Многоатомным спиртом является:
1) пропанол-1 3) этилен 2) глицерин 4) этаналь 4. Вид изомерии, характерный для предельных одноатомных спиртов: 1) положения тройной связи 3) положения двойной связи 2) пространственная 4) межклассовая 5. Название вещества, формула которого СН3—СН2—СНОН—СН3: 1) бутаналь 3) бутанол-3 2) бутанол-2 4) 3-метилпропанол-1
|
| БЛОК 5. Подведение итогов, домашнее задание |
| Этап 5.1. Рефлексия |
| Введите рекомендации для учителя по организации в классе рефлексии по достигнутым либо недостигнутым образовательным результатам |
| Фронтальная работа - Какую цель мы поставили сегодня на уроке? - Смогли ли мы достичь поставленной цели? - Оцените свою работу на уроке.
|
| Этап 5.2. Домашнее задание |
| Введите рекомендации по домашнему заданию. § 17, упр.1-3. Сделать плакат или мини-проект «Алкоголь и здоровье» |
|
|
































