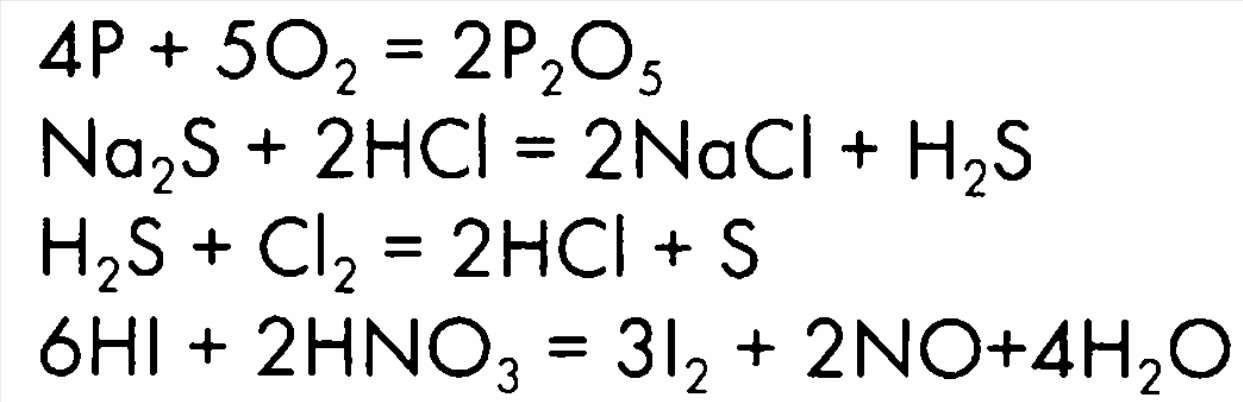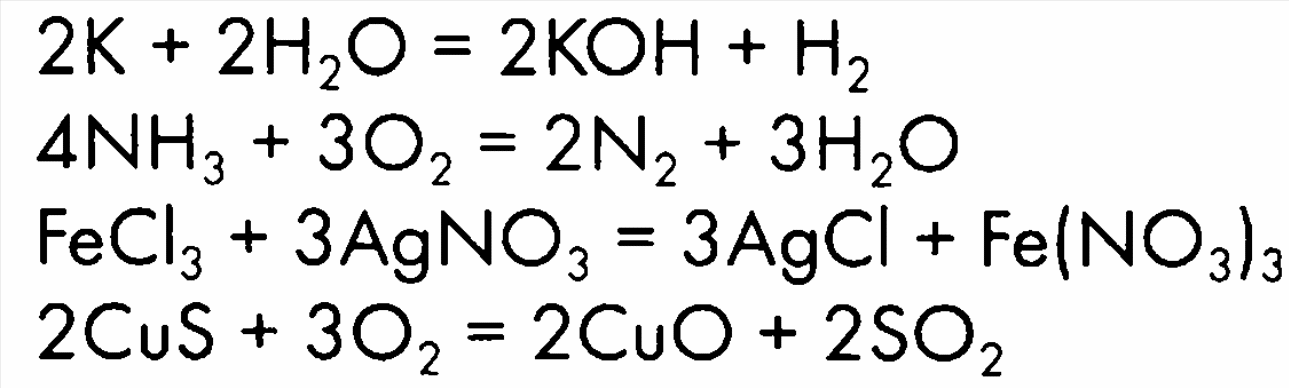Проблемное объяснение нового знания
1) Сформулировать и согласовать цели урока. 2) Организовать уточнение и согласование темы урока. 3) Организовать подводящий или побуждающий диалог по проблемному объяснению нового знания. 4) Организовать использование предметных действий с моделями, схемами, формулами, свойствами и пр. 5) Соотнесение нового знания с правилом в учебнике
|
Нам неизвестен данный тип реакции.
Чем же будем сегодня заниматься? Что изучать? Сформулируйте тему урока.
Такие реакции можно рассматривать как совокупность взаимодействующие процессов и поэтому имеют особое название – ОВР.
Почему эти реакции так названы? В чем суть данных реакций? Как решить нам данную проблему?
Задание для учащихся в помощь решения проблемы Корректировка задания: 2КNO3 + S + 3C = К2S + N2 + 3CO2 Составим электронные уравнения полуреакций (запись, показывающая сколько ē отдает или принимает элемент, чтобы поменять степень окисления): C0 – 4ē → C+4 р. окисления (отдачи ē) вос-ль S0 +2ē → S–2 р восстановления ок-ль 2N+5 + 4ē → N2+ 3 р восстановления ок-ль Элемент, понижающий свою степень окисления в ходе реакции, называется окислителем, а повышающий – восстановителем. Ок-лями и вос-лями называются также вещества, содержащие соответствующий элемент. 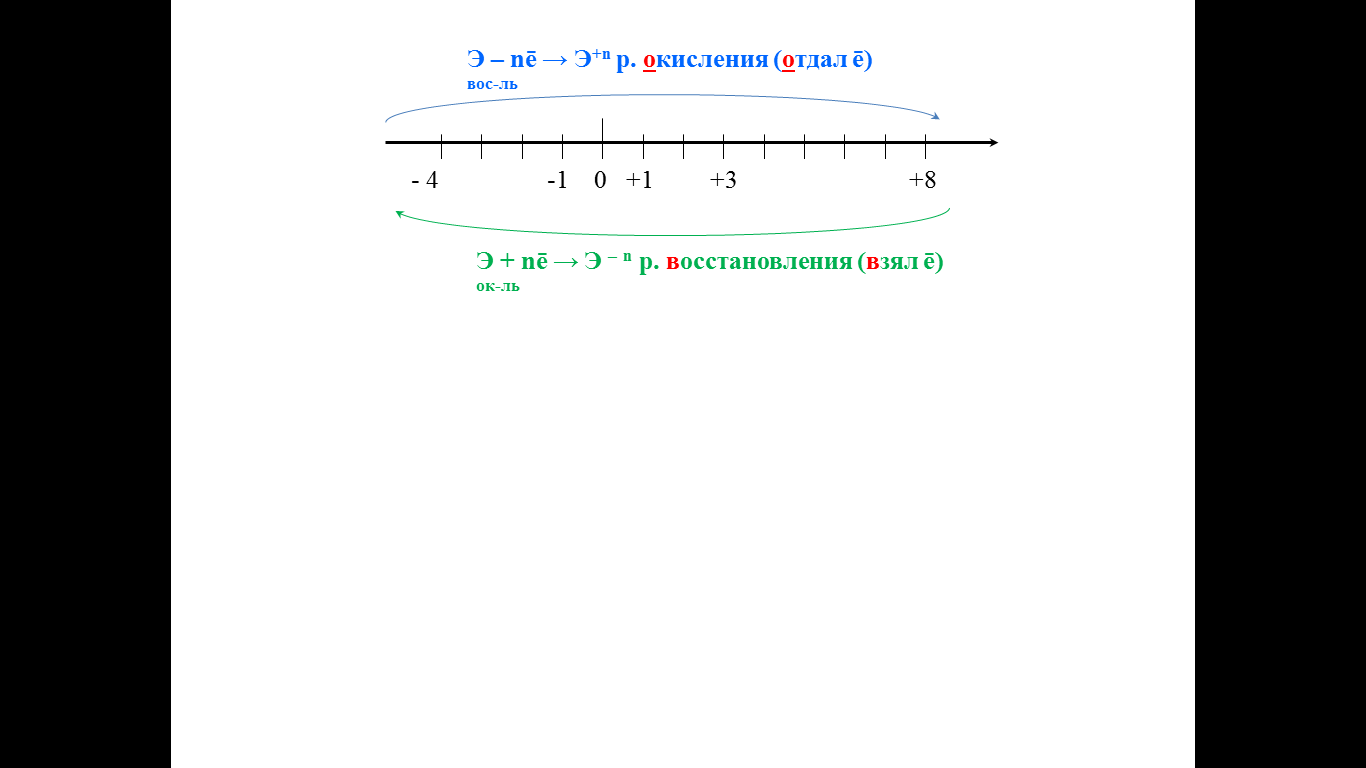
Обратите внимание: в общем случае ок-ль и вос-ль определяется реакцией, а не веществом. В ОВР всегда есть и ок-ль и в-ль. 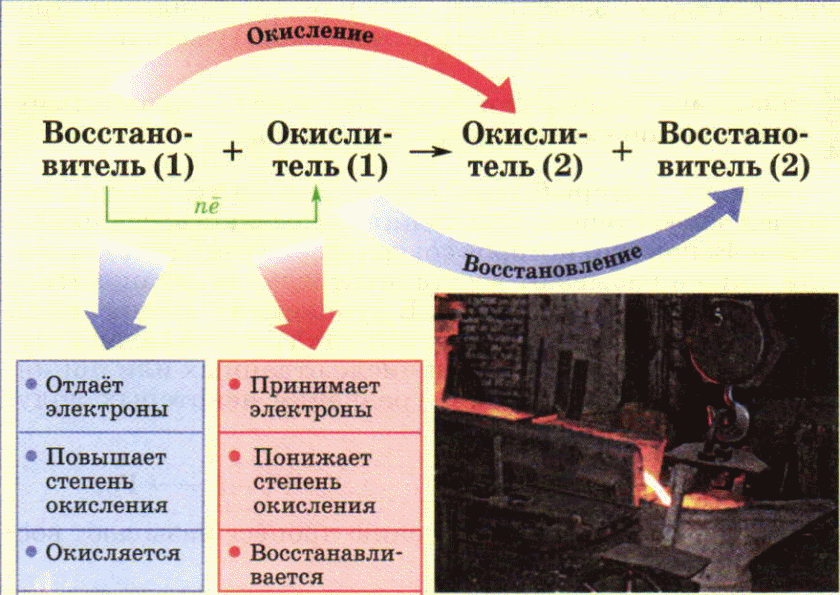
Дифференцированные задания для определения усвоения материала В уравнениях реакций расставьте степени окисления элементов. Укажите, является ли реакция ОВР. Укажите элемент окислитель и элемент восстановитель. Напишите полуреакции окисления и восстановления: Карточка № 1, 1 вариант
Карточка № 2, 2 вариант
Корректировка задания ( разноуровневое задание - уравнение д – для высокого уровня): Иногда окислителем и восстановителем является один элемент. Такие реакции называются р. диспропорционирования.
Сформулируйте и запишите определение данным реакциям.
Одна из задач химии – предсказать, какие вещества получатся в той или иной реакции. Чтобы ответить на этот вопрос для ОВР, надо знать: Какие вещества могут быть ок-лями, а какие – восстановителями; Как может меняться степень окисления окислителя и восстановителя в результате реакции. Сила ок-ля зависит от нескольких факторов: Электроотрицательности элемента Его степени окисления (чем выше – тем сильнее) Прочности его связей (чем прочнее – тем слабее).
Можно ли предугадывать окислительно-восстановительную способность веществ? Какие вещества проявляют только окислительные свойства, какие только восстановительные, или могут быть и теми и другими? Где взять ответы на данные вопросы?
Давайте выполним следующее задание: Составьте валентную схему атома серы в основном состоянии: Составьте валентную схему атома серы, который принимает или отдает ē, приобретая ту или иную степень окисления, приведите примеры веществ, в которых элемент имеет данные степени окисления. Находясь в данных состояниях, что может делать атом со своими электронами? Какие вещества могут быть только окислителями, только восстановителями или тем и другим?
Корректировка задания Окислители – элементы в высших степенях окисления: Н2SО4, НNО3, KMnO4, K2Cr2O7 Cl2 (до Cl–), O2 ( до H2O илиOH–), Br2 (до Br–) Неметаллы (F2) Восстановители – элементы в низших степенях окисления: Окислители и восстановители – элементы в промежуточных степенях окисления Задание для определения усвоения материала (парное) Поменяйтесь тетрадями и проведите взаимопроверку.
Здесь мы осудим только важнейшие, начнем с перманганата калия KMnO4 (степень окисления марганца + 7 ) – сильнейшего окислителя. В ходе ОВР с восстановителями он может менять окраску, поэтому его можно использовать как тест на выявления восстановительных свойств веществ.
Помимо перманганата тестом на восстановители может быть I2, который также меняет окраску в окислителях.
Для выявления окислителей применяют в качестве теста раствор КI, который окисляется до I2
|
Ответ: Реакциями, идущими с изменением степени окисления элементов
Записывают тему урока и определение из текста учебника
Ответ: Рассмотреть изменения степеней окисления элементов в реакции. Определиться с понятиями окисление и восстановление. Какие вещества могут менять степень окисления в реакциях и как?
Задание для учащихся в помощь решения проблемы Попробуйте составить схемы, которые отражали бы изменения степеней окисления у элементов. Почему изменяется степень окисления? Как назвать данные процессы? Как назвать элементы, а значит и вещества, содержащие их? Варианты ответов:
Дифференцированные задания для определения усвоения материала Выполнение задания: Карточка № 1 4Al + 3O2 = 2Al2O3 Zn + 2HCl = ZnCl2 + H2 ZnO + 2 HCl = ZnCl2 + H2O 4Cl2 + H2S + 4 H2O = H2SO4 + 8HCl 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O Карточка № 2 4P + 5O2 = 2P2O5 2Al + 6HCl = 2AlCl3 + 3H2 CaO + 2HCl = CaCl2 + H2O 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl+ 8H2O 3Br2 + 6KOH = 5KBr +KBrO3 + 3H2O Варианты ответов:
Ответ: При окислении восстановлении элементы отдают или принимают ē, следовательно, узнать о их окислительно-восстановительной способности можно рассмотрев строение их атомов.
Выполнение заданий: Ответ: 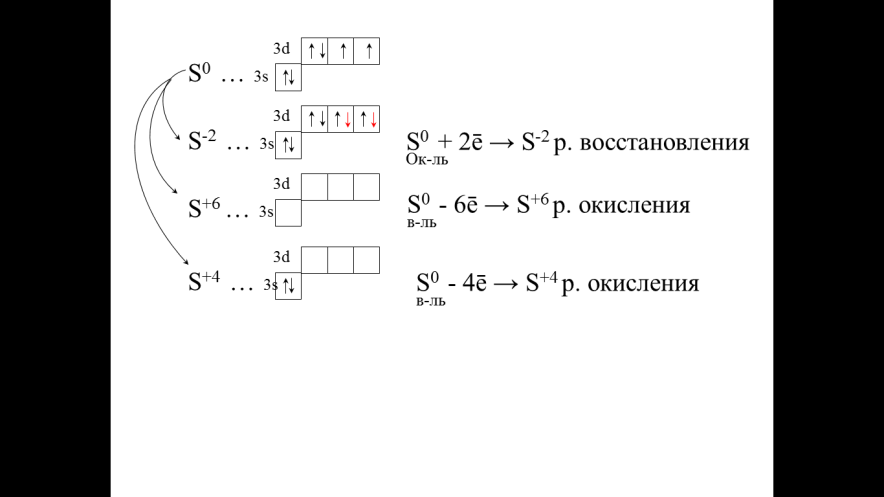
Н2S, K2S – восстановители, Н2SО4, SО2 – окислители, S, SО2 – ок-ль, в-ль.
Задание для определения усвоения материала (парное) Обсудите в паре, какие из приведённого ниже списка полуреакции относятся к окислению, какие к восстановлению и выпишите полуреакции 1 вариант – окисления; 2 вариант – восстановления. Дополните схемы этих полуреакций, показав число электронов: Fe+2 → Fe+3 Fe+2 → Fe0 N+5 → N+2 N20 → 2N+2 O20 → 2O –2 Mn+7 → Mn+2 Mn+7 → N+4 2N–3 → N20 N–3 → N+2
| Регулятивные -целеполагание как постановка учебной задачи на основе соотнесения того, что уже известно и усвоено учащимися, и того, что ещё не не известно --планирование — определение последовательности промежуточных целей с учетом конечного результата; составление плана и последовательности действий;
|