ЗАГАЛЬНА ТЕМА: ХІМІЧНІ РЕАКЦІЇ.
ТЕМА УРОКУ: Швидкість хімічної реакції, залежність швидкості реакції від різних чинників.
Мета:
Навчальна: Сформувати уявлення про швидкість хімічних реакцій і причини від яких вона залежить; продовжити формувати навички експериментальної роботи, вміння аналізувати інформацію встановлювати причинно-наслідкові зв’язки між явищами, робити висновки.
Розвиваюча: Розвивати уміння точно та логічно висловлювати власні думки, узагальнювати. Розвивати мислення, увагу, пам’ять, уміння спостерігати.;
Виховна: Виховувати науковий світогляд та вміння спілкуватись. Виховувати бажання здобувати нові знання, пізнавати навколишній світ. Дати поштовх у формуванні ставлення учнів до інших людей, праці, успіхів та невдач.
Тип уроку: урок засвоєння нових знань
Форма проведення: лекція з елементами проблемності, урок - дослідження.
Обладнання і матеріали: Ряд активності металів, презентація «Швидкість хімічної реакції. Умови, що впливають на швидкість реакції», мультимедійний проектор, презентація до уроку, кросворд "Швидкість реакції"
на столі вчителя: парафінова свічка, порошок магнію, спиртівка, сірники.
на столах в учнів:штатив для пробірок, пробірки, ложечка,ложечка, пробіркотримач, спиртівка, сірники.
Реактиви:
Набір реактивів для експериментальної частини:
дослід № 1: 10% розчин НCl, Mg, Zn (гранули), Fe (кусочки); пробірки №1, №2, №3.
дослід № 2:10%розчин НCl, дистильована вода, гранули цинку;пробірки №1, №2,№3.
дослід № 3: 10% розчин НCl ,порошок CuO, склянка з гарячою водою, спиртівка, тримач, пробірки №1, №2,№3.
дослід № 4: 10 % розчин НCl, кусочок Fe, порошок Fe; пробірки № 1, № 2.
дослід № 5: 3 % розчин гідроген пероксиду, порошок MnO2, пробірка.
ПЛАН УРОКУ
І. Організаційний етап.
ІІ. Актуалізація опорних знань
ІІІ. Мотивація навчальної діяльності
IV. Вивчення нового матеріалу
Поняття про швидкість реакції.
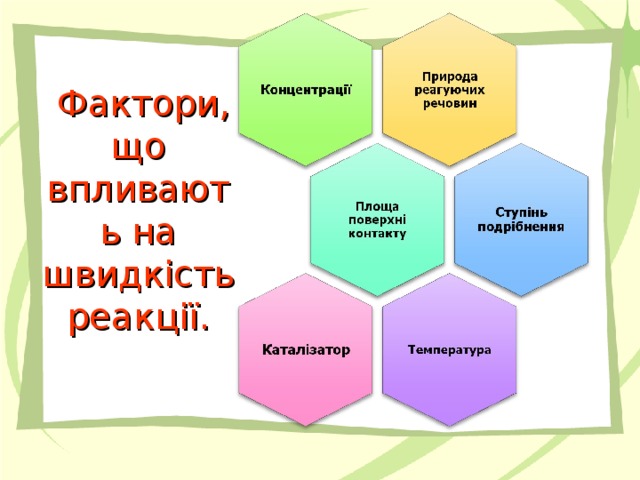
Фактори, що впливають на швидкість реакції:
природа реагуючих речовин;
концентрація;
площа стикання реагентів;
температура;
наявність каталізатора.
V. Домашнє завдання
VI. Підбиття підсумків
VIІ. Закріплення знань
ХІД УРОКУ
І. Організаційний етап
Доброго дня шановні учні! Сьогодні у вас незвичайний урок, урок особливий, сповнений цікавими фактами. Надіюсь, що вам запам’ятається цей урок, і ви візьмете із нього все те, що вам знадобиться в майбутньому.
ІІ. Актуалізація опорних знань
Дайте визначення поняттю "Хімічна реакція". //Хімічна реакція – це перетворення одних речовин на інші при незмінності ядер атомів//
Які ознаки протікання хімічних реакцій? //Виділення або поглинання тепла, світла, електричної енергії; поява чи зникнення запаху, виділення газу, випадання осаду та інше//
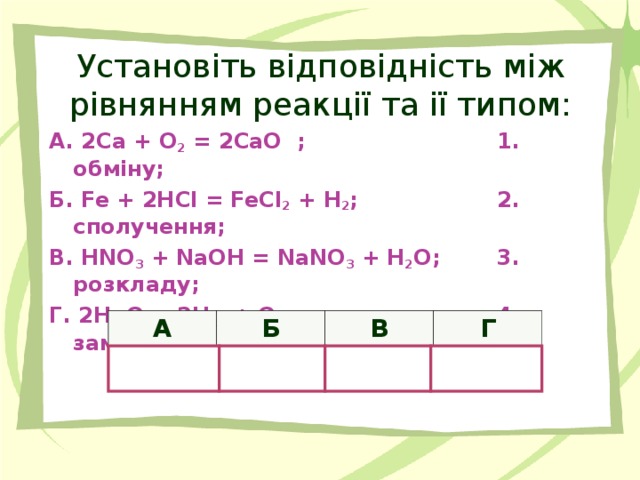
Назвіть відомі вам типи хімічних реакцій. //Розкладу, сполучення, заміщення та обміну//
ІІІ. Мотивація навчальної діяльності
Скажіть будь-ласка чим відрізняється черепаха від гепарда?
//Наприклад: У них різна швидкість руху//
А тепер за допомогою експерименту переконаємось, що швидкість може використовуватись і в хімії.
До експерименту вам завдання:
Спостерігаючи за експериментом зверніть увагу яка з реакцій відбувається найшвидше, а яка найповільніше.
Демонстрація.
Дослід 1. Горіння свічки.
Запалити свічку звернути увагу на швидкість її горіння.
Дослід 2. Горіння порошку магнію
– Чи однакова швидкість горіння в обох випадках?
//Ні. магній згоряє швидше.//
Як ви вже здогадались тема нашого уроку "Швидкість хімічної реакції".
Є тільки дві форми життя: гниття і горіння. Боягузи та жадібні оберуть першу, мужні та щедрі – другу. Як пояснити даний вислів з хімічної точки зору.
//Гниття і горіння – процес окиснення, що відбувається з різною швидкістю і якістю //
Сучасний світ уявити без продуктів хімічної промисловості практично неможливо. Будь-яке хімічне виробництво базується на певних хімічних реакціях. Закони економіки диктують необхідність розробки технологій дешевших, економічніших, з максимальним виходом продукту та найменшими витратами.
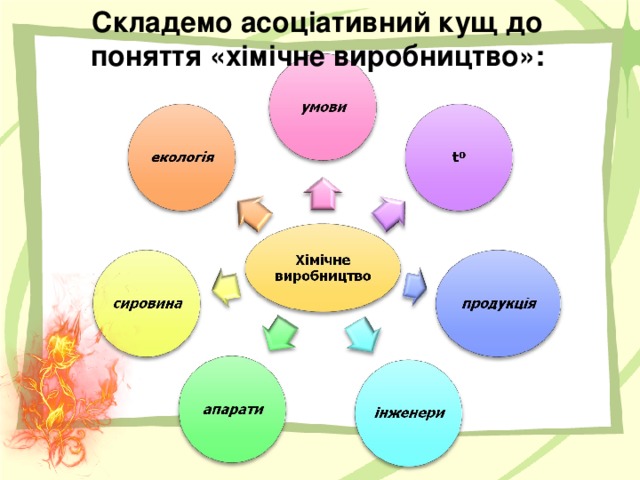
2. Складемо асоціативний кущ до поняття « хімічне виробництво»:
умови ↖ ↥ tº ↗ продукція
сировина ← Хімічне виробництво → інженери
апарати ↙ ↘екологія
Ми бачимо, яке багатогранне поняття «хімічне виробництво». І для того, щоб керувати хімічними процесами, треба знати закономірності протікання хімічних реакцій, умови, що впливають на їх проходження.
Отже тема нашого уроку є дуже актуальною.
На сьогоднішньому уроці ми з вами спробуємо вияснити, що розуміють під швидкістю хімічної реакції, та встановити які фактори і яким чином впливають на неї.
IV. Вивчення нового матеріалу.
1. Поняття про швидкість реакції.
Вам вже відомо із курсу фізики, що, швидкість – це величина, яка чисельно дорівнює шляху, який проходить тіло за одиницю часу.
Ви вже вивчаєте хімію з 7 класу. А чи зустрічалися ви із поняттям швидкості в хімії? //Ні//
Проте поняття швидкості в хімії використовується. Але під час проходження хімічної реакції механічного переміщення не відбувається.
Проблема: То що ж характеризує швидкість в хімії? Спробуємо розібратись в цьому.
– Скажіть, будь ласка, швидко чи повільно відбуваються такі процеси:
а) Іржавіння заліза; //повільно//
б) утворення мінералів в земній корі; //повільно//
в) тверднення цементу; //повільно//
г) вибух пороху; //швидко//
д) спалах пари бензину в двигуні. //швидко//
Найшвидші реакції відбуваються приблизно в 1040 разів швидше від найповільніших.
Отже, швидкість хімічних реакцій, пов’язана із зміною кількості речовини реагенту чи продукту реакції в одиниці об’єму. Величина що показує вміст кількості речовини в одиниці об’єму називається концентрацією.
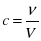 ,
,
де c – концентрація 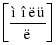 , ν – кількість речовини [моль], V – об’єм [л].
, ν – кількість речовини [моль], V – об’єм [л].
Отже, швидкість реакції це зміна концентрації одного з реагентів чи одного з продуктів реакції за одиницю часу при незмінному об’ємі системи.
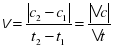 ,
,
де v – швидкість хімічної реакції 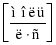 , c1 та c2 – початкова та кінцева концентрація (відповідно)
, c1 та c2 – початкова та кінцева концентрація (відповідно) 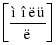 , t1 та t2 – початковий та кінцевий час (відповідно) [с],
, t1 та t2 – початковий та кінцевий час (відповідно) [с], 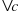 – зміна концентрації
– зміна концентрації 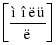 ,
,  – проміжок часу [с].
– проміжок часу [с].
Вивченням швидкості хімічних реакції займається спеціальний розділ хімії – хімічна кінетика. Серед учених, що зробили вагомий внесок у її розвиток, багато імен, зокрема: Якоб Вант-Гофф (перший лауреат нобелівської премії з хімії (1901 р), якої удостоєний був за ряд відкриттів, одне з яких правило, що носить його ім’я), Сванте Арреніус (лауреат нобелівської премії за відкриття в області розчинів, відкрив залежність миттєвої швидкості реакції від температури), а також Петер Вааге, М. М. Семенов, Бекетов та інші.
2. Фактори, що впливають на швидкість реакції.
Водій керуючи автомобілем, використовує різні пристосування для зміни швидкості руху автомобіля (коробку передач, зчеплення, гальма, "газ"). Так і, щоб керувати хімічним процесом необхідно змінювати швидкість хімічної реакції. Які ж "пристосування" можна використати для зміни швидкості хімічної реакції?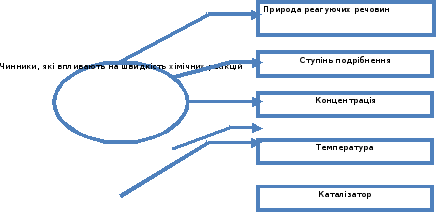
Швидкість хімічної реакції залежить від багатьох факторів. Розглянемо схему.
1. Що таке швидкість реакції в гомогенній системі? Лекція з елементами бесіди з використанням презентації «Швидкість хімічної реакції. Умови, що впливають на швидкість реакції»
Лабораторна робота. Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Учні виконують лабораторну роботу згідно інструкції. Клас розділений на групи, в кожній групі є капітан. Кожна група виконує лише один дослід. Після виконання досліду учні оформляють звіт (див. Додаток 1) по своєму досліду, роблять висновки. Висновок кожної групи оголошує капітан. Члени іншої групи записують оголошені висновки у свої звіти. Форма проведення експерименту: робота в групах.
Інструктаж з правил безпеки при виконанні дослідів.
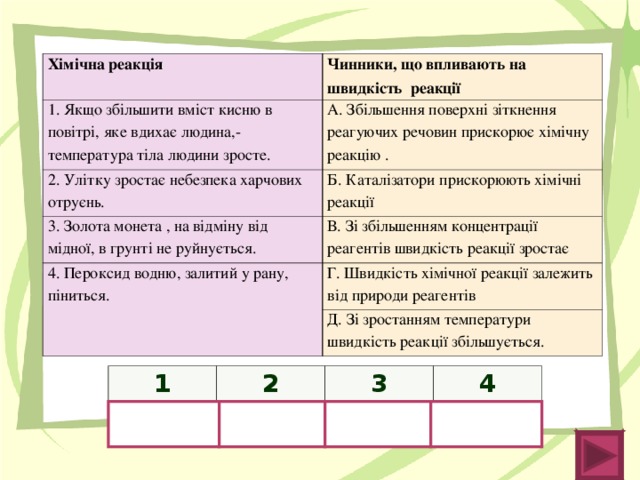
Завдання для групи №1. Дослід № 1. Як залежить швидкість хімічної реакції від природи реагуючих речовин ?(Обговорення результатів).Спостереження: хімічна реакція йде у всіх трьох пробірках з виділенням газу. Швидкість виділення газу різна.
Проблема: Маси взятих металів, концентрація соляної кислоти, умови проведення реакції однакові, але при цьому інтенсивність проходження процесів (швидкість виділення водню) різна. Чому?
Висновок учнів: ми брали різні метали.
Учитель: Всі речовини складаються з атомів хімічних елементів. Чим відрізняються хімічні елементи згідно знання вами Періодичного закону і періодичної системи Д.І. Менделєєва?
Учні: Порядковим номером, положенням в періодичній системі
Д.І.Менделєєва, тобто вони мають різну будову атома , а отже прості речовини утворені цими атомами мають різну хімічну активність.
Учитель: Тобто ці речовини мають різну природу. Таким чином, швидкість хімічної реакції буде залежати від природи реагуючих речовин. Демонстрація положення хімічних елементів в «Ряду активності металів» .
Висновок. Учні: Швидкість хімічної реакції буде залежати від природи реагуючих речовин: чим активніше метал (речовина), тим більша швидкість хімічної реакції.
Завдання для групи №2. Дослід № 2. Залежність швидкості хімічної реакції від концентрації реагуючих речовин. (Обговорення результатів).Спостереження: хімічна реакція йде у всіх трьох пробірках, Рівняння реакції: Zn + 2НCl → ZnCl2 + Н2 ↑
Проблема: природа всіх реагуючих речовин, умови проведення досвіду однакові, проте інтенсивність проходження процесів (швидкість виділення водню) різна. Чому?
Учні: При додаванні води, ми змінили (зменшили) концентрацію соляної кислоти у другій і третій пробірках, при цьому інтенсивність виділення водню зменшувалася.
Висновок: Швидкість хімічної реакції буде залежати від концентрації реагуючих речовин: чим більше концентрація реагуючих речовин, тим вище швидкість хімічної реакції.
Вчитель: З’ясуємо математичну залежність швидкості реакції mA + nB = AmBn від концентрації реагуючих речовин: V = k C(A)m C(B)n
Завдання для групи №3. Дослід № 3. Залежність швидкості хімічної реакції від температури . (Обговорення результатів).
Спостереження: ( учні коментують)
Рівняння реакції: CuO + 2НCl → Cu Cl2 + Н2О
Проблема:
Учитель: Всі взяті для експерименту речовини мають однакову природу, маса взятого порошку CuO і концентрація сірчаної кислоти також однакові, проте швидкість реакції різна. Чому?
Висновок: При підвищенні температури реакції швидкість реакції зростає.
Учитель: (слайд ) Залежність швидкості реакції від температури визначає закон Вант - Гоффа: при зміні температури реакції на кожні 10 ºС швидкість хімічної реакції змінюється в 2 - 4 рази.
Завдання для групи № 4. (Обговорення результатів).
Дослід № 4. Залежність швидкості хімічної реакції від площі поверхні зіткнення реагуючих речовин (ступеня подрібнення).
Спостереження: хімічна реакція йде у обох пробірках з виділенням газу, але з різною інтенсивністю.
Проблема Всі речовини однакові по своїй хімічній природі, однакові за масою і концентрацією, реагують при однаковій температурі, однак інтенсивність виділення водню (а отже і швидкість реакції ) різна. Чому? Висновки
Учні: Залізо в обох пробірках має різну ступінь подрібнення. Там де цей ступінь подрібнення більший - швидкість виділення водню більша.
Учитель: Ступінь подрібнення - це характеристика, яку називаємо: площа поверхні зіткнення реагуючих речовин. У нашому випадку різна площа поверхні зіткнення цинку з розчином соляної кислоти.
Висновок: Швидкість хімічної реакції залежить від площі зіткнення реагуючих речовин: чим більше площа зіткнення реагуючих речовин (ступінь подрібнення), тим більше швидкість реакції.
Учитель: така залежність спостерігається не завжди: так для деяких гетерогенних реакцій, наприклад, у системі Тверда речовина - Газ, при дуже високих температурах (більше 500 ºС) сильно подрібнені (до порошку) речовини здатні спікатися, тим самим площа поверхні зіткнення реагуючих речовин зменшується.
Сформулюйте висновок про залежність швидкості хімічної реакції за участю твердого реагенту від площі стикання речовин і температури.
Напишіть рівняння проведених вами хімічних реакцій.
– Як залежить швидкість реакції від концентрації реагуючих речовин? //Чим більша концентрація реагуючих речовин, тим більша швидкість реакції.//
У 1867 р. норвезькі дослідники Гульдберг та Вааге сформулювали закон діючих мас. Який виражає зв’язок між швидкістю реакції та концентраціями речовин.
Швидкість гомогенної реакції пропорційна добутку концентрацій реагуючих речовин.
Для реакції виду aA(г) + bB(г) → cC(г) + dD(г) кінетичне рівняння матиме вигляд:
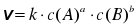 ,
,
де k – константа швидкості реакції, c(A) та c(B) – концентрації речовин А та В відповідно 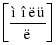 , a та b – коефіцієнти із рівняння реакції.
, a та b – коефіцієнти із рівняння реакції.
Як ви думаєте, від чого залежить k?
//- Від природи речовин. - Від температури.//
Приклад:
N2 + 3Н2 → 2NН3. 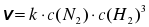 .
.
У січні 1967 року три американські космонавти загинули від пожежі, яка виникла в командному модулі їх корабля "Аполлон" під час тренувань. Тоді атмосфера в кабіні американських космічних кораблів складалась на 100% із кисню. Причиною пожежі стала випадкова іскра, яка призвела до займання пластмаси в кабіні командного модуля. Швидке поширення полум’я стало можливим через високу концентрацію кисню. Надалі космічні кораблі були розраховані на використання атмосфери із 60% кисню та 40% азоту.
в) площа стикання реагентів
– Як залежить швидкість реакції від площі поверхні реагуючих речовин? //Чим більша площа поверхні реагуючих речовин, тим більша швидкість реакції.//
В гетерогенних системах реакція відбувається на поверхні, а не в об’ємі речовини. Тому для характеристики швидкості реакції використовують відношення кількості речовини до площі поверхні.
Тоді формула визначення швидкості реакції набуде вигляду:
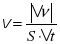 ,де v – швидкість хімічної реакції
,де v – швидкість хімічної реакції 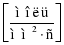 ,
, 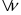 – зміна кількості речовини [моль],
– зміна кількості речовини [моль], 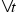 – проміжок часу [с].
– проміжок часу [с].
Наслідок:
Чи більший ступінь подрібнення речовини, тим більша швидкість реакції.
Так, наприклад, тріски згоряють значно швидше ніж поліно. Цукор-пісок швидше розчиняється в чаї, ніж грудка цукру.
г) температура
– Як залежить швидкість реакції від температури?
//Чим більша температура, тим більша швидкість реакції.//
Голландський вчений Якоб Вант-Гофф сформулювали правило, яке виражає зв’язок між швидкістю реакції та температурю.
Правило Вант-Гоффа:
Із збільшенням температури на кожні 10 ˚C швидкість реакції збільшується в середньому у 2–4 рази.
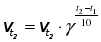 , де
, де 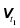 та
та 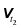 – швидкість хімічної реакції за температури t1 та t2 відповідно
– швидкість хімічної реакції за температури t1 та t2 відповідно 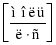 , γ – температурний коефіцієнт (коефіцієнт Вант-Гоффа), t1 та t2 –кінцева та початкова температура відповідно [˚C].
, γ – температурний коефіцієнт (коефіцієнт Вант-Гоффа), t1 та t2 –кінцева та початкова температура відповідно [˚C].
Так щоб пришвидшити розчинення кухонної солі при приготуванні ропи кухарі нагрівають воду.
Під час проведення деяких операцій на серці та мозку пацієнтів охолоджують для того що сповільнити реакції, які відбуваються в організмі людини.
– Поміркуйте, чому продукти харчування довше зберігаються в холодильнику.
//Тому що реакції розкладу сповільнюються//
д) наявність каталізатора
Демонстраційний експеримент. Вплив каталізаторів на швидкість хімічних реакцій
Дослід № 5. Розкладання гідроген пероксиду в присутності каталізатора.
Каталізатор – це речовина, яка впливає на швидкість реакції, але сама при цьому залишається незмінною на кінець реакції.
Каталізатор – це речовина яка впливає на швидкість реакції але сама при цьому залишається незмінною.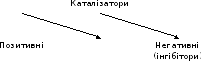
Позитивні каталізатори збільшують швидкість реакції, а негативні – зменшують.
Як саме впливають каталізатори на швидкість реакції вияснимо з експерименту.
За інтенсивністю виділення газу порівняйте швидкість розкладу гідроген пероксиду в обох пробірках.
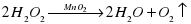
Зробіть висновок про вплив каталізатора на швидкість реакції.
Механізми дії каталізаторів до кінця не з’ясовані. Існує велика кількість теорій про те яким саме чином діють каталізатори. Вчені до цих пір працюють над цим питанням. Можливо хтось із вас в майбутньому відкриє цей механізм, й одержить невеличку, розміром у 1,5 млн. доларів, нобелівську премію.Не для всіх реакцій використовують каталізатор. Для кожної каталітичної реакції існує свій каталізатор.Каталізатори досить поширені в живій природі. Такі каталізатори називають ферментами. За їх участю відбуваються реакції в клітинах живих організмів, перетравлення їжі в шлунку та інше.
Каталізатори використовують майже на кожному хімічному виробництві: виробництво сульфатної кислоти, аміаку та інші.Каталізатори використовують у фільтрах призначених для очистки викидів від шкідливих газів (платинові фільтри вихлопних газів автомобілів).
V. Підбиття підсумків уроку Активізація пізнавального інтересу
Учитель звертає увагу на те, що протягом уроку вдалося знайти на поставлене раніше запитання: Що ж характеризує швидкість в хімії? Вдалося вияснити які чинники впливають на швидкість реакції.
Учитель відмічає активних учнів повідомляє та обгрунтовує оцінки.
VІ. Закріплення знань.
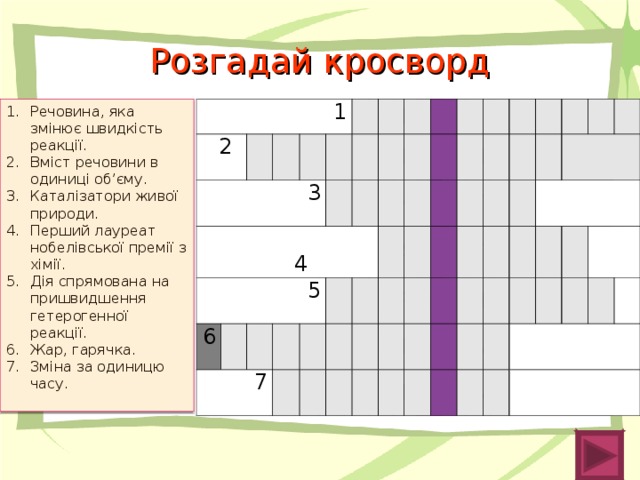
Розв’язавши кросворд, у виділених клітинках ви прочитаєте прізвище відомого вченого-хіміка.
|
|
|
|
|
| 1 | К | А | Т | А | Л | І | З | А | Т | О | Р |
|
| 2 | К | О | Н | Ц | Е | Н | Т | Р | А | Ц | І | Я |
|
|
|
|
|
|
|
| 3 | Ф | Е | Р | М | Е | Н | Т | И |
|
|
|
|
|
|
|
|
|
|
| 4 | В | А | Н | Т | Г | О | Ф | Ф |
|
|
|
|
|
|
| 5 | П | О | Д | Р | І | Б | Н | Е | Н | Н | Я |
|
| 6 | Т | Е | М | П | Е | Р | А | Т | У | Р | А |
|
|
|
|
|
|
|
| 7 | Ш | В | И | Д | К | І | С | Т | Ь |
|
|
|
|
|
Речовина, яка змінює швидкість реакції.
Вміст речовини в одиниці об’єму.
Каталізатори живої природи.
Перший лауреат нобелівської премії з хімії.
Дія спрямована на пришвидшення гетерогенної реакції.
Жар, гарячка.
Зміна за одиницю часу.
VІІ. Домашнє завдання.
1. Опрацювати §18
2. Виконати вправи 1–5 на ст. 107
Додаток № 1 Звіт по лабораторній роботі та самостійна робота
Дослідна група1
Дослідна група2
Дослідна група3
Дослідна група4
Дослідна група5
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Неухильно виконуйте правила техніки безпеки
Завдання для групи №1. Дослід № 1. Як залежить швидкість хімічної реакції від природи реагуючих речовин ?(Обговорення результатів).
Обладнання та реактиви: розчин НCl, Mg (смужка), Zn (гранули ), Fe ( кусочки).
Хід роботи:
У три пронумеровані пробірки долити по 1 мл розчину НCl і в кожну з пробірок додати приблизно однакову масу металів: у першу - Mg, у другу - Zn, в третю - Fe;
| № пробірки | Рівняння реакції | Швидкість виділення газу |
| № 1 |
|
|
| № 2 |
|
|
| № 3 |
|
|
Висновок: __________________________________________________________________________
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Неухильно виконуйте правила техніки безпеки
Завдання для групи №2. Дослід № 2. Залежність швидкості хімічної реакції від концентрації реагуючих речовин. (Обговорення результатів).
Обладнання та реактиви: 10 % розчин НCl, дистильована вода, гранули цинку.
Хід роботи:
У три пронумеровані пробірки долити по 1 мл 10 % розчину соляної кислоти (НCl), а потім долити дистильованої води (тим самим розбавляємо розчин) в пробірку № 1 - 2 мл, в пробірку № 2 -1 мл, в пробірку № 3 – не добавляти. У кожну з пробірок опустити по гранулі Zn (приблизно однакового розміру).
| № пробірки | Рівняння реакції | Швидкість виділення газу |
| № 1 |
|
|
| № 2 |
|
|
| № 3 |
|
|
Висновок: __________________________________________________________________________
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Неухильно виконуйте правила техніки безпеки
Завдання для групи №3. Дослід № 3. Залежність швидкості хімічної реакції від температури . (Обговорення результатів).
Обладнання та реактиви: 10 % розчин Н2SO4, порошок CuO, склянка з гарячою водою, спиртівка, тримач, пробірки № 1, № 2, № 3.
Хід роботи:
У три пронумеровані пробірки налити по 1 мл розчину сульфатної кислоти (Н2SO4) . У кожну помістити наважку Купрум (II) оксиду (CuO) (порошок). Першу пробірку залишити у штативі; другу - опустити в склянку з гарячою водою; третю - нагріти в полум'ї спиртівки.
| № пробірки | Рівняння реакції | Зміна забарвлення |
| № 1 |
|
|
| № 2 |
|
|
| № 3 |
|
|
Висновок: __________________________________________________________________________
Лабораторна робота.
Вплив площі поверхні контакту реагентів, концентрації й температури на швидкість хімічної реакції.
Неухильно виконуйте правила техніки безпеки
Завдання для групи № 4. (Обговорення результатів).
Дослід № 4. Залежність швидкості хімічної реакції від площі поверхні зіткнення реагуючих речовин (ступеня подрібнення).
Обладнання та реактиви: розчин НCl, кусочок Fe, порошок Fe; пробірки № 1, № 2.
Хід роботи:
У дві пронумеровані пробірки долити по 1 мл розчину HCl, і додати в першу – кусочок Fe, у другу – порошок Fe (однакові за масою).
| № пробірки | Рівняння реакції | Швидкість виділення газу |
| № 1 |
|
|
| № 2 |
|
|
Висновок: __________________________________________________________________________
Лабораторна робота.
Розкладання гідроген пероксиду в присутності каталізатора.
Обладнання та реактиви: 3 % розчин гідроген пероксиду, порошок MnO2.
У дві пробірки налийте по 2 мл 3% розчину гідроген пероксиду. У першу пробірку опустіть тліючу скіпку (вона залишається без змін). В другу пробірку добавте на кінчику шпателя манган(ІV)оксид і також опустіть тліючу скіпку.
Про що свідчить яскраве спалахування скіпки?
| № пробірки | Рівняння реакції | Швидкість виділення газу |
| № 1 |
|
|
Додаток № 2
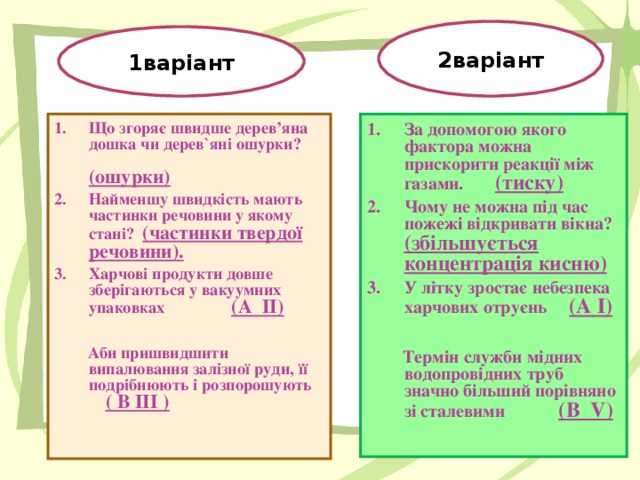
1 варіант
Що згоряє швидше дерев’яна дошка чи дерев`яні ошурки?
(2 бали)
Найменшу швидкість мають частинки речовини у якому стані?
(2 бали)
Для кожної позиції лівої колонки знайдіть усі правильні відповіді з правого стовпчика:
(по 3 бали)
Харчові продукти довше зберігаються у вакуумних упаковках
Аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують
Зі зростанням температури швидкість реакції збільшується
Зі зменшенням концентрації реагентів швидкість реакції зменшується
Зі зростанням площі поверхні контакту реагентів швидкість реакції збільшується
Каталізатори пришвидшують хімічні реакції
Швидкість хімічної реакції залежить від природи реагентів
Відповідь: А.__________________
В.__________________
Загальна кількість балів__________
2 варіант
За допомогою якого фактора можна прискорити реакції між газами.
(2 бали)
Чому не можна під час пожежі відкривати вікна?
(2 бали)
Для кожної позиції лівої колонки знайдіть усі правильні відповіді з правого стовпчика:
(по 3 бали)
У літку зростає небезпека харчових отруєнь
Термін служби мідних водопровідних труб значно більший порівняно зі сталевими
Зі зростанням температури швидкість реакції збільшується
Зі зменшенням концентрації реагентів швидкість реакції зменшується
Зі зростанням площі поверхні контакту реагентів швидкість реакції збільшується
Каталізатори пришвидшують хімічні реакції
Швидкість хімічної реакції залежить від природи реагентів
Відповідь: А.__________________
В.__________________
Загальна кількість балів__________

 ,
, 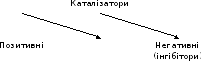








![Концентрація Швидкість реакції Величина, що показує вміст кількості речовини в одиниці об’єму називається концентрацією. швидкість реакції - це зміна концентрації одного з реагентів чи одного з продуктів реакції за одиницю часу при незмінному об’ємі системи. де v – швидкість хімічної реакції , c 1 та c 2 – початкова та кінцева концентрація (відповідно) , t 1 та t 2 – початковий та кінцевий час (відповідно) – ∆ C зміна концентрації , ∆ t – проміжок часу [с]. де c – концентрація ,](https://fsd.kopilkaurokov.ru/uploads/user_file_549fad160cead/img_user_file_549fad160cead_0_10.jpg)



![Закон діючих мас 1867 рік Норвезькі дослідники Гульдберг Като Максиміліан Математична залежність швидкості від концентрації для реакції : А + Б = АБ має вигляд: v = k[А][Б] Де V –швидкість реакции; K – константа швидкості; [А] и [Б] – концентрації речовин А и Б відповідно Швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин, взятих у ступенях рівних їх коефіцієнтам в рівнянні реакції. Цей закон ще називають законом діючих мас. Петер Вааге 1865 рік - російський вчений Н.І. Бекетов](https://fsd.kopilkaurokov.ru/uploads/user_file_549fad160cead/img_user_file_549fad160cead_0_15.jpg)