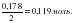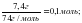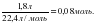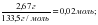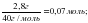Саба?ты? та?ырыбы: «?рекеттесуші заттарды? біреуі арты? алын?анда?ы химиялы? реакциялар те?деулері бойынша есептер»
Саба?ты? ма?саты:
Білімділік: О?ушылар?а химиялы? те?деулер бойынша есептер шы?ару ?дісін т?сіндіріп, есепті? негізгі типін шешуге ?рт?рлі ?діс-т?сілдерді пайдаланып, алгоритмдерді ?олдануды ?йрету. Затты? мольдік массасы, моль т?сінігін еске алып, зат массасыны? са?талу за?ын ?айталау.
Т?рбиелік: П?нге деген ынтасын арттыру, ?з бетімен ж?мыс жасауды, ??ыптылы??а, ж?йелілікке, тазалы??а ?йрету.
Дамытушылы?: Химиялы? те?деулер бойынша есеп шы?ару да?дыларын дамытып, тере?дете т?су, ой-?рекетін ?йымдастыру.
Саба?ты? т?рі: Аралас саба?
Саба?ты? ?тілу ?дістері: С?здік: т?сіндіру, есептер шы?ару.
К?рнекілік: ерігіштік кесте.
Саба??а ?ажетті ??ралдар: Д.И. Менделеевті? периодты? ж?йесі, Н.Н.Бекетовты? «кернеулік ?атары», «ерігіштік кесте».
Саба?ты? барысы: І. ?йымдастыру б?лімі
ІІ. Есептер шы?ару
І. ?йымдастыру б?лімі.
• С?леметсіздерме, о?ушылар!
• О?ушыларды т?гелдеу.
• О?ушыларды? назарын саба??а аудару.
ІІ. Есептер шы?ару.
Алгоритм
1. Есепті? шартын ?ыс?аша ?рнектеу.
2. Реакция те?деулерін жазып те?естіру.
3. Те?деу бойынша берілген ж?не есептеп табу?а ?ажетті заттарды? санды? сипаттамаларын (ν, Mr, M, m, V) тауып. Те?дікті? астына жазу.
4. Есепті? шартына с?йкес заттарды? зат м?лшерлерін есептеу.
5. ?ай затты? арты? берілгенін табу.
6. Аз м?лшерде берілген зат бойынша реакция н?тижесінде т?зілген затты? массасын (к?лемін, зат м?лшерін) есептеу.
7. Есепті? жауабын жазу.
1-есеп. Массасы 20 г мыс сульфаты бар ерітіндісін массасы 8 г натрий гидроксидіні? ерітіндісімен араластыр?анда ?анша мыс гидроксидіні? т?нбасы т?зіледі?
Шешуі:
1. Екі затты ?ос?анда ж?ретін химиялы? реакцияны? те?деуін ж?не есептеуге ?ажетті заттарды? м?лшерлерін жазамыз:
1) CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
2) ν, моль 1 2 1
М, г/моль 160 40 98
m, г 160 80 98
ν = ; ν (CuSO4) = = 0,125 моль ν (NaOH) = моль
3) Eсепті? шартында беріліп т?р?ан екі затты? м?лшерлерін салыстырамыз:
ν (CuSO4) < ν (NaOH)
4) Реакция барысында зат м?лшері аз зат толы? ж?мсалады. Олай болса, реакция мыс сульфаты бойынша ж?реді. Реакция ?німіні? зат м?лшері де со?ан те? болады.
5) Зат м?лшері бойынша т?зілген т?нба мыс (II) гидроксидіні? массасын табамыз:
m(Cu(OH)2) = ν(Cu(OH)2) * М(Cu(OH)2) = 0,1 моль * 98 г/моль = 9,8 г.
Жауабы: 9,8 г.
2-есеп. Темір (II) сульфидін алу ?шін 28 г темір мен 22,4 г к?кірт ?осылды. Алын?ан заттарды? ?айсысы толы? ?рекеттеседі? ?ай зат арты? ?алады ж?не арты? затты? массасы ?андай? Темір (II) сульфидіні? неше грамы т?зілетінін табы?дар.
Шешуі:
1. Реакцияны? те?деуін жазамыз:
Fe + S = FeS
Те?деу бойынша 1 моль темір мен 1 моль к?кіртпен ?рекеттесіп, 1 моль темір (II) сульфидін т?зеді, я?ни
ν (Fe) + ν (S) = ν (FeS)
2. Бастап?ы заттарды? моль сандарын табамыз:
ν (Fe) = ;
ν (S) = ;
ν (Fe) < ν (S), я?ни к?кірт арты? алын?ан.
3. К?кіртті? арты? м?лшерін:
νарт. (S) = 0,7 – 0,5 = 0,2 моль
ж?не реакция?а т?спеген к?кіртті? массасын аны?таймыз.
m арт. (S) = νарт. (S) * М (S) = 0,2 моль * 32 г/моль = 6,4 г.
4. Реакция н?тижесінде т?зілген ?німні? м?лшері реакция?а жеткіліксіз алын?ан бастап?ы зат м?лшерімен аны?талады, я?ни
ν (FeS) = ν (Fe) = 0,5 моль.
Темір (II) сульфидіні? массасын есептейміз:
m (FeS) = ν (FeS) * M (FeS) = 0,5 моль * 88г/моль 44 г.
Жауабы: m арт. (S) = 6,4 г; m (FeS) = 44 г.
3-есеп. 2 л азот пен 4 л сутек ?рекеттескенде (?.ж.) т?зілетін аммиакты? к?лемін табы?дар.
Шешуі:
1. N2 + 3H2 = 2NH3
ν 1 3 2
2. ν = ; ν (N2) = ; ν(H2) = ;
3. 3 моль H2 ?рекеттескенде 2 моль NH3 т?зілсе, есепті? шарты бойынша:
0,178 моль H2 ——— х моль NH3 т?зіледі.
ν (NH3) = 2*
V = ν * VM ?рнегін пайдаланып, т?зілген аммиакты? к?лемін табамыз:
V(NH3) = 0,119 моль * 22,4 л/моль = 2,66 л.
4-есеп. ??рамында 7,4 г кальций гидроксиді бар ерітінді ар?ылы 1,8 л (?.ж.) к?мір?ыш?ыл газы жіберілді. Т?зілген т?нбаны? массасын табы?дар.
Шешуі:
1. Ca(OH)2 + CO2 = CaCO3↓ + H2O (1)
ν (CO2) > ν [Ca(OH)2] арты? болса, онда ол т?нбада?ы кальций карбонатымен ?рекеттесіп еритін т?з – кальций гидрокарбонатын т?зеді:
CaCO3 + CO2 + H2O = Са(НСО3)2 (2)
2. Бастап?ы заттарды? м?лшерлерін есептейміз:
ν[Ca(OH)2] =
ν(CO2) =
ν [Ca(OH)2] > ν(CO2), реакция (1) те?деу бойынша ж?реді. т?зілген CaCO3 м?лшері реакция?а жеткіліксіз алын?ан затты? м?лшерімен аны?талады:
ν [Ca(OH)2] = ν(CO2) = 0,08 моль.
3. Т?зілген т?нбаны? массасы:
m (CaCO3) = 0,08 моль * 100г/моль = 8 г.
Жауабы: m (CaCO3) = 8 г.
5-есеп. ??рамында 2,67 г алюминий хлориді бар ерітіндіге ??рамында 2,8 г натрий гидроксиді бар сілті ерітіндісі ?осылды. Т?зілген алюминий гидроксидіні? зат м?лшерін есепте?дер.
Шешуі:
1. AICI3 + 3NaOH = AI(OH)3 + 3 NaCI (1)
2. Реакгенттерді? зат м?лшерлерін аны?таймыз:
ν (AICI3) =
ν (NaOH) =
3. Т?зілген AI(OH)3 зат м?лшері:
ν [AI(OH)3] = ν (AICI3) = 0,02 моль.
4. Алюминий гидроксидін т?зуге ж?мсал?ан NaOH-ты? м?лшерін табамыз. 1-теідеу бойынша:
1 моль AICI3-пен 3 моль NaOH ?рекеттессе
0,02 моль AICI3 ——— х моль NaOH ?рекеттеседі.
х = 0,02 * 3 = 0,06 моль NaOH.
5. Я?ни NaOH арты? м?лшерде берілген. Оны? 1-реакциядан артылатын м?лшерін табамыз:
νарт.(NaOH) = 0,07 моль – 0,06 моль = 0,01 моль.
6. AI(OH)3 екідайлы бол?анды?тан, NaOH арты? м?лшерінде AI(OH)3 ериді. Те?деуді ы?шамдап аламыз:
AI(OH)3 + NaOH = NaAIO2 + 2H2O (2)
2-те?деу б/ша реакция?а т?сіп, еритін AI(OH)3 зат м?лшері:
ν2 [AI(OH)3] = νарт.(NaOH) = 0,01 моль.
7. 1-реакция те?деуі б/ша т?зілген 0,02 моль AI(OH)3-ті? 0,01 молі 2-реакция б/ша еріп кетеді. Ал ?ал?ан AI(OH)3 м?лшері:
ν3 [AI(OH)3] = ν1 [AI(OH)3] = ν2 [AI(OH)3] = 0,02 моль – 0,01 моль = 0,01 моль.
Жауабы: ν3 [AI(OH)3] = 0,01 моль.
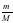 ; ν (CuSO4) =
; ν (CuSO4) = 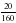 = 0,125 моль ν (NaOH) =
= 0,125 моль ν (NaOH) =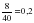 моль
моль 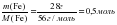 ;
;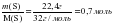 ;
;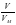 ; ν (N2) =
; ν (N2) = 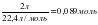 ; ν(H2) =
; ν(H2) = 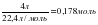 ;
;