Акмолинская область
Жаркаинский район
Отрадненская средняя школа
Открытый урок
на тему:
«Горение и медленное окисление. Оксиды. Тепловой эффект реакции. Термохимические реакции. Демонстрация реакции».
Предмет: химия
Учитель: Мынбаева Ж.Т.
Класс: 8
2014-2015 учебный год
Класс: 8
Учитель: Мынбаева Ж.Т.
Дата: 20.01.2015 год.
Тема урока: Горение и медленное окисление. Оксиды. Тепловой эффект реакции. Термохимические реакции. Демонстрация реакции.
Тип урока: урок открытия новых знаний
Методы урока: лекция, беседа, обсуждение, приобретение новых знаний.
Межпредметные связи: биология, физика, математика.
Материалы и оборудование: слайдовая презентация, карточки с заданиями по теме «Кислород», бланки ответов, кроссворд, интерактивная доска, видеоролики процессов горения и окисления.
Цели по содержанию:
- обучающие: формирование у обучающихся представления: о классе оксидов, (умение их называть и классифицировать), о термохимических реакциях, а так же о процессах горения и медленном окислении;
- развивающие: развитие умения анализировать, сравнивать, обобщать, делать выводы, развивать внимание;
- воспитывающие: развитие мотивации к предмету химия, воспитание ответственного и бережного отношения к окружающей среде.
Планируемые результаты учебного занятия:
- Предметные: давать определение «оксиды», распознавать оксиды среди других веществ, составлять формулы оксидов и называть их, классифицировать, описывать физические свойства оксидов, значение процессов горения и медленного окисления.
- Метапредметные:
- регулятивные: умение планировать и регулировать свою деятельность, самостоятельно планировать пути достижения цели, владение основами самоконтроля и самооценки;
- коммуникативные: готовность получать необходимую информацию, отстаивать свою точку зрения в диалоге и в выступлении, выдвигать гипотезу, доказательства, продуктивно взаимодействовать со своими партнерами, владение письменной речью;
- познавательные: умение определять понятия, устанавливать аналогии, строить логические рассуждения и делать выводы, производить поиск информации, анализировать и оценивать её достоверность.
- личностные: развитие мотивов учебной деятельности и формирование личностного смысла обучения, социальных и межличностных отношений.
План
Организационный момент (психологический настрой) 2 мин
Проверка исходного уровня знаний по теме «Кислород»
(работа по карточкам - «Фронтальный опрос») 5 мин
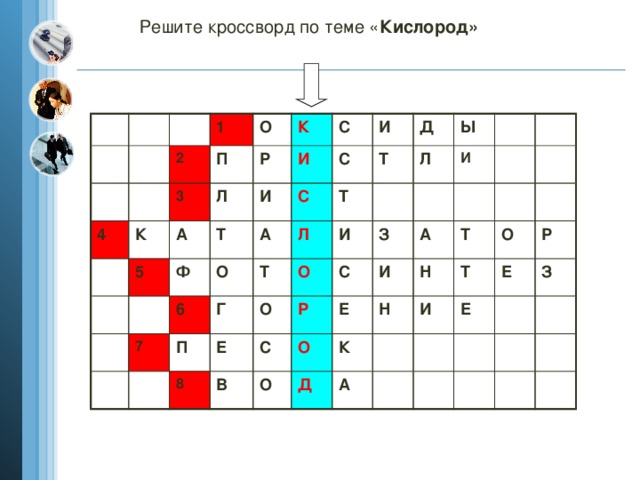
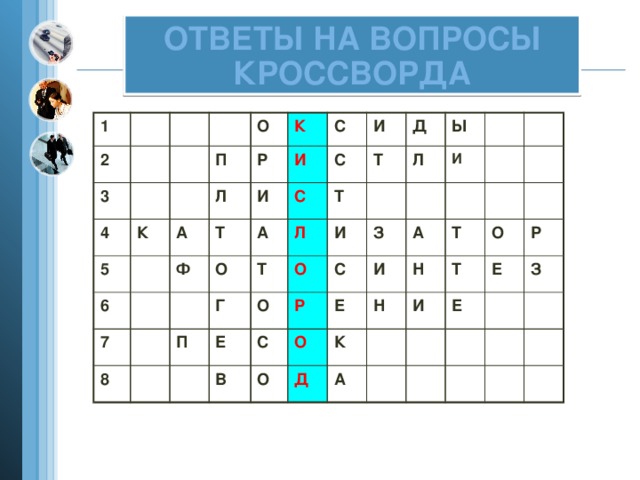
Разгадывание кроссворда 3 мин
Изучение нового материала
Видео-клипы (лекция, беседа, обсуждения) 7 мин
Определение реакции по тепловому эффекту реакции.
Термохимические реакции (презентация) 3 мин
Слайдовая презентация по теме «Оксиды» (презентация) 5 мин
Закрепление изученного материала (работа на интерактивной доске)
Составление формул оксидов 7 мин
Составление уравнений реакций получения оксидов 8 мин
Рефлексия. Подведение итогов. Домашнее задание 3 мин
Ход урока
Организационный момент:
Проверка наличия тетрадей, ручек, карандашей, книг. Рапорт дежурного. Настраиваю учащихся на позитивное сотрудничество. Начнем с улыбки…
Задаю пару общих вопросов: Сегодня все пришли? Все готовы начать урок?
Проверка исходного уровня знаний по теме «Кислород»
«Фронтальный опрос» осуществляю с использованием раздаточного материала. Раздаю карточки с заданиями по теме «Оксиды» каждому учащемуся. Это задание также можно выполнить в парах. Учащиеся выполняют задание в течение 3 минут. Осуществляется взаимопроверка в течение 2 минут (приложение 1).
Разгадывание кроссворда и проверка в течение 3 минут (приложение 2). Слово под № 1.
Изучение нового материала
а) Демонстрация видеоматериала на интерактивной доске – виртуальная лаборатория (3- 4 мин)
Клип №1: Горение кальция на воздухе (25 с)
Клип №2: Горение в кислороде железа (50 с)
Клип №3: Горение спиртов (60 с)
Клип №4: Горение различных веществ в потоке кислорода (100 с)
б) Обсуждение увиденного видеоматериала (2-3 мин)
Проблемная ситуация
Подумайте, как можно назвать вещества, которые состоят из двух элементов и в которых есть кислород? Как их можно классифицировать?
Все ли данные вещества являются оксидами?
Какая цель нашего урока?
в) Определение реакции по тепловому эффекту реакции.
Термохимические реакции – слайдовая презентация.
Новые знания.
Горение и медленное окисление
Горение – это первая химическая реакция, с которой познакомился человек. Огонь… Можно ли представить наше существование без огня? Он вошел в нашу жизнь, стал неотделим от нее. Без огня человек не сварит пищу, сталь, без него невозможно движение транспорта. Огонь стал нашим другом и союзником, символом славных дел, добрых свершений, памятью о минувшем.

Мемориал славы
Пламя, огонь, как одно из проявлений реакции горения, имеет и свое монументальное отражение. Яркий пример – мемориал славы.
Раз в четыре года в мире происходит событие, сопровождающееся переносом «живого» огня. В знак уважения к основателям олимпиад огонь доставляют из Греции. По традиции один из выдающихся спортсменов доставляет этот факел на главную арену олимпиады.
Об огне сложены сказки, легенды. В старину люди думали, что в огне живут маленькие ящерицы – духи огня. А были и такие, которые считали огонь божеством и строили в его честь храмы. Сотни лет горели в этих храмах, не угасая, светильники, посвященные богу огня. Поклонение огню было следствием незнания людьми процесса горения.
 Олимпийский огонь
Олимпийский огонь
М.В.Ломоносов говорил: «Изучение природы огня и без химии предпринимать отнюдь невозможно».
Горение - реакция окисления, протекающая с достаточно большой скоростью, сопровождающаяся выделением тепла и света.
Схематически этот процесс окисления можно выразить следующим образом:

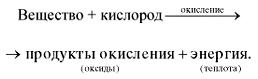
Реакции, протекающие с выделением теплоты, называются экзотермическими (от греч. «экзо» - наружу).
При горении идет интенсивное окисление, в процессе горения появляется огонь, следовательно, такое окисление протекает очень быстро. Если скорость реакции окажется достаточно большой? Может произойти взрыв. Так взрываются смеси горючих веществ с воздухом или кислородом. К сожалению, известны случаи взрывов смесей воздуха с метаном, водородом, парами бензина, эфира, мучной и сахарной пылью и т.п., приводящие к разрушениям и даже человеческим жертвам.
Для возникновения горения необходимы:
Температура воспламенения у каждого вещества различна.
В то время как эфир может воспламениться от горячей проволоки, для того чтобы поджечь дрова, нужно нагреть их до нескольких сот градусов. Температура воспламенения веществ различна. Сера и дерево воспламеняются при температуре около 270 °С, уголь – около 350 °С, а белый фосфор – около 40 °С.
Однако не всякое окисление непременно должно сопровождаться появлением света.
Существует значительное число случаев окисления, которые мы не можем назвать процессами горения, ибо они протекают столь медленно, что остаются незаметными для наших органов чувств. Лишь по прошествии определенного, часто весьма продолжительного времени мы можем уловить продукты окисления. Так, например, обстоит дело при весьма медленном окислении (ржавлении) металлов или при процессах гниения.

Разумеется, при медленном окислении выделяется теплота, но это выделение вследствие продолжительности процесса протекает медленно. Однако сгорит ли кусок дерева быстро или подвергнется медленному окислению на воздухе в течение многих лет, все равно – в обоих случаях при этом выделится одинаковое количество теплоты.
Медленное окисление – это процесс медленного взаимодействия веществ с кислородом с медленным выделением теплоты (энергии).
Примеры взаимодействия веществ с кислородом без выделения света: гниение навоза, листьев, прогоркание масла, окисление металлов (железные форсунки при длительном употреблении становятся тоньше и меньше), дыхание аэробных существ, т. е. дышащих кислородом, сопровождается выделением теплоты, образованием углекислого газа и воды.
Познакомимся с характеристикой процессов горения и медленного окисления приведённой в таблице.
Характеристика процессов горения и медленного окисления
| Признаки реакции | Процесс |
| Горение | Медленное окисление |
| Образование новых веществ | Да
(оксиды) | Да
(оксиды) |
| Выделение теплоты | Да | Да |
| Скорость выделения теплоты | Большая | Небольшая
(идет медленно) |
| Появление света | Да | Нет |
Вывод: реакции горения и медленного окисления – это экзотермические реакции, отличающиеся скоростью протекания этих процессов.
II. Тепловой эффект химической реакции.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного МОЛЯ реагента или (реже) для моля продукта реакции. Количество теплоты, выделяющееся или поглощающееся при химической реакции, называется тепловым эффектом реакции (Q). Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений:
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
2 H2(г) + O2(г) = 2 H2О(ж) + Q
Это уравнение реакции называется термохимическим уравнением. Здесь символ "+Q" означает, что при сжигании водорода выделяется теплота. Эта теплота называется тепловым эффектом реакции. В термохимических уравнениях часто указывают агрегатные состояния веществ.
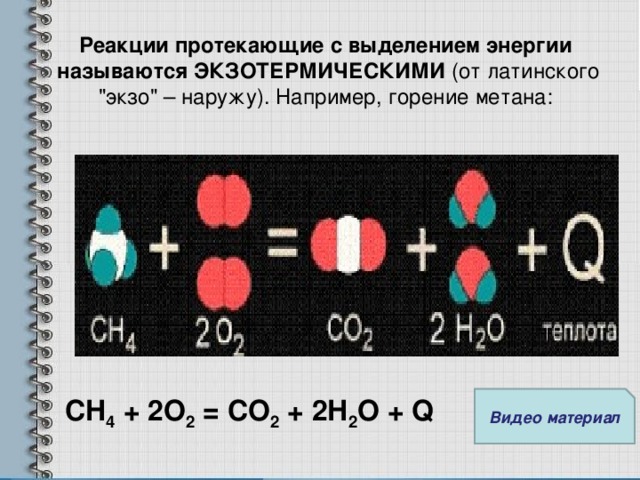
Реакции протекающие с выделением энергии называются ЭКЗОТЕРМИЧЕСКИМИ (от латинского "экзо" – наружу). Например, горение метана:
![]()
CH4 + 2O2 = CO2 + 2H2O + Q
Клип №1: Взаимодействие метана с кислородом (20 с)
Реакции протекающие с поглощением энергии называются ЭНДОТЕРМИЧЕСКИМИ (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании.
C + H2O = CO + H2 – Q
Тепловые эффекты химических реакций нужны для многих технических расчетов.
Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы (рис.).


Рис. Самая мощная в мире российская ракета "Энергия" перед стартом на космодроме Байконур. Двигатели одной из её ступеней работают на сжиженных газах - водороде и кислороде.
Допустим, вам известна работа (в кДж), которую придется затратить для доставки ракеты с грузом с поверхности Земли до орбиты, известна также работа по преодолению сопротивления воздуха и другие затраты энергии во время полета. Как рассчитать необходимый запас водорода и кислорода, которые (в сжиженном состоянии) используются в этой ракете в качестве топлива и окислителя?
Без помощи теплового эффекта реакции образования воды из водорода и кислорода сделать это затруднительно. Ведь тепловой эффект - это и есть та самая энергия, которая должна вывести ракету на орбиту. В камерах сгорания ракеты эта теплота превращается в кинетическую энергию молекул раскаленного газа (пара), который вырывается из сопел и создает реактивную тягу.
В химической промышленности тепловые эффекты нужны для расчета количества теплоты для нагревания реакторов, в которых идут эндотермические реакции. В энергетике с помощью теплот сгорания топлива рассчитывают выработку тепловой энергии.
Врачи-диетологи используют тепловые эффекты окисления пищевых продуктов в организме для составления правильных рационов питания не только для больных, но и для здоровых людей - спортсменов, работников различных профессий. По традиции для расчетов здесь используют не джоули, а другие энергетические единицы - калории (1 кал = 4,1868 Дж). Энергетическое содержание пищи относят к какой-нибудь массе пищевых продуктов: к 1 г, к 100 г или даже к стандартной упаковке продукта. Например, на этикетке баночки со сгущенным молоком можно прочитать такую надпись: "калорийность 320 ккал/100 г".
г) Слайдовая презентация по теме «Оксиды» (презентация)
Закрепление изученного материала (работа на интерактивной доске)
а) Составление формул оксидов с учетом валентностей элементов
№ 1 задания: составьте формулу полученных веществ с учетов валентностей химических элементов в указанных соединениях:
1. KO, SO, РO, SO, CuO, MnO, СО, СО2
ответ: K2O, SO2, Р2O5, SO3, Cu2O, Mn2O7, СО, СО2
2. AlO, NaO, BaO, CO, Crо, CaO, ZnО, SO, HО, PO, KО, FeO, NO, NO.
ответ : Al2O3, Na2O, BaO, CO2, Cr2О3, CaO2, ZnО, SO3, H2О, P 2O5
K2О, Fe2 O3, NO3, N2O5.
№ 2 задание. Выпишите оксиды, дайте им названия и определите валентность:
CO2, SnCl2, P2O5, FeCl2, ZnO, AgNO3, MgSO4, Ba(OH)2, H2CO3, FeS, H2SiO3, KOH, H2SO4, LiOH, HJ, Al(OH)3, HgO, CuSO4, H2O, CaCO3.
H2S, Na2SiO3, SO2, CuO, HClO4, P2O3, Zn(OH)2, NaOH, Ca(NO3)2, KCl, Mg3(PO4)2, Cu(OH)2, Na2O, HBr, Cl2O7, Fe2(SO4)3, Ba(OH)2, H3BO3, HgCl2, ZnCO3.
б) Составление уравнений реакций получения оксидов - карточки
5. Рефлексия. Подведение итогов. Домашнее задание
Подведем итоги нашей работы.
Вспомните, какую цель мы поставили в начале урока?
Как вы считаете, достигли ли мы целей?
А теперь оцените свою деятельность на уроке. Ответьте на предложенные вопросы.
Что изучали сегодня на уроке?
Кто желает сформулировать определение оксидов.
На какие группы делятся оксиды?
Коррекция самооценок, самоанализа, выставление оценок.
Домашнее задание: составить по 10 примеров оксидов.
 ЕМА: Горение и медленное окисление.
ЕМА: Горение и медленное окисление. 



 Олимпийский огонь
Олимпийский огонь
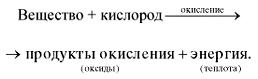











![Цели по содержанию: обучающие: формирование у обучающихся представления: о классе оксидов, (умение их называть и классифицировать), о термохимических реакциях, а так же о процессах горения и медленном окислении; развивающие: развитие умения анализировать, сравнивать, обобщать, делать выводы, развивать внимание; воспитывающие: развитие мотивации к предмету химия, воспитание ответственного и бережного отношения к окружающей среде. [ Image information in product ] Image :www.photosclub.co.kr / CD_Global Business&communication(ImageStates) Note to customers : This image has been licensed to be used within this PowerPoint template only. You may not extract the image for any other use.](https://fsd.kopilkaurokov.ru/uploads/user_file_5697b87ce6f9c/img_user_file_5697b87ce6f9c_2_2.jpg)