Цель работы:Практически ознакомиться со свойствами веществ в различных агрегатных состояниях и систем с непостоянным составом, методами устранения жесткости воды и приготовлением растворов разной концентрации. Экспериментально произвести смешивание пигментов для получения заданного цвета.
- Краткие сведения о свойствах и методах получения газообразных веществ ( кислород, водород, углекислый газ, этилен), заполнение таблицы.
Способ получения
Способ собирания
Способ распознавания
1.Кислород
О2
2.Водород
Н2
3.Углекислый газ
СО2
4.Этилен
С2Н4
2.Строение и свойства воды.
Физические свойства воды
Строение молекулы воды
Виды жесткости
Способы устранения жесткости
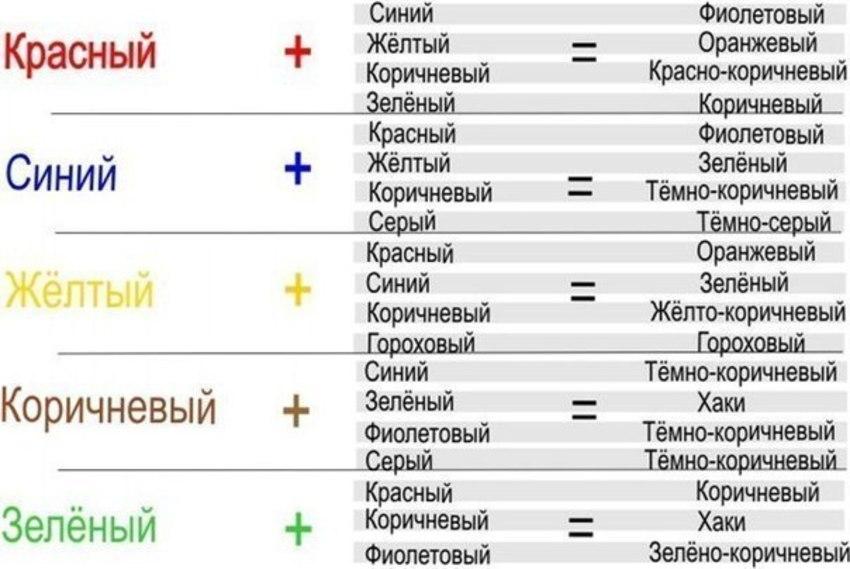
3.Получить, при помощи таблицы смешивания, зеленый и фиолетовый цвет.
4.Приготовление растворов разной концентрации:
- Приготовить раствор поваренной соли с массовой долей растворенного вещества 2%, если масса раствора равна 100 граммам.
- Приготовить 5%-ый раствор сахара, если масса воды 50 граммов.
- Приготовить раствор NaCI, вычислив его необходимую массу, если молярная концентрация в 0,1 л равна 0,02 моль/л.
Расчетные формулы:
m р.в. *100%
- ω % = m р-ра
ω % - массовая доля растворенного вещества (%)
m р.в. – масса растворенного вещества (г)
m р-ра – масса раствора (г)
- n
с = V р-ра
с- молярная концентрация ( моль/л)
V р-ра – объем раствора (л)
Выводы:
- Свойства газов:
- Чем обоснована жесткость воды?
3. Как изменяются свойства коллоидных растворов при длительном хранении? Является ли смена цвета химическим явлением при смешивании красок? Почему акварельная краска в растворе воды в течение небольшого времени оседает.
4.