| Этап урока и его содержание с хронометражем | Деятельность учителя | Деятельность учащихся |
| I. Организационный момент (2 мин.) | Приветствие учащихся, учет посещаемости, задается эмоциональный тон урока | Настраиваются на урок |
|
|
| II. Актуализация знаний (5 мин.) Проверяется усвоения темы «Кислоты, их классификация и свойства» |
Проводит опрос по ранее изученной теме, активизирует процесс познания с помощью вопросов |
Отвечая на вопросы, демонстрирует уровень знаний по теме «Кислоты, их классификация и свойства» |
| Задание № 1. «Что лишнее» Н SO SO ; H ; H S; CuO; HNO S; CuO; HNO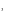 (CuO – оксид) (CuO – оксид) Н SO SO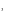 ; HCl; HNO ; HCl; HNO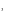 ; Н ; Н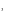 PO PO (HCl - безкислородная кислота) (HCl - безкислородная кислота) HNO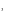 ; Н ; Н SO SO ; H ; H CO CO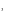 ; Н ; Н SO SO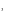 (HNO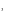 - одноосновная - одноосновная кислота) |
|
|
| Задание № 2. Выберите формулу сильной кислоты: 1. Н S 2. HNO S 2. HNO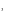 3. H 3. H SiO SiO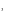 ( HNO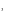 ) ) |
|
|
| Задание № 3. С какими из перечисленных веществ взаимодействует соляная кислота: 1. Mg 2. NaOH 3. P O O 4. HNO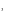 5. K 5. K O 6. AgNO O 6. AgNO 7. Cu (Отв.: Mg, NaOH, K O, AgNO O, AgNO ) ) |
|
|
|
|
| III. Введение новых знаний. а) вводно-мотивационный этап: Учитель: В начале учебного года мы с вами отправились в путешествие по самой удивительной стране с множеством тайн и загадок – стране Химии. Страну эту населяют множество существ-веществ, которые имеют свой состав, особенности, обычаи. В этой удивительной стране живут вещества простые и сложные, спокойные и беспокойные, ядовитые и безвредные, имеющие разные взгляды на отношение друг к другу, но живущие по общим химическим законам. В: Со свойствами каких классов неорганических соединений мы с вами уже познакомились? (Оксиды и кислоты) Учитель: А сегодня мы с вами отправляемся в гости к Основаниям. |
Задает эмоциональный тон урока. Активизация процесса познания с помощью вопросов
|
Психологически настраиваются на восприятие материала, включаются в процесс восприятия
|
| б) постановка целей Учитель сообщает тему, план урока и учащиеся вместе с ним формулируют его цель. На доске написан план урока План: Состав и название оснований. Классификация оснований. Понятие об основаниях как классе электролитов. Распознавание щелочей (качественная реакция) Химические свойства оснований. | Сообщает тему и план урока
| Принимают цели, осознают свои возможности, определяют перспективу работы до конца урока.
|
| в) первичное обобщение и введение новых знаний В: Что такое основания? (Основания – это сложные вещества, состоящие из атомов металлов и соединенных с ними одной или нескольких гидроксо-групп) |
|
|
| Задание № 1. «Крестики-нолики» Покажите выигрышный путь, который составляют формулы оснований. | Н О О | CuO | Н О О | | NaOH | KOH | CuOH | | Ca(OH) | HNO | BaSO |
| MgCl | KOH | Ca(OH) | | CaCO | Ba(OH) | KCl | | Al(OH)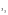 | HCl | LiOH | В. Назовите выбранные основания | Активизация процесса усвоения знаний и первичного их обобщения в игровой форме
| Выполняют задание, демонстрируют имеющиеся знания.
|
| Задание № 2 Классификация оснований (заполняют 3 ученика) | Признаки классификации | Основания | |
|
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
| В. Назовите известные вам признаки классификации оснований и впишите их в таблицу (1. Растворимость в воде) 2. Степень ЭД) Учитель. Чтобы найти еще один признак, вернемся к игре в «крестики-нолики». В. В чем отличаются основания групп а) и б)? ( числом ОН-групп, признак - кислотность) 2 ученика заполняют таблицу на примере гидроксида натрия и гидроксида магния. |
Активизация процесса усвоения знаний. Помогает ученикам заполнять таблицу. |
Систематизируют и обобщают знания, заполняя таблицу у себя в тетради. |
| Учитель. Среди оснований есть одно, которое не содержит в составе атомы металла. |
|
|
| Задание № 3. Используя таблицу растворимости, составьте формулу этого основания и назовите его. (NH OH – гидроксид аммония) OH – гидроксид аммония) Используя текст учебника (§ 39 с.215) найдите каким свойством обладает это вещество. (легко разлагается на аммиак и воду). Ученик у доски заполняет таблицу на примере гидроксида аммония) |
| Работают с таблицей растворимости и текстом учебника |
| Учитель: Однако, какими бы разными ни были основания, попробуем дать еще одно определение данного класса веществ, указывающее на их сходство с точки зрения ТЭД. (Основания (щелочи) – это электролиты, образующие при диссоциации катионы металла и анионы гидроксо-групп) | Помогает систематизировать и обобщить знания | Обобщают полученные данные, делают вывод |
| Распознавание щелочей  Задание № 4 Составить уравнения диссоциации гидроксида бария Задание № 4 Составить уравнения диссоциации гидроксида бария 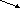 КОН↔К КОН↔К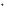 + ОН + ОН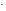 щелочная щелочная   Ва(ОН) Ва(ОН) ↔Ва ↔Ва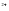 + 2ОН + 2ОН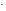 среда среда  Изменяет окраску индикаторов |
|
|
| В.: Какие ионы обуславливают проявление щелочами общих свойств? (гидроксид – ионы (-ОН)) Как распознать щелочи? (индикаторами) Как изменяют окраску индикаторы? (лакмус – синий, метилоранж – желтый, фенолфталеин –малиновый) | Задает вопросы, подводит учащихся к их решению | Анализируют поученные данные, делают выводы |
| Экспериментальная задача (выполняет ученик) В двух пробирках находятся растворы гидроксида натрия и соляной кислоты. Как определить содержимое каждой из пробирок. (Добавить в обе пробирки индикатор – фенолфталеин. Там, где окраска станет малиновой – щелочь, где не изменится – кислота) | Дает инструкцию по проведению опыта, напоминает о ТБ | Учащиеся наблюдают, анализируют происходящие изменения, делают выводы. |
| Химические свойства оснований Проблемный вопрос: будут ли отличаться по химическим свойствам щелочи и нерастворимые основания? | Формулирует проблему, направляет учащихся в русло исследовательской работы | Анализируют свойства, составляют схемы |
| Задание № 5. Вспомните и составьте схемы, отражающие известные вам свойства оснований. основание + кислота → соль + Н О (р. обмена) О (р. обмена) щелочь + кислотный оксид → соль + Н О (р. обмена) О (р. обмена) Учитель: Какими еще химическими свойствами обладают основания выясним в ходе выполнения лабораторных опытов. (Повторяют правила ТБ) |
|
|
| Инструктивная карта Опыт № 1. Взаимодействие щелочей с солями. Налейте в пробирку 1мл гидроксида натрия. Прилейте в нее 2 мл сульфата меди (II) В. 1. Что наблюдаете? (Выпадение голубого осадка) 2.Запишите уравнение этой реакции в молекулярном и ионном виде. 3.Составьте схему реакции Щелочь + соль → новое основание + новая соль | Дает инструктаж по проведению опыта, напоминает о правилах ТБ | Самостоятельно выполняют работу, анализируют увиденное, обсуждают, делают выводы, составляют уравнения реакций |
| Опыт № 1 Разложение нерастворимых оснований Пробирку с осадком из опыта № 1 поместите в ручной зажим и нагрейте на спиртовке. В.: 1. Что наблюдаете? (изменение цвета) 2.Составьте уравнение реакции, укажите условия ее протекания. Назовите получившиеся вещества. 3. Составьте схему реакции нерастворимое оксид + оксид + основание металла + Н2О
По мере выполнения работы учащиеся выносят на доску уравнения реакций. |
|
|
| В.: На основании изученных свойств назовите классы веществ с которыми взаимодействуют: а) щелочи (кислоты, кислотные оксиды, соли) Б) нерастворимые основания (кислоты, разлагаются при t) | Подводит учащихся к решению проблемы | Анализируют результаты опытов, делают выводы |
| IV. Закрепление новых знаний (4 мин.) Задание. Выпишите из таблицы для каждого основания номера клеток с характерными для него химическими свойствами. Сумма номеров правильных ответов равна относительной атомной массе натрия
(1+3+6+5+8 = 23) | Свойства оснований | Щелочь | Нерастворимое основание | | Раствор фенолфталеина окрашивается в малиновый цвет | 1 | 2 | | Взаимодействует с кислотами | 3 | 6 | | Взаимодействует с растворами солей | 5 | 4 | | Разлагается при t | 7 | 8 |
|
|
Закрепляют полученные знания |
| V. Контроль и оценка знаний (7 мин.) Учащиеся выполняют тест для индивидуального контроля усвоения новых знаний ТЕСТ Даны вещества: 1. КОН 3. Аl(OH)3 5 HCl 2. SO4 4. LiOH 6. FeCl3 7. Mg(OH)2 8. Na2O 9. H2SO4 10. KCl | I в. | II в. | | 1.Выбрать щелочи 2. Выбрать многокислотные основания 3. Выбрать основания, которые не разлагаются при t. 4. Выбрать вещества, с которыми взаимодействует Cu(OH)2 | 1. Выбрать нерастворимые основания 2. Выбрать однокислотные основания 3. Выбрать основания, которые разлагаются при t 4. Выбрать вещества,с которыми взаимодействует NaOH |
|
Осуществляет контроль и оценку знаний
|
|
| VI. Рефлексия содержания учебного материала, деятельности и эмоционального состояния учащихся. 1. Закончить фразу: Основания – это…, образующие при диссоциации … и … Дать классификационную характеристику LiOH а) по растворимости - … б) по кислотности - … в) по степени диссоциации - … Свое настроение на уроке отмечают нарисовав лучик на одном из 3-х рисунков, отражающих эмоциональное состояние.  VII. Домашнее задание (2 мин.) § 39 В школьном коридоре были найдены два обрывка разорванных шпаргалок. На одном были написаны формулы исходных веществ, на другом – продуктов реакции. Ваша задача восстановить недостающие части 1. FeCl3 + KOH → … Mg(OH)2 + HCl → … 2. …  Al2O3 + H2O Al2O3 + H2O … → CaCO3 + H2O |
|
|
 SO
SO ; H
; H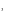 (CuO – оксид)
(CuO – оксид)
 Задание № 4 Составить уравнения диссоциации гидроксида бария
Задание № 4 Составить уравнения диссоциации гидроксида бария КОН↔К
КОН↔К + ОН
+ ОН щелочная
щелочная
 Ва(ОН)
Ва(ОН) + 2ОН
+ 2ОН















