Американский химик и физик

Биография
1934 Первый шаг в биохимии. Исследует механизм взаимодействия гемоглобина и кислорода.
1936 Занимается исследованием антител и структуры белка.
1942 Изобретает оксигенометр , совместно с коллегой создаёт искуственную плазму.
1949 Начал работу по изучению серповидно-клеточной анемии
1954 Получает Нобелевскую премию за работы по теории химической связи.
1963 В связи с состоявшимся запрещением испытаний ядерного оружия в атмосфере,
получает Нобелевскую премию за миротворчество.
1970 Издаёт книгу «Витамин С и простуда»
1979 Издаёт книгу «Витамин С и рак»
1986 Издаёт книгу "Как прожить дольше и чувствовать себя лучше".
Биография
Американский химик Лайнус Карл Полинг родился в Портленде (штат Орегон), в семье Льюси Полинг и Уильяма Полинга, фармацевта. Отец умер, когда его сыну исполнилось 9 лет. Полинг с детства увлекался наукой. Вначале он собирал насекомых и минералы. В 13-летнем возрасте один из друзей Полинга приобщил его к химии, и будущий ученый начал ставить опыты. Делал он это дома, а посуду для опытов брал у матери на кухне.
В одиннадцать лет уже работал с цианистым калием.
Полинг посещал Вашингтонскую среднюю школу в Портленде, но не получил аттестата зрелости. Тем не менее он записался в Орегонский государственный сельскохозяйственный колледж в Корваллисе, где изучал главным образом химическую технологию, химию и физику. Чтобы поддержать материально себя и мать, он подрабатывал мытьем посуды и сортировкой бумаги. Когда Полинг учился на предпоследнем курсе, его как на редкость одаренного студента приняли на работу ассистентом на кафедру количественного анализа. На последнем курсе он стал ассистентом по химии, механике и материалам. Получив в 1922 г. степень бакалавра естественных наук в области химической технологии, Полинг приступил к подготовке докторской диссертации по химии в Калифорнийском технологическом институте в Пасадене.

Структура белков
Полинг ввел в научный обиход четыре уровня описания строения молекулы белка:
первичная структура – последовательность аминокислотных остатков,
вторичная структура – наличие и соотношение характерных фрагментов (таких как a-спираль и b-структура),
третичная структура – точная картина пространственного расположения атомов (или хотя бы аминокислотных остатков), задаваемая их пространственными координатами,
четвертичная структура – наличие субъединиц (подглобул, из которых формируется молекула белка-глобулина).
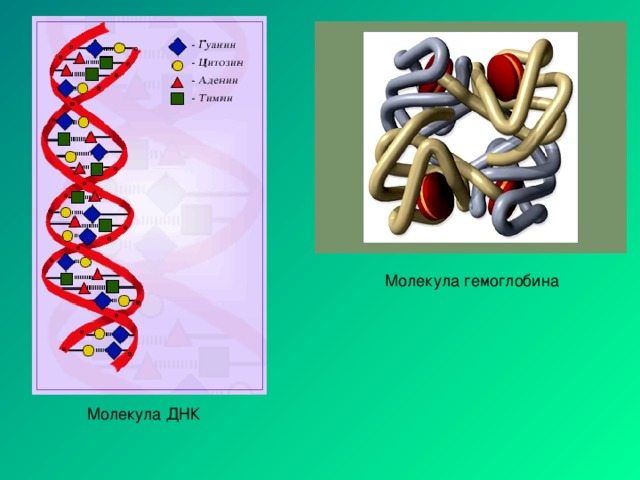
Эти понятия, сформулированные до того, как появились первые данные полного рентгеноструктурного анализа белков, вскоре получили экспериментальное подтверждение (структура гемоглобина, Перутц, 1960; структура миоглобина, Кендрю, 1960) и поныне составляют основу кристаллографии белка).

Нобелевская премия за работы по теории химической связи
В 1954 г. Полингу была присуждена Нобелевская премия по химии «за исследование природы химической связи и ее применение для определения структуры соединений». В своей Нобелевской лекции Полинг предсказал, что будущие химики станут «опираться на новую структурную химию, в т. ч. на точно определенные геометрические взаимоотношения между атомами в молекулах и строгое применение новых структурных принципов, и что благодаря этой технологии будет достигнут значительный прогресс в решении проблем биологии и медицины с помощью химических методов».

В 1945 г. Полинг и Кемпбелл сообщили о создании заменителя плазмы – оксиполижелатина.
Оксигенометр (oximeter). Прибор, используемый для измерения насыщения крови кислородом по ее оптической плотности.
Работа по изучению серповидно-клеточной анемии
В 1949 г. Полинг начал работу по изучению серповидно-клеточной анемии. Название этой наследственной болезни, приводящей к смерти, связано с тем, что эритроциты больного приобретают форму серпа, теряя при этом способность переносить кислород. Проявив незаурядную интуицию, Полинг предположил, что причина недуга кроется в нарушении аминокислотной последовательности в полипептидной цепи гемоглобина – белка , осуществляющего транспорт кислорода в организме. Спустя три года Полингу удалось с помощью электрофореза разделить нормальный и дефектный гемоглобин и доказать, что в структуре последнего имеется «опечатка»: один из аминокислотных остатков (остаток глутаминовой кислоты) заменен другим (остатком валина). Впоследствии было установлено, что в молекуле гемоглобина человека и высших животных в строго определенной последовательности соединены 574 аминокислотных остатка. И вот, как обнаружил Полинг, замена лишь одного из них приводит к тяжкой болезни. В настоящее время известно более 50 разновидностей аномальных гемоглобинов, вызывающих различные патологические состояния.
Нобелевская премия за миротворчество
1957 г. Полинг составил проект воззвания, в котором содержалось требование прекратить ядерные испытания , его подписало более 11 тыс. ученых из 49 стран мира , и среди них свыше 2 тыс. американцев. В январе 1958 г. Полинг представил этот документ генеральному секретарю ООН. Такая серьезная общественная и личная озабоченность по поводу опасности заражения атмосферы радиоактивными веществами привела к тому, что в 1958 г., несмотря на отсутствие какого бы то ни было договора, США, СССР и Великобритания добровольно прекратили испытания ядерного оружия в атмосфере.
В июне 1961 г. Полинг и его жена созвали конференцию в Осло против распространения ядерного оружия. В сентябре того же года, несмотря на обращения Полинга к Никите Хрущеву, СССР возобновил испытания ядерного оружия в атмосфере. В июле 1963 г. США, СССР и Великобритания подписали договор о запрещении ядерных испытаний, в основе которого лежал проект Полинга.
В 1963 г. Полинг был награжден Нобелевской премией мира . В своей вступительной речи от имени Норвежского нобелевского комитета Гуннар Ян заявил, что Полинг «вел непрекращающуюся кампанию не только против испытаний ядерного оружия, не только против распространения этих видов вооружений, не только против самого их использования, но против любых военных действий как средства решения международных конфликтов». В своей Нобелевской лекции, названной «Наука и мир», Полинг выразил надежду на то, что договор о запрещении ядерных испытаний положит «начало серии договоров, которые приведут к созданию нового мира, где возможность войны будет навсегда исключена».
«Витамин С и простуда»
Полинг в своей лекции мимоходом бросил замечание, что сам с успехом применяет витамин С для профилактики простуды. Местные газеты тут же раззвонили об этом, и вскоре высказывания Полинга о том, что большие дозы витамина С полезны, стали достоянием гласности. Несколько врачей немедленно обрушились на него с критикой. Где, спрашивали они, научные доказательства правоты Полинга?
И Полинг начал их собирать. Он нашел пять аккуратно выполненных широкомасштабных медицинских исследований, явно доказывавших, по его мнению, что дозы витамина С, превышающие нормальные, способны снижать частоту и тяжесть простуды. В некоторых из этих исследований пациентам давали немного добавочного витамина С, и эффект был невелик. В других работах и дозы были больше, и эффект более заметный. Самые большие дозы были в швейцарском эксперименте с лыжниками, где одна половина группы ежедневно получала дополнительно по 1000 мг витамина С, а другая половина - нет. В получавшей витамин С группе количество человеко-дней простуды оказалось на 61%, а тяжесть простуды - на 65% меньше, чем в контрольной группе. Это скромное исследование убедило Полинга в том, что он на пути к очень важному открытию. Потребляя больше витамина С, дешевого и безопасного элемента питания, миллионы людей смогут улучшить свое здоровье. Взволнованный Полинг начал писать о своем открытии и статью в научный журнал, и научно-популярную книгу.

«Рак и витамин С»
В 1973 г. Полинг основал Научный медицинский институт Лайнуса Полинга в Пало-Альто. В течение первых двух лет он был его президентом, а затем стал там профессором. Он и его коллеги по институту продолжают проводить исследования терапевтических свойств витаминов, в частности возможности применения витамина С для лечения раковых заболеваний.
В 1979 г. Полинг опубликовал книгу «Рак и витамин С» , в которой утверждает, что прием в значительных дозах витамина С способствует продлению жизни и улучшению состояния больных определенными видами рака. Однако авторитетные исследователи раковых заболеваний не находят его аргументы убедительными.
Помимо двух Нобелевских премий , Полинг был удостоен многих наград. В их числе:
награда за достижения в области чистой химии Американского химического общества (1931),
медаль Дэви Лондонского королевского общества (1947),
советская правительственная награда – международная Ленинская премия «За укрепление мира между народами» (1971),
национальная медаль « За научные достижения» Национального научного фонда (1975),
золотая медаль имени Ломоносова Академии наук СССР (1978),
премия по химии американской Национальной академии наук (1979)
и медаль Пристли Американского химического общества (1984).
Ученому присвоены почетные степени Чикагского, Принстонского, Йельского, Оксфордского и Кембриджского университетов. Полинг состоял во многих профессиональных организациях. Это и американская Национальная академия наук, и Американская академия наук и искусств, а также научные общества или академии Германии, Великобритании, Бельгии, Швейцарии, Японии, Индии, Норвегии, Португалии, Франции, Австрии и СССР.
Он был президентом Американского химического общества (1948) и Тихоокеанского отделения Американской ассоциации содействия развитию науки (1942 – 1945), а также вице-президентом Американского философского общества (1951 – 1954).

- Деятельность
- Как жить долго и быть здоровым
- Аскорбинка по Полингу
- Биография
- Научная сеть Лайнуса Полинга
- Из энциклопедии КМ
- Подробнее