ваыреырявабтюфбьтж№ьмбвбю№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№№бтовимооооооооооооооооооооооооооооооооооооооооммммммммммммммллллллллллллллллллпиииииииииииииииииииииииииииииииииииииииииииииииииииииииииииииииииьмммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммммм
- Меню
- Главная
- Дошкольное образование
- Начальные классы
- Астрономия
- Биология
- География
- Информатика
- Математика
- Алгебра
- Геометрия
- Химия
- Физика
- Русский язык
- Английский язык
- Немецкий язык
- Французский язык
- История
- Естествознание
- Всемирная история
- Всеобщая история
- История России
- Право
- Окружающий мир
- Обществознание
- Экология
- Искусство
- Литература
- Музыка
- Технология (мальчики)
- Технология (девочки)
- Труд (технология)
- Физкультура
- ИЗО
- МХК
- ОБЗР (ОБЖ)
- Внеурочная работа
- ОРК
- Директору
- Завучу
- Классному руководителю
- Экономика
- Финансовая грамотность
- Психологу
- ОРКиСЭ
- Школьному библиотекарю
- Логопедия
- Коррекционная школа
- Всем учителям
- Прочее
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
"Коссейт" СОШ
Просмотр содержимого документа
«"Коссейт" СОШ»
Сабақтың тақырыбы: Азот оксидтері
Сабақтың мақсаты:
a) Білімділік: Жаңа инновациялық технологияларды қолдану, теориялық жеке- дара өз білімдерін тиімді пайдалану. Жүйелі жұмыс істеуге мүмкіндік туғызу.
ә) Тәрбиелік: алған білімдерін өмірде пайдалана білу, өзіндік ой қорытуға, жан-жақтылыққа тәрбиелеу, қауіпсіздік ережелерін есте сақтау, сабақ уақытын бағалауға үйрету,еңбекқорлыққа және пәнге қызығушылығын арттыру.
б) Дамытушылық: оқушылардың қызығушылықтарын арттыру, өз-өзіне деген сенімін күшейтіп, таным қабілетін дамыту, мұғалім - бағыттаушы, оқушы – ізденуші рөлін атқару.
Сабақтың әдісі: СТО бағдарламасы стратегиялары
Сабақтың түрі: Аралас сабақ
Сабақтың көрнекілігі: азот, кесте, химиялық диктант, сөзжұмбақ, семантикалық карта, слайд презентациялар.
Сабақтың барысы: І. Ұйымдастыру кезеңі
- оқушылармен сәлемдесу;
- оқушы санын түгендеу;
- оқушылардың сабаққа дайындығын тексеру;
- оқушыларға жаңа сабақтың тақырыбымен және мақсатымен таныстыру.
ІІ. Үй тапсырмасын сұрау.
ІІІ. Жаңа сабақ."Азот оксидтері."
Сабақ 6 кезеңнен тұрады:
І кезең. "Ой шақыру"үй тапсырмасы сұралады.
(2 қатар бойынша)
Алынуы Физикалық Алынуы
қасиеттері
Қолданылуы Химиялық Қолданылуы қасиеттері

Жаңа сабақ: Азот оксидтері.
II кезең.«Қызығушылығын ояту» үш түрлі тапсырмасымен жүргізіледі.
а) Семантикалық карта толтыру, оқушы азот оксидтерін, тұздарын, қышқылдарын ажыратады.
| N2 | HNO3 | NO2 | NaNO3 | HNO2 | NO | Ca(NO3)2 | AgNO3 |
| тұздары |
|
|
|
|
|
|
|
| қышқылдары |
|
|
|
|
|
|
|
| оксидтері |
|
|
|
|
|
|
|
ә) «Қандай зат түзілді?» ойыны аукцион ойыны түрінде өткізіледі. Дөңгелек тақташадағы бағдаршаны айналдыра отырып, сәйкес келген формула бойынша реакция теңдеулерін жүргізіп, шыққан өнімді анықтау, салыстырмалы молекулалық массасын табу. Есеп шотқа 500 теңгелік тиындар салынады, реакцияны дұрыс жүргізген, жауабын тапқан оқушы 50 теңгеден ұтып отырады, ұтылса 50 теңге салады.
б) «Миға шабуыл» кезеңі.
Сөзжұмбақ шешу.
|
|
|
| А |
|
| |||||||
|
|
|
| З |
| ||||||||
|
| О |
|
|
|
|
| ||||||
|
|
| Т |
|
|
| |||||||
Ең жеңіл балқитын металл?
Азоттың агрегаттық күйі?
Биэлементтік қосылыс, оның біреуі оттегі болып келетін зат?
Өмір мен ойдың элементі?

IIIкезең. «Мағынаны тану кезеңі».
Есептер шығару .
1-есеп.30г суда 10г натрий гидроксидін еріткенде түзілетінің сілтінің массалық үлесін тап?
2-есеп.Массасы 75г мыс пен мыс (ІІ) оксиді қоспасын концентрациялы азот қышқылы мен өңдегенде, 22,88л (қ.ж) газ бөлінген. Бастапқы қоспадағы мыс (ІІ) оксидінің массасы мен массалық үлесін табаңыз?
IV кезең. "Ой толғаныс кезеңі".
Оқулықпен жұмыс арқылы азот оксидтері туралы ассоциациясын толтырады.
Vкезең. "Білімді тиянақтау " кезеңінде тақтаға деңгейлік тапсырма беріледі.
а)Химиялық диктант.
Азот қосылыстарында ____________ тотығу дәрежесін көрсету.
Азоттың сутекпен қосылысы __________.
Азоттың тұздарың ___________ деп атайды.
Азоттың оксидтерін жаз______________.
Азот элементінің химиялық таңбасы ___________.
Азот атомының электрондық құрылысы_____________.
Азот элементінің ұшқыш сутекті қосылысының формуласы__________________.

ә) "Сандарды сөйлетейік " ойыны ойналады.
Жауабы:
Бос күйіндегі азот ауаның басты құрам бөлігі, көлемі бойынша 78,1 % құрайды.
Ar(N) = 14
Реттік нөмірі – 7
1772 ж. азотты алғаш рет ағылшын химигі Д.Резерфорд ашқан жылы болып есептеледі.
Азот – 1960 С- та сұйылады.
Қату температурасы - 210 °C.
Тотығу дрежесі - -3. 
Тотығу дәрежесі - +5.
VI кезең. Сабақты қорытындылау. Оқушыларды бағалау.
Үйге тапсырма беру. Азот оксидтерінің халықшаруашылығындағы, адам тұрмысындағы маңызы туралы мағлұматтар жинап келу
| Пәні: Химия | 9 -сынып | ||
| Тақырыбы:
| “Металдардың жемірілуі және онымен күресу жолдары ”
| ||
| Мақсаты: | Металдардың жемірілуі туралы ақпарат алу. Металдардың жемірілуімен күресу жолдарын білу.
| ||
| Күтілетін нәтиже: | Металдардың жемірілуі туралы біледі. Жемірілумен күресу жолдарын үйренеді. Өз еркімен жұмыс жасай алады | ||
| Керекті жабдықтар: | Cу, темір шеге, ас тұзы ерітіндісі, натрий гидроксиді ерітіндісі,мырыш, мыс сыммен оралған темір шеге,сынауықтар, постер, маркер, фломастер, стикерлер, бағалау парағы. | ||
| Сабақ кезеңдері | Мұғалім әрекеті | Оқушы әрекеті | |
| Кіріспе. | 1.Оқушылармен амандасады. 2. Психологиялық әдіс; « Отбасылық сурет» 3. Сыныпты темір кендері: магнетит, пирит бойынша 2 топқа бөледі. 4.Топ басшыларына бағалау парақтары береді. 5. Өткен тақырып бойынша оқушылардың білімін тексеру. І кезең « Бәйге » бойынша сұрақтарға жауап берген топ бір кірпіштен алады , ал жауап бере алмаса кірпіш алмайды. Осылай үй тұрғызылады. Сұрақтар
| Мұғаліммен амандасады. Топтарға бөлінеді.
Топ басшылары бағалау парақтарын толтырады.
Оқушылар бір-бірін тексереді, балл қояды.
| |
| Тұсаукесер
Негізгі бөлім. | Металдар мен құймалар қоршаған ортада ненің әсерінен бүлінеді? . Сабақтың тақырыбы: “Металдар және оның құймаларының жемірілуі ”.
Топтарға жаңа тақырыпты ашу үшін тапсырма беріледі. 1-топ. Металдардың жемірілуі деген не? Оның қандай түрлері бар? Тұрмыстағы металдың жемірілуіне мысалдар келтіріңдер. 2-топ . Химиялық жемірілу ненің әсерінен болады? Мысал келтіріңдер.Металдар мен олардың құймаларын жемірілуден сақтаудың жолдарын көрсетіңдер Сонымен,металдар коррозиясы деген не? Ол ненің әсерінен болады? Металдар коррозиясы қандай заттардың әсерінен күшейеді? Оны болдырмау үшін қандай шаралар жүзеге асырылады? Күнделікті өмірден мысал келтіріңдер. |
Сабақтың тақырыбын дәптерлеріне жазады.
Оқушылар оқулықпен жұмыс жасайды, постер дайындап, қорғайды, қойылған сұрақтарға жауап береді.
| |
|
Қорытынды.
| ІІІ – кезең. Топтарға деңгейлік тапсырма береді.
Fe2O3 → Fe → FeCl2 → Fe(OH)2 ↓ ↓ FeO FeO 2) Құрамында 8 % қоспасы бар 300кг әктасты өртегенде алынатын сөндірілмеген әктің массасын есептеңдер. Тақтада 2 оқушы тапсырма орындайды. 1-тапсырма. Мүмкін болатын реакция теңдеулерін аяқта: Fe + HCl → Cu + HCl→ Zn + Pb(NO3)2 → Al + CuSO4 → Fe + HNO3 конц. Hg + CuCl2 → 2-тапсырма Массасы 15,2 г хром оксидін алюмениймен тотықсыздандырғанда 9 г хром түзіледі. Хромның теориялықпен салыстырғандағы шығымын процентпен көрсетіңдер? ІІІ кезең « Ширату » 1 – топ. Металлургия 2 - топ. Жемірілу
ІV кезең . Тәжірибе жасау «Жанартау»
Рефлекция Оқушыларға шар беріп, әр үпірген сайын бүгінгі сабақтан алған әсерлерін айтады. Оқушылар білімін бағалау.
Үйге тапсырма беру.
|
Топ басшыла-ры топ мүше-лерін бағалай-ды.Әр оқушы стикерлерге рефлексия жазып, өздерін бағалайды. Қабырғадағы кестеге стикерлерін өздерінің жаңа тақырыпты түсіну деңгей-леріне қарай жапсырады.
| |
Сыныбы: 10
Сабақтың тақырыбы: Алюминий және оның қосылыстары
Сабақтың мақсаты:
Білімділік: Алюминий элементінің периодтық жүйедегі орнын,табиғатта кездесуі,алынуы,физикалық,химиялық қасиеттерін, қолданылуын, қосылыстары туралы мəліметтерді меңгерту.
Дамытушылық: Оқушылардың пəнге қызығушылығын, дүниетанымын,
екідайлы элементтер жайлы алған білімді одан əрі дамыту.
Тəрбиелік:Топтарға бөліну арқылы шығармашылық жұмысты қалыптастыру.Алюминийдің тұрмыста қолданылуын, алюминий құймаларының құрамымен таныстыру, өмірдегі маңызын түсіндіру.
Сабақтың түрі: Дәстүрлі сабақ
Сабақтың əдісі :сұрақ - жауап, тест шешу, топпен жұмыс, есептер шығару
Сабақтың барысы:
1.Ұйымдастыру бөлімі.
2.Үй тапсырмасын сұрау.
Үй-жұмысын тексеру.
1.Кермек сулар дегеніміз? (құрамында гидрокарбонаттар хлорид, сульфаттар
түрінде Ca жəне Mg тұздары бар табиғи сулар)
2.Гипс – ғаныштың формуласы. (CaSO4 . 2H2O).
3.Кальцийдің физикалық қасиеттері (Кальций күмістей жылтыраған ақ түстес
металл, өте жеңіл, қатты, созылғыш).
4.Кальций қосылыстарда қандай қасиет көрсетеді? (күшті тотықсыздандырғыш).
5.Кальцийдің тотығу дəрежесі (+2).
6.Тұрақты кермек суды қалай тұщытады? (сода қосу)
7.CaH2 (кальций гидриді)
8.Уақытша кермек суды қандай əдіспен тұщытады? (Суды кайнату немесе
сөндірілген ізбес қосу)
9.Кальцийдің жер қыртысындағы мөлшері қанша? (3,6%)
10.Кальций қосылыстарын ата (Мрамор — CaCO3; доломит -CaCO3 * MgCO3. Фосфорит — Ca3(PO4)2 апатит — Ca3(PO4)2 * CaF2 норвегия селитрасы немесе кальций нитраты Ca(NO3)2.)
10.Кальцийді кім ашты? (1808ж ағылшын ғалымы Дэви)
3.Жаңа сабақты түсіндіру
Тақтада бір элементтің атом құрылысы берілген, ойланып бұл қай элемент
екенін табыңдар? + 13 AІ ) ) )
Aлюминий элементі III топтың негізгі топшасында орналасқан элемент,
сыртқы қабатында 3 электрон болғандықтан, ол қосылыстарда тұрақты +3 тотығу дəрежесін көрсетеді.III топшаның ішінде ядро заряды жоғарлаған сайын атомның иондану энергиясы төмендеп, элементтің металдық қасиеттері артады. Алюминий металл, оның оксиді мен гидроксидтері екідайлы қасиет көрсетеді.Қалыпты жағдайда III топша элементтерінің барлығында бір дара р электрондары болады. Сондықтан ол химиялық қосылыстарда бір валентті болуы мүмкін. Ал қозған күйде сыртқы қабаттың S- ұяшығындағы жұп электрондардың біреуі көршілес р-ұяшығына көшуінің нəтижесінде 3 дара электрондар түзіледі де, элементтің қосылысындағы валенттігі 3-ке тең.
Алюминийдің табиғатта кездесуі.
Алюминий латынның «алюмин» ашудас деген мағына береді. Табиғатта
ең кең тараған элемент. Табиғатта таралу жөнінен үшінші орында, ал металдық негізінде бірінші орында. Жер қыртысындағы массасы 8,8%. Алюминийдің маңызды қосылыстарына алюмосиликаттар, боксит, корунд, криолит
Алюмосиликаттар дегеніміз – құрамында Al, Si, O2, сілтілік жер
металдарының оксидтері арқылы түзілетін тұздар. Бокситтер-негізінен
гидратталған Al2O3 жəне қызыл түс беретін Fe2O3 тұратын тау жынысы. Бокситтен алюминий алады.Қазақстанда бокситтердің белгілі кен орындары бар,олар Қостанай жəне Ақтөбе облыстарында орналасқан. Корунд – құрамында Al2O3бар өте қатты минерал.Криолит-жасанды жолмен дайындалады, алюминий металлургиясында қолданады.
4.Жаңа сабақты бекіту
Оқушыларға топтар бойынша тапсырмалар беру.
І топ: Алыну жолы
ІІ топ: Физикалық қасиеті.
ІІІ топ: Химиялық қасиеті.
ІV топ: Қолданылуы.
І топ: Алыну жолдары:
а) зертханада алу. Алюминийді неміс химигі Фридрих Велер 1827 жылы алю-
миний хлоридіне ауа қатысынсыз сілтілік калий, натрий металдарын қосып,
қыздыру арқылы алюминий алған.
AlCl3+3K= 3KCl+Al
в) Өнеркəсіпте алу жолы.
а) Аl2O3 электролиздеу арқылы металл Аl – ді алуда 1880 жылы американ
инженер-химигі Чарлз Холл, француз химигі Полл Эру криолитте балқыған
Al2O3 (t=1000oC) электролиздеу арқылы алған.
в) Бокситтен глинозем алу, глиноземнен Аl алу, электрохимиялық əдіс
арқылы.
с) Металл алюминийді 1825 жылы дат физигі Ханс Кристиан Эрстед электро-
магнитизм аймағынан электр арқылы жəне алюминий құймаларынан Аl алған.
ІІ топ: Физикалық қасиеті
III топ. Химиялық қасиеттері:
Алюминий белсенді металл. Электрокернеу қатарында Mg-ден кейін
орналасқан. Алюминий атомының сыртқы қабатында 3 электрон бар. Реакция кезінде 3е беріп, химиялық қосылыстарда +3 тотығу дəрежесін көрсетіп, күшті тотықсыздандырғыш болады. Ал металдың беті ауадағы оттекпен жанасқанда,лезде тотығып, оксидті қабықшамен қапталады.Алюминий бетіндегі қабықшаның қалыңдығы 0,00001мм, ол өте берік,иілімді,созғанда бетке жабысып тұрады. Оксид қабықшасы ауада бұзылмайды,жемірілуге тұрақты.
«Химиялық қасиеттері » кестесі
| Жай заттар | Күрделі заттар |
| 2Al + 6 H2O → 2Al ( OH )3¯ + 3H22Al + 6HCl → 2Al Cl3 + 3H22Al+ 6NaOH +6H2O=2Na3[ Al(OH)6] + H2Натридің гексагидроксо алюминаты2Al + 3HgCl2 2AlCl3 + 3Hg Алюминий амальгамасы 8Al + 3Fe3O4 =9Fe + 4Al2O3 Бұл əдіс металлотермия деп аталады
| 4Al + 3O2= 2 Al2O32Al + 3Cl2=2AlCl32Al + 3S = Al2S32Al + 3N2=2AlN34Al +3C = Al4C3
|
ІV топ: Қолданылуы.
ІІІ. «Ой — толғаныс»
Тұжырымдамаларға жауабыңыз? (Диаграмма құру)
Aлюминий табиғатта таралуы бойынша І орын алады? (жоқ)
Aлюминий атомының сыртқы қабатында 3электрон бар (ия)
Aлюминий бір изотопы бар. (ия)
Aлюминий сілтімен артық мөлшерде комплексті тұз түзеді (ия)
Aлюминий құймалары өте ауыр ( жоқ)
6. Aлюминий белсенді металл (ия)
7. Aлюминий ауада тотығып оксид қабығымен қапталады (ия)
8. Aлюминий екідайлы металл (ия)
9. Aлюминий қоры Қазақстанда кездеспейді? (жоқ)
10. Aлюминий ауыр металл (жоқ)
11. Алюминотермия əдісін Н.Н. Бекетов ашты (ия)
- Aлюминий қосылыстарда І валентті (жоқ)
- Aлюминийге конц. салқын НNO3 əсер етеді.(жоқ)
- Aлюминий тек қосылыс түрінде кездеседі (ия)
- Aлюминийдің қайнау температурасы 660оС тең (ия)
- Aлюминий қышқыл , сілтімен де əрекеттеседі? (ия)
- Aлюминий электр тогын өткізбейді (жоқ)
- Aлюминийді бокситтен алады (ия)
- Aлюминий электрөткізгіштігі жөнінен І орында (жоқ)
- Aлюминий қосылысы зергерлік бұйымдар жасауда қолданылады (ия)
Есептер мен жаттығулар орындау:
Шешуі:
Бер: υ(Na)=1 моль 2Na+2H2O=2NaOH+H2
2 Al+6HCl=2 AlCl3+3H2 υ(Η2)=υ(Na)= 1/2=0,5моль
υ(Al)=υ(Η2)*2/3=0,333моль
Т/К: m(Al)=? m(Al)=υM=0,3327=9,0г
Жауабы:9г
Бер: ω(AlCl3)-5% Шешуі:
m(ер-ді)=40г AlCl3+NaOH=Na[Al(OH)4]+3NaCl
ω(NaOH)=0.2-20% m(AlCl3)=m(ер-ді)ω=400.05=2г
ρ=1.2г/см3 υ (AlCl3)=m/M=2/133.5=0.015 моль
υ (NaOH)=4* υ (AlCl3)=0.06 моль
т-к: V(ер-діNaOH)-? m(NaOH)= υM=0.0640=2,4г
m(ер-діNaOH)= m(NaOH)/ ω(NaOH)=2,4г/0,2=12г
V(ер-діNaOH)=m/ ρ=12г/1,2г/см3=10мл.
Жауабы:10мл
5.Үй тапсырмасы: Алюминий және оның қосылыстары
Сыныбы: 10
Сабақтың тақырыбы: Кальций және оның қосылыстары
Сабақтың мақсаты:
Білімділігі: Периодтық жүйедегі орны бойынша кальций атомының құрылысы, қасиеттері, оның қосылыстары, күнделікті өмірде қолдану салаларымен таныстыра отырып, алған білімдерін жадында сақтау, ойлау қабілетін дамыту, білімге құштарлығын, дүниетанымдық көзқарасын арттыру.
Тәрбиелілігі: Оқушыларды ұйымшылдыққа, төзімділікке, ұқыптылыққа, жауапкершілікке тәрбиелеу.
Дамытушылығы: Оқушылардың өз бетімен, ұжыммен жұмыс істеу біліктіліктерін дамыту, есте сақтау, ой - өрісін дамыту, өмірдегі көрген деректерді пайдалана білуіне және шығармашылықпен жұмыс істеуге дағдыландыру.
Сабақтың типі: Аралас сабақ.
Сабақтың әдісі: Сұрақ – жауап, зертханалық тәжірибе, топтық жұмыс, тірек – сызбалармен жұмыс, дифференциалау әдісі.
Көрнекілігі: Д. И. Менделеев кестесі, буклет, үлестірме тапсырмалар.
Сабақтың барысы:
: І. Ұйымдастыру:
ІІ. Үй тапсырмасын сұрау
ІІІ. Жаңа сабақ
ІҮ. Жаңа сабақты бекіту
Ү. Үй тапсырмасын беру
ҮІ. Қорытынды жасау, бағалау
І. Үйымдастыру кезеңі.
ІІ. Үй тапсырмасы «Бинго» ойыны барысымен сұралады:
1. Кендер деп нені айтады?
Жауабы: Өнеркәсіптік әдіспен металдар алынатын минералдарды кендер деп атайды.
2. Қазақстан қазба байлықтарының металлогендік картасын жасаған кім?
Жауабы: Қ. И. Сәтбаев
3. Жемірілу (коррозия) деген не?
Жауабы: Қоршаған орта факторларының әсерінен болатын металдың желіну құбылысы жемірілу (коррозия) деп аталады.
4. Жұмсақ металл?
Жауабы: Литий
5. Электролиттік диссоциация теориясын ашқан ғалым?
Жауабы: С. Аррениус
6. Кремний қышқылының тұздары қалай аталады?
Жауабы: Силикаттар
7. Сұйық металл?
Жауабы: Сынап
8. Күміс қасық шыны стақанға қарағанда жылуды неше есе өткізеді?
Жауабы: 500 есе
9. Ең қиын балқитын металл?
Жауабы: Вольфрам
10. Қанның құрамында кездесетін металл?
Жауабы: Темір
11. Металдарды олардың қосылыстарынан химиялық белсендірек металдармен тотықсыздандыру әдісі?
Жауабы? Металлотермия
12. Шынының формуласы қандай?
Жауабы: Na2O*CaO* 6SiO2 (тақтаға жазу)
13. «Адамзат ашқан алашқы метал - алтын»- деп айтқан неміс ғалымы кім?
Жауабы: К. Маркс
14. Металдарды алудың жалпы әдістері нешеге бөлінеді, және оларды ата?
Жауабы: пирометаллургиялық, гидрометаллургиялық
ІІІ. Жаңа сабақ.
Сабақтың жоспары:
1 - бөлім Қайталау - оқу анасы
2 - бөлім Білгенге - маржан
3 - бөлім Ізденген жетер мұратқа
Сабақ жоспары түсіндірілгеннен кейін әр топтың алдына үлестірме тапсырмалар тапсырылады.
1 – бөлім. Қайталау – оқу анасы.
I топ тапсырмасы:
8 сыныптағы «Д. И. Менделеевтің заңы мен жүйесі» тақырыбынан алған теориялық білімдеріңізге сүйеніп, кальций элементіне сипаттама беріңіздер. (Периодтық жүйе пайдаланылады)
II топ тапсырмасы:
Кальцийдің химиялық қасиеттерін сипаттайтын мына рекция теңдеулерін аяқтаңыздар.
1. Са+Cl2
2. Са+S
3. Са+Н2
4. Ca+O2
5. Ca+HCl
6. Ca+H2O
III топ тапсырмасы:
Тотығу дәрежесі №2 - ге тең, 8 гр металл сумен реакцияласқанда 4, 48л сутегі (қ. ж.) бөлінді. Металдың Аr анықтап, оны атаңыз.
Шығарылуы: Ме + 2Н2 О → Ме(ОН)2 + Н2↑
8/4, 48=х/22, 4
х =40 г (Са)
Жауабы: Аr = 40 г (Са)
Осы тапсырмалар бойынша әр топ өздерінің білімін ортаға салды, ары қарай мұғалім толықтырды.
2 – бөлім. Білгенге – маржан.
Мұғалім тірек - хабарларын пайдалана отырып кальцийдің адам ағзасы үшін маңызы, кальцийдің табиғатта таралуы, физикалық қасиеттері, химиялық қасиеттері, алынуы, қолданылуы, қосылыстары жайлы әңгімелейді.
Құрамы: Кальций
1808 ж ағылшын ғалымы. Г. Дэви ашты
IV период Са40
II топ негізгі топша
2е 8е 8е 2е
Маңызы:
Адам ағзасы – 1кг
Орта есеппен күніне – 0, 5 гр
Са2+ ----------------- қан ұю
Са3(РО4) 2 -------- сүйек, тіс, бауыр, бүйрек, жүрек
Тағамдар --------- сүт, сүзбе, сыр, жұмыртқа
Әктас қалай пайда болды?
Бор - мұхит пен теңіздерде тіршілік ететін ұсақ ағзалардың қабыршақтары мен қаңқаларынан пайда болады. Олардың әктен түзелген қаңқаларынан теңіз, мұхиттарда, су астында үйінді пайда болады. Қаңқалар үйіндісінен жартас - риф және шеңберлі жартас - атолл түзіледі. Әк алуға көбінесе рифтегі көп қармалауышты маржандардың қаңқалары пайдаланады. Бор бор дәуірінде түзілген, тау жер бетінде тұтас жота болып көтерілген.
Табиғаттағы айналымы.
Калиций карбонатының гидрокорбанатқа және керісінше айналу реакциясы.
Жаңбыр және басқа табиғи сулар ауадағы көмірқышқыл газын ерітіп, көмірқышқылын түзеді:
Н2 О + СО2 → Н2 СО3
Са(НСО) 3 → Н2 СО3 ↓ + Н2О + СО2↑
ІҮ. Жаңа сабақты бекіту.
Үш топқа тапсырма берілді.
1-топ: Оқушылық деңгей.
2 - тапсырма:
Кальцийдің өздеріңіз білетін, күнделікті өмірде кездестіріп жүрген қандай қосылыстарын білесіздер?
3 - тапсырма.
Егер қышқылдың шығымы 80% болса, онда 31т кальций ортофосфатынан қанша ортофосфор қышқылын алуға болады?
Шешуі: 31 Х
Ca3(PO4) 2+3H2SO4=3CaSO4+2H3PO4
310г/моль 98г/моль
31 X
310 196 X=196*31/310=19. 6
Егер қышқылдың шығымы 80% болса
19. 6 100%
X 80% X=19. 6*80/100=15. 68т.
2 топ: Эвристикалық деңгей.
2 - тапсырма.
Мына айналуларды жүзеге асырыңыздар:
СаО → Са(ОН) 2 → СаСО3 → Са(НСО3) 2 → Ca(ClO) 2
3 - тапсырма
Таза кальций карбонатының 50кг массасын қақтағанда оның массасы 4. 4 г кемиді. Кальций карбонатының қанша проценті ыдырайды?
Шешуі:
X 4. 4
CaCO3 = CaO+CO2
100 г/моль 44г/моль
100 44
X 4. 4 X=100*4. 4/44=10кг CaCO3
Енді ыдыраған кальций карбонатының массалық үлесін есептейміз.
W=10/50=0. 2 немесе 20%
3 топ: Шығармашылық деңгей
2 - тапсырма
Реакциялардың иондық теңдеулерін құрыңыздар:
1. Са(ОН) 2 → СаСО3
2. СаСО3 → Са(НСО3) 2
3. Са(НСО3) 2 → СаСО3
3 - тапсырма «Мен кіммін?»
Бер.: Шешуі:
W (Cu) = 40% Са: C: O = 40/40: 12/12: 16/48 = 1: 1: 3
W (C) = 12% Жауабы: СаСО3
W (O) = 48%
T/k: CaxCyOz -?
Ү. Үй тапсырмасы.
3 бөлім. Ізденген жетер мұратқа.
Үйге тапсырманы дифференциалдап беру.
1 топқа: Кальций және оның қосылыстары тақырыбын оқу, тірек хабарларды пайдалана отырып, реакция теңдеулерін жаза білу
2 топқа: Оқулықтағы №6, №7 жаттығу (137 - бет)
3 топқа: Ізденіп шығармашылықпен жұмыс істеу:
«Менің өлкемнің байлығы» тақырыбына реферат жазу.
ІҮ. Қорытынды жасау. Бағалау. Сабаққа қатысқан оқушылардың белсенділігін бағалау. Сыныппен қоштасу.
Сабақтың тақырыбы: Су таңғажайып зат
Сабақтың мақсаты:
Білімділік - Оқушыларға судың химиялық қасиеттерін,табиғаттағы айналымын,судың тіршілік үшін маңызын түсіндіру,реакция теңдеулерін сауатты жазуға үйрету.
Дамытушылық -Ойын элеметтерін қолдану арқылы баланың ойлау
қабілетін, ой-өрісін дамыту,қосымша әдебиеттермен жұмыс.
Тәрбиелік - Табиғат байлығын қорғауға, туған жерге деген сүйіспеншілікке баули отырып,экологиялық тәрбие беру.
Сабақтың түрі: Қорытынды сабақ, топпен,жеке
Сабақтың әдісі: Шығармашылық тапсырма, ойын, сұрақ-жауап, зертханалық жұмыс, жұмбақтар, мақал-мәтелдер, тыйым сөздер
Сабақтың көрнекілігі: Периодтық жүйе,таратпа қағаздар, салыстыру картасы, слайдтар,жұмбақтар.
Сабақтың пәнаралық байланысы: Биология, география, математика,
қазақ әдебиеті.
Сабақтың барысы: 1) Ұйымдастыру кезеңі
2) «Кім білімпаз?» сайысы
3) «Кім жылдам?»
4) «Кім жүйрік?»
5) «Кім математик?»
6) Зертханалық тәжірибе
7) Үшіншісі артық
8) Халықтық педагогика (тиым сөздер,мақал-мәтел,
жұмбақтар)
9) Судың қолданылуы
10) «Керуеншілер» ойыны
11) «Ізденген жетер мұратқа»
12) Бағалау
Ұйымдастыру кезеңі
Оқушыларды түгелдеу, назарын сабаққа аудару, 3 топқа бөлу. «Н», «О», «Н2О»
“Кім білімпаз?” сайысы
Судың химиялық қасиеті?
Судың физикалық қасиеті қандай?
Мұз неліктен суға батпайды?
Табиғатта су неше агрегаттық күйде болады?
Жердің су қабаты.
Су электр тогын қай кезде жақсы,қай кезде нашар өткізеді?
Суды зарарсыздандыру үшін 1 тонна суға қанша хлор қажет?
Жанбайтын қандай затты сумен сөндіреді?
Судың химиялық қасиеті?
Судың физикалық қасиеті қандай?
Мұз неліктен суға батпайды?
Табиғатта су неше агрегаттық күйде болады?
Жердің су қабаты.
Су электр тогын қай кезде жақсы,қай кезде нашар өткізеді?
Суды зарарсыздандыру үшін 1 тонна суға қанша хлор қажет?
Жанбайтын қандай затты сумен сөндіреді?
«Кім жылдам?»
I топ Са—СаО—СаСl2 ----СаSO4
ІІ топ АІ—АІ2О3 –АІРО4 ---Аl2(SO4)3
III топ Мg– MgO– MgSO4--- MgCl2
«Кім жүйрік?»
І топ СаО + Н3РО4..........Н2О
ІІ топ MgО + НCl............. Н2О
ІII топ Fe2О3 + Н2SО4...... Н2О
«Кім математик?».
І топ Массасы 8 г СиО сутекпен тотықсыздандырғанда
қанша грамм су түзілетінін есепте?
ІІ топ Массасы 8г SO2 cумен әрекеттескенде неше
грамм суды қажет етеді?
ІІІ топ Массасы 8г СаО + Н2SO4 әрекеттескенде неше
грамм су түзіледі?
Көрініс көрсетілімі: Еду, еду қашықтан,
Мен – водовоз асыққан.
«Мөлдір су бар, достар-ей,
Кому надо – поскорей»
Зертханалық тәжірибе: №1“Жасырын жазу”.
1.Жайпақ табақшаға жарты пиала 125 мл су құямыз.
2.Оған 10 тамшы йодты тамызып, араластырамыз.
3. Лимонды бөлек ыдыста суын сығамыз.
4. Жайпақ табақшаға еркін сиятындай қағаз дайындаймыз.
5. Жазу жазатын қылқаламды лимон шырынына батырып, қағазға Н2О жазу жазамыз.
6. Қағазды жайпақ табақшадағы йод ерітіндісінде батырамыз.
№2 Ca O + H2O → Ca(OH)2 кальций гидроксиді Сөндірілмеген әк
Реакция кезінде жылу бөлінеді, экзотермиялық реакция .
Техникалық атау.Сөндірілген әк.
Үшіншісі артық

Халықтық педагогика.
Тыйым сөздер:
Суға түкірме,қоқыс тастап, бүлдірме.
Өзің ішетін суға өлген ит тастама.
Су ішкен құдығыңа түкірме.
Судың да сұрауы бар.
Сумен ойнама,батарсың,отпен ойнама,күйерсің.
Көптеп даланы қорлама,
Мол деп суды былғама.
Су туралы мақал-мәтелдер:
1.Су анасы – бұлақ.
2.Сулы жер - нулы жер.
3.Ердің құты-белеңде,
Судың құты тереңде.
4. Ағынды су - бал татыр,
Ақшабағы май татыр.
5.Су дүниенің - басы.
6. Наурызда су болмаса, сәуірде ну болмайды.
7.Су тіршіліктің тірегі.
8.Сулы жер құрақсыз болмас,
таулы жер бұлақсыз болмас.
Су туралы жұмбақтар :
1. Жылт-жылт еткен, жылғадан өткен.
2. Аяғы жоқ жүреді,сылқ-сылқ күледі.
3. Шыдасаң да алты күн ассыз мүлде,
Шыдау қиын бұл затсыз екі күнге.
4. Қаратаудың басында киік кетіп барады,
Қол аяғы бауырына ,тиіп кетіп барады.
5. Көтеріліп теңізден, аспанға биік барамын
Биіктен қайта түскенде,өңі кірер даланың.
6.Отқа жанбас,суға батпас.
7. Бет көретін айнам,тауып алдым сайдан.
8.Кескен боламын кесілмейді,кесілсе де бөлінбейді
Судың қолданылуы:




Керуеншілер" ойыны
Барлық 13 оқушы түйе қимылын көрсетіп, “моф” деген дыбыс шығарып орындарында қимылдап тұрады.
Әрбір оқушы өзінің белгіленген формуласы бойынша сумен реакция теңдеуін жазу керек.
![]()
Үйге: Судың химиялық қасиеті, қолданылуы.“Су - өмір” , “Су - байлық”
Реферат жазу.
Сабақтың тақырыбы: Мыс және оның қосылыстары
Сабақтың мақсаты:
Білімділік: Мыс элементін жан – жақты зерттеу арқылы мыс , оның
қосылыстары,қолданылуы, маңызы жөнінде білімдерін кеңейту.
Дамытушылық: Оқушылардың ойлау, қорытындылау, жүйелеу қабілеттерін дамыту.
Тәрбиелік: Оқушылардың шығармашылық мүмкіндігін дамыту, қабілетін арттыру, қосымша материалдар арқылы эстетикалық тәрбие беру.
Сабақтың түрі: Аралас сабақ
Сабақтың әдісі: Түсіндірме-көрнекілік және диалогтік әдіс, кластер (сын тұрғысынан ойлау), тест, Не?Қайда?Қашан? спорттық жарыс ойыны.
Сабақтың көрнекілігі: 1. Д.И.Менделеевтің периодтық кестесі
2. Ақпараттық технологиялар
3. Тірек-сызбалар
4. Таратпа материалдар
Сабақтың барысы:
І. Ұйымдастыру кезеңі ;
1. Сәлемдесу
2.Топқа бөлу
1 топ – Na 2 топ -K
3 топ –Ca 4 топ- Mg ІІ. Үй тапсырмасын сұрау (10 мин )
Мұғалімнің кіріспе сөзі:
2010 жылы ақпан айында елімізде 7 қысқы азиада ойындары өтті. Азиадаға әлемнің 27 мемлекеті қатысып, Қазақстан жалпы ойындар бойынша 32 алтын ,21 күміс , 17 қола медальмен І орынға шықты. Қысқа азиада ойындарының түрлері бойынша тапсырмалар болады. Азиада ойындарына өз білімдеріміз арқылы үлесімізді қосайық. Алға!
Оқушылардан өткен тақырыпты «Не?Қайда?Қашан?» ойыны арқылы өз білімдерін көрсетеді.
Химия теориясы .(Хоккей)
10. Неше қышқылдың формуласы берілген?(10)
20. Кестеті толтыр.
| Оксид формуласы | Оксид атауы | Сәйкес негіз формуласы | Сәйкес негіз атауы |
| Na2O |
|
|
|
30. Реакция жүретін қатарды табыңдар (екінші қатар )
| H2SO4+Fe(OH)2 | HCl+CaCO3 | NaHSO4+ H2SO4 |
| Zn+H3PO4 | Fe+ H2SO4 | Ca+HCl |
| Al(OH)3+HCl | Cu+ H2SO4 | Fe+HCl |
40. Натрийге жарық түскенде элетрондардың ұшуы қалай аталады ?
(фотоэлектрлік эффект)
50. Дұрыс жауаптардың қосындысы көміртегінің (ІҮ)оксидінің молекулалық массасына тең. (44)
Химия зертханасы (Коньки)
10. NaOН + фенолфталеин → ? (Индикатор таңқурай түске боялады. )
20. Жұмыртқаның сыртын сындырмай қалай аршуға болады?
(Сұйылтылған тұз қышқылы ерітіндісінде еріп кетеді)
30. Платина сымды алақан бойымен жүргізіп , содан кейін жанарғы жалыныны ұстаса нені көруге болады . Неге?
(Жалын сары түске боялады. Тердің ылғал құрамында ас тұзы бар. Натрий иондары жалынды сары түске бояйды. )
40. Магний қосылыстарың қалай анықтауға болады.
(Магний қосылыстары сілті қосқанда ақ қоймалжың тұнба Mg(ОН)2 түзіледі.
Mg2+ +2 ОН- → Mg(ОН)2 ↓ )
50. Лабораторияда көмір қышқыл газын анықтау үшін қандай затты қолданады. (Егер көмір қышқыл газын әк суы арқылы өткізсе, онда ерітінді лайланады.
Химик ғалымдар өмірінен (Шаңғы)
Дмитрий Иванович Менделлев отбасындағы нешінші бала?(17)
20. 1807 ж ағылшын ғалымы Г.Дәви қандай металды таза күйінде алған?
(Натрийді . натрий гидроксидінің балқымасын электролиздеу арқылы.)
30. Өз жерінің қара тасын мақтай білмеген, бөгде жердің алтынын да мақтап жарытпас. Қай ғалымның сөзі?(Қ. Сатпаев)
40.Орыстың қай ғалымы алғаш профессор атағын алды?
( М.В.Ломоносов )
50. Сутегіні ашқан қай ғалым? ( Г. Кавендиш )
Есеп шығару. (Фристайл)
10 92г натрийдің зат мөлшерін есептендер. (4 моль )
20. Массасы 3,9 г Калий тұз қышқылымен әрекеттескенде . Тұзілген тұздың массасын есептендер . m(КСІ)=7,45 г
30. Массасы 9,2 г сілтілік металл йодпен әрекеттескенде массасы60 г осы металдың йодиді түзіледі. Реакция үшін қандай сілтілік металл алынған? (Натрий )
40. Егер суға массасы 9,2 г натрий мен 7,8 г калийден тұратын құйманы салса , қанша көлем сутек бөлінеді? V(Н2) =6,72 л.
50. Құрамында 56 % мырыш 35% мыс бар құймасы артық мөлшерде алынған тұз қышқылына салынды. Реакция аяқталғаннан кейін алынған ерітіндіні суалтады. Қандай тұз түзілді? Оның массасы қандай?
m(ZnСІ2)=7,45 г
Әр түрлі.( Биатлон)
10. Ең жеңіл металлды ата . (литий )
20. Ас содасының формуласы қандай? (NaHСO3)
30. Кермек су деген не? ( Құрамында гидрокарбонаттар бар су. )
40. От көмір жейді…? (Тот темір жейді)
50. Арпа бидай ас екен…? (Алтын , күміс тас екен.)
ІІІ. Жаңа сабақ
1. Қызығушылық ояту . (10 мин )
Мыс тұралы не білеміз деп ойлайсындар?
1. Топтарда жұмыс. 2 мин
2. Тізбек құру. 2 мин
3. Критерияға бөлу 1 мин
.4. Кластер құрастыру 5 мин
2. Мағынаны танып білу. (10 мин )
1. Мыстың периодтық жүйедегі орны.
2. Табиғатта таралуы .
3. Мыстың ашылу тарихи.
4. Мыстың алынуы
5. Физикалық қасиеттері
6. Мыстың химиялық қасиеттері
7. Мыстың қосылыстары
8. Мыстың биологиялық маңызы
9. .Мыстың қолданылуы.
Периодтық жүйедегі орны және атом құрылысы.
Мыс-І Б топ элементі.
Химиялық таңба –Сu
№ -29
Ar(Сu) =63, 546
Электрондық формуласы 1s2 2 s22p6 3s2 3p63d10 4s1
Тотығу дәрежесі: +1, Сu2О ; +2 СuО
тұрақсыз +3 Сu2О3
Табиғатта таралуы
мыстың табиғи минералдары:
СuFe S2 халькопирит (30% Сu)
СuS2 халькозин немесе мыс жылтыры (79,8 % Сu)
СuS ковелин ( 64,4% Сu)
СuСО3 . Сu(ОН)2 малахит (54,4 % Сu)
2СuСО3 . Сu(ОН)2 азурит (55,5 % Сu)
Сu2О куприт (81,8 % Сu)
Табиғатта саф күйінде кездеседі. Өте ірі саф күйінде табылған мыс 420 т болды.
Мыс кендерінің ең үлкен бөлігі Жезқазған маңында, сондай-ақ Павладар, Жамбыл, Шығыс Қазақстан, Ақтөбе облыстарында, Кенді Алтайда.
Балқаш және жезқазған тау-металлургтя комбинатында өндіріледі.
Мыстың ашылу тарихи.
Тас ғасырдан адамның бірінші танысқан металы.
6 мың жыл бұрын Ежелгі Шығыста.
4мың жыл бұрын Еуропада.
Адам құрал жасау үшін алғаш рет саф мысты пайдаланған
Б.з.д ІV мыңжылдықта Египетте Синай түбігінде мыс кендері өңденген.
Кипр аралында белгілі болған
“Купрум ” сөзі мыстың латынша атауы, ежелгі римдіктердің мыс кен орындары болған Кипр аралының атаунын шыққан деген жорамал бар .
Мыстың алынуы
1.Пирометаллургиялық әдіс .
Сu2S + 3О2 → Сu2О + 2S О2
Сu2О + Сu2S →6 Сu + 2S О2
2 Гидрометаллургиялық әдіс.
СuО + Н2SО4 → Сu S О4 +Н2О
СuSО4 + Fe → Сu + Fe S О4
Физикалық қасиеттері
Ашық қызғылт түсті, металдық жылтыры бар,
электр тогы мен жылуды жақсы өткізетін,
жеңіл созылғыш металл.
Тығыздығы 8,9 г/см3 ,
балқу t ═1083 0С .
Мыстың химиялық қасиеттері
Жай заттармен әрекеттесуі
Мыс-галогендермен (кәдімгі температурада йодпен,қалғандарымен қыздырғанда )оңай әрекеттеседі:
Сu0 + СІ2 0→ Сu+2СІ2-1
2Сu0 + О2 0→ 2Сu+2О -1
Сu0 + S 0→ Сu+2S-2
Күрделі заттармен әрекеттесуі
Кернеу қатарында мыс сутектен кейін орналасқан, сондықтан ол қышқылдар тотықтырғыш болса ғана олармен әрекеттеседі.
Сu0 + 2H2S+6O4 → Сu+2S+6O4+ S+4O2↑+ 2H2О
(конц.)
Сu0 + 4HN+5 O3 → Сu+2 (NO3)2+NO2↑+2 H2О
(конц.)
Сu0 + 8HN+5 O3 →3 Сu+2 (NO3)2+2NO↑+4 H2О
(cұйылт.)
2Сu + 4HСІ+О2 → 2СuСІ2+ 2H2О
Сu + АgN O3 → Сu (NO3)2+2Аg
Мыс қосылыстары

Мыстың сапалық реакциялары
1. Мыс және оның ұшқыш қосылыстары жанарғы жалынын көк жасыл түске бояйды.
Мыс тұздары сілтіні қосқанда мыс гидроксидінің көгілдір тұнбасы түзіледі.
Сu2+ + 2ОН - → Сu (ОН)2 ↓
Мыстың биологиялық маңызы
Адам қанында құрамы 0,001 мг/л дейін болады. Мыс біздің организмге тамақ арқылы келеді.
Қан түзу процесіне қатысады, тотығу процесін күшейтеді, ферменттердің құрамына кіреді майлар,гемоглобин синтезін, көмірсу алмасуын қамтамасыз етеді.
Теңіз жануарлардың (былқылдақденелілер, буынаяқтылар )қанында темірдің қызметін атқарады.
Мыс өсімдіктерде фотосинтез процесіне қатысады.
Мыстың қосылыстарының қолданылуы .
Электротехника
Металл өндеу
Машина жасау, химиялық шыны өнеркәсібі.
Гальваностегияда металдарды қаптау
Ауыл шаруашылығында зиянкестермен күресу.
Полиграфия
Баяу жасау.
IV. “Ой толғау” Бекіту (10 мин )
1.Тізбекке қайту, топта жұмыс (2 мин)
2.Критерияға бөлу (1 мин)
3.Кластер толықтыру (2 мин)
ІҮ. Үйге тапсырма: 7.179 бет есеп 5-7 Ү.Бағалау . Топтарды және белсене қатысқан оқушыларды бағалау.
Сабақтың тақырыбы: Сутек-химиялық элемент және жай зат. Сутектің изотоптары.
Сабақтың мақсаты:
Білімділік: Сутектің химиялық элемент және жай зат ретіндегі түсінігін қалыптастыру мақсатында элементті сипаттауға ерекше мән беріп, білімдерін дамыту, табиғатта таралуы және алыну жолының ерекшеліктерін өткен сабақпен байланыстыра отырып түсіндіру.
Дамытушылық: Экзо, эндотермиялық реакцияларды қайталай отырып оқушылардың дұрыс шешім қабылдай білу дағдыларын жетілдіру, белсенділік икем дағдысын қалыптастыру.
Тәрбиелік: Экологиялық тәрбие беру.
Сабақтың түрі: жаңа сабақ
Сабақтың әдіс-тәсілдері: СТО стратегиялары,
Құрал-жабдықтар,көрнекі құралдар:Газ жинайтын құрал (тұрғы,сынауық, спиртшам), Кипп аппараты, мырыш , тұз қышқылы, күкірт қышқылы,кальций,су, периодтық кесте.
Пәнаралық байланыс: әдебиет, тарих
Күтілетін нәтиже: Оқушылар эксперименттік тәжірибелердің орындалуын мұқият қадағалап, қауіпсіздік ережесін еске түсіреді, зертханалық тәжірибелерден қорытынды жасап,реакция теңдеулерін жазып,реакция типтерін ажырата біледі.
САБАҚТЫҢ ЖҮРУ БАРЫСЫ:
І. Ұйымдастыру бөлімі
ІІ. «Қызығушылықты ояту»
1. « Миға шабуыл»
1.Заттар нешеге жіктеледі? Жай және күрделі заттар дегеніміз не?
Химиялық элемент дегеніміз не? Оттек элементіне сипттама беріп көрелік( аты, таңбасы, сал.ат.массасы, молекуласы, сал.мол.массы,валенттілігі, периодтық кестеде орны бар,аллотропиялық түр өзгерісі бар)
3.Химиялық реакцияның неше типі бар? Атаңыз
4.Термохимиялық реакция дегеніміз қандай реакция,ол нешеге жіктеледі?
2. « Семантикалық карта»
|
| Қосылу реакция сы | Айырылу реакция сы | Орын басу реакция сы | Алмасу реакци ясы | Экзо Термия лық реак ция | Эндо Термия лық реак ция |
| Са + О2 = 2СаО | + |
|
|
|
|
|
| Fe + CuCI2 = Cu + FeCI2 |
|
| + |
|
|
|
| CaCO3 = CaO + CO2 - Q |
| + |
|
|
| + |
| HCI + NaOH = NaCI + H2O + Q |
|
|
| + | + |
|
| 2H 2O = 2H2 + O2 - Q |
| + |
|
|
| + |
| 2H2 + O2 = 2H 2O + Q | + |
|
|
| + |
|
ІІІ. «Мағнаны тану»
«Мені тап»
Мен судың арғы тегімін,
Серігімін оттек атты серінің.
Ежелден ең жеңіл газбын,
Оттекке қарағанда азбын.
1 пайыз ғана жер бетіне тарағам,
Ғаламшарда 92 пайызбын.
Бармын газбен көмір,мұнайда,
Болашақта өзім отын бола алам. (Сутек)
Бүгінгі сабақтың тақырыбы (тақтамен, дәптермен жұмыс)
Химиялық таңбасы : Н , Ar ( Н ) = 1,008 м.а.б.
Н2 , Mr (Н2) = 2 м.а.б.
Н2 ↑, и , т, суда АЕ (100Vсуда - 2V Н2 ериді).
Жер бетінде оттекке қарағанда сутек едәуір аз.Ең көп тараған қосылысы- Н2О
Күн жүйесі планеталарының 92%-ін сутек атомы құрады.
Сутектің жер қыртысында газ күйіндегі метанның, қатты тас көмірдің, сұйық күйдегі мұнайдың, көптеген минералдар мен тау жыныстарының құрамында оттекпен қатар сутек те кіреді. Жер қыртысындағы сутектің массалық үлесі 1 %. Ол аз болып көрінгенмен, шындығында жердегі әр 100 атомның, шамамен, 10 атомы сутектің үлесіне келеді.
Сутекті отын ретінде пайдаланған тиімді. Әзірше сутекті көп мөлшерде өндіруге болатын шикізаттар – метан мен суды айыру қымбатқа түсіп отыр. Келешекте автомобильдерді сутек отыны көмегімен жүргізуді дамыту көзделуде.
Жер қыртысындағы сутектің мөлшері:
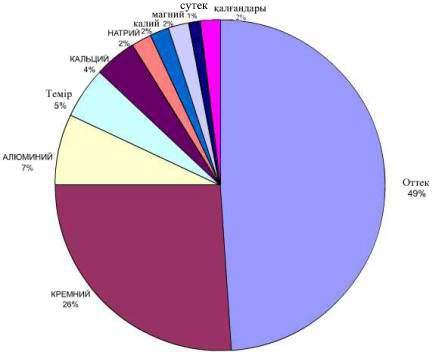
Жер бетінде сутек бос күйінде кездеспейді, көп тараған қосылысы-су. Судағы сутектің массалық үлесі 11 пайыз. Сонымен қатар сутек табиғатта қосылыстар құрамында кездеседі
Сутектің ашылуы
▪Сутекті алғаш ХҮІ ғасырда неміс дәрігері ПАРАЦЕЛЬС ашқан.
▪1776 жылы ағылшын ғалымы Г.Кавендиш сутектің қасиетін анықтап,басқа газдардан айырмашылығын анықтап берген.
▪Француз ғалымы А. Лавуазье сутекті алғаш судың құрамынан бөліп алды және судың құрамы сутек пен оттектен тұратындығын дәлелдеді. Ол сутектің жай зат екенін анықтап, оған “гидрогениум” деп ат берген. Латынша бұл “су тудырушы” дегенді білдіреді.


Генри Кавендиш Антуан Лавуазье
Өнеркәсіпте алынуы:
Жер бетінде су кең тарағандықтан өнеркәсіпте сутекті алудың негізгі әдісі – суды тұрақты электр тогының көмегімен айыру болып табылады.
2H 2O = 2H2 + O2
CH4 + 2H2O = CO2 + 4H2 -165 кДж
Зертханада алынуы:
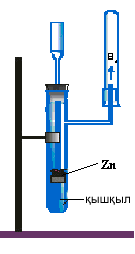
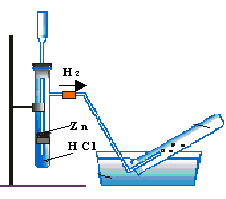
Сынауыққа 1-2 түйір мырыш салып, үстіне сұйытылған тұз немесе күкірт қышқылын құяды. Реакцияның жүре бастағанын сұйықтың бетінде газ көпіршіктерінің пайда болуынан байқауға болады. Ол – сутек газы.
Сутек газының бөлінгенін дәлелдеу үшін сутек жиналған сынауықты жанып тұрған спиртшамға жақындатса «пах» деген дыбыс шығарады.
Zn + H 2SO4 = ZnSO4 + H2 ↑
Zn + 2 HСІ = ZnСІ2 + H2 ↑
Белсенді ме. + қышқыл = тұз + сутек
5. Са + 2 Н2О = Са ( ОН )2 + Н2↑
6. 2Nа + 2 Н2О = 2 Nа ОН + Н2↑
Белсенді ме. + су = металл гидроксиді + сутек
Зертханада сутекті жинау әдістері:
( оттегін жинау әдісімен салыстыру)
Ауаны ығыстыру арқылы Суды ығыстыру арқылы
Сутегін зертханада алуға арналған құрал - Кипп аппараты
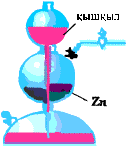
ІҮ. «Ой толғаныс»
Оқулықтың 207 бетіндегі лабораториялық тәжірибе
«Мырышқа қышқылмен әсер етіп сутек газын алу» (дәптерге орындау)
Әр оқушының алдына ойықшалар беріліп ішіне мырыш түйіршіктері салынады. Үстіне (өте сақ болу! ) күкірт немесе тұз қышқылдары тамшуырмен құйылады. Бөлініп жатқан газ көпіршіктерін көзбен көреді.Бөлініп жатқан газды сынауыққа жинап жанып тұрған спиртшамға апарып сутек екендігін дәлелдеу.
А.Тақтадан сәйкес теңдеулерін табады.
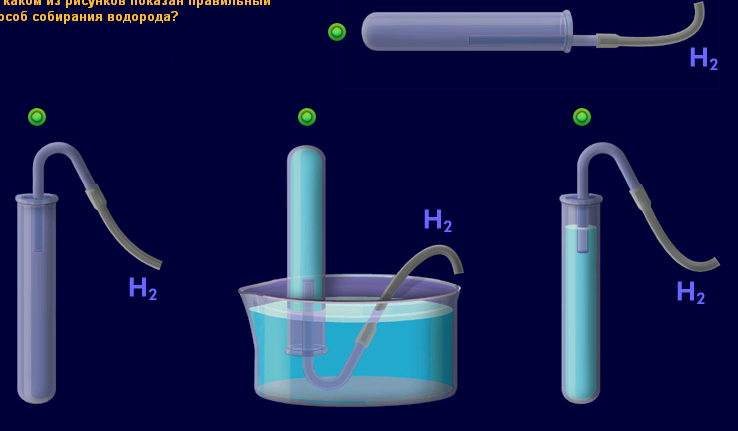
ә. Неге сутекті сынауықты төмен қаратып жинайды?
Б.сутек толған сынауықты жалынға жақындатқанда не байқадыңдар?
В. Сутектің жану теңдеуін жазыңдар.
2H2 + O2 = 2H 2O - Q
2. Төрт шар әртүрлі газдармен толтырылған. Қай шарда сутек газы бар?

3.Қай суретте сутек газын алу әдісі дұрыс берілген?
4. Тест тапсырмалары:
1.Сутектің химиялық таңбасы:
а) Н ә) Не б) Cu в) Si
2.Күн жүйесі планеталарының қанша пайызын сутек атомы құрайды?
а)25% ә)32% б)24% в)92%
3.Сутекті ең алғаш алған ғалым?
а) Ломоносов ә) Менделеев б) Кавендиш в) Лавуазье
4.Сутек латынша қандай мағынаны береді:
а)түтінді газ ә)су тудырушы б)қопарғыш газ в)су тасушы
5.Сутекті өнеркәсіпте алу жолы:
а)Электр тоғы арқылы ә)белсенді металдан
б)ауаны ығыстыру арқылы в)айдау арқылы
Жауаптары:
| 1 | 2 | 3 | 4 | 5 |
| А | В | Б | Ә | А |
Үйге тапсырма: §30 № 1-12
Сабақтың тақырыбы: «Бастапқы химиялық ұғымдар» тақырыбын қорытындылау.
Сабақтың мақсаты: Білімділік: Осы тарау бойынша алған білімдерін тереңдету. Дамытушылық: Химиялық формула, теңдеу құру дағдыларын, есеп шығару химиялық тәжірибе жасау біліктерін дамыту. Осының бәрін атом – молекулалық ілім тұрғысынан дәлелдеу.
Тәрбиелік мақсаты: ғылымға, пәнге қызығуға тәрбиелеу.
Құрал– жабдықтар: тестер, полигот, менделеев кестесі,есептер
.Сабақтың түрі: дәстүрлі емес.
Сабақтың әдіс-тәсілдері:топпен жұмыс, деңгейлік тапсырмалар.
Сабақ барысы: Ұйымдастыру кезеңі. Оқушыларға ойын сабағының жоспары хабарланады. Тақтаға жазылады.
Сабақ девизі: «Пысықтау оқу - анасы».
1.Бақытты сәт – ойыны.
2. Деңгейлік есептер
3. Полиглот – ыдысы.
4.Тестілермен жұмыс.
Оқушыларды 2 ұғымдық топқа бөлетін. Топ басшысы осы ұжымның ұпайын есептеп отырады. Оған кесте алдын ала беріледі.
1-кезең. Сұрақтар (Дұрыс жауап берген оқушыға жетон беріледі)
1 ұжымдық топқа қойылатын сұрақтар.
1.Физикалық денелерді құрайтын нәрсе? (Зат) 2. Құрамына кіретін заттардың бөлшектері микрос коп арқылы да көрінбейтін қоспа қалай аталады? (Біртекті) 3. Шынының балқуы қай құбылысқа жатады? (Физ.) 4. Бөлінбейтін ең кішкентай бөлшектер. (Атомдар) 5. Атомдарының әр түрінен түзілген заттар...(күрделі) 6.Оттектің салыстырмалы атомдық массасы.(16) 7.Мыстың латынша атауы. (купрум) 8. Плюмбум – (қорғасын) 9. О әрпімен белгіленетін элемент.(оттегі) 10.Таңбалар және формулалар арқылы шартты түрде жазылған реакциялар (Химиялық теңдеулер)
2-ұжымдық топқа қойылатын сұрақтар.
1. Заттардың агрегаттық күйлері.(Қатты,сұйық,газ)
2. Құрамына кіретін заттардың бөлшектерін жай көзбен көруге болатын қоспалар қалай аталады?(Әр текті)
3. Темірдің тот басуы қандай құбылысқа жатады?(хим.)
4. Атом-молекулалық ілімді жасаған орыс ғалым.(Ломоносов)
5. «Эн» таңбасы (Азот)
6. Кремнийдің латынша аты?(силициум)
7. Сутегінің таңбасы.(Н)
8. Химиялық теңдеуді теңестіру үшін қойылатын сандар?(Коэфф-р)
9. Феррум...(темір)
10. Азоттың салыстырмалы атомдық массасы.(14)
2-кезең. Деңгейлік есептер шығару.
1.Мына химиялық элементтердің таңбаларын жазыңдар:
Алюминий,кальций,фосфор,кремний, хлор.
2. Валенттіліктері бойынша мына химиялық элементтерден формулалар құрастырыңыздар
NaO, CO, PH, HS, AlO
3.Элементтердің валенттіліктерін ескеріп,мына сызба бойынша реакция теңдеуін құрыңыздар және коэффициентін қойыңыздар.
Al+O2=
Na + Cl2 =
Zn + O2 =
Fe + Cl2 =
3-кезең. Үй тапсырманы тексеру үшін «Полиглот» ойыны ойналады. Сұрақтарда кездесетін элементтер дің атын қазақ, орыс, латын тілінде айту керек. Дұрыс жауапқа 10 ұпай, жартылай 5 ұпай. Қай ұжым дық топ жылдам, білімділігін көрстеді.
1.Сұйық металл (Нg, сынап,ртуть-гидраргирум )
2. Ауаның негізгі құрам бөлігі? (О-оттек-кислород-оксигениум)
3.Қай элементтің жетіспеуі тіс ауруына ұшыратады? (Ғ-фтор-фтор-фторум)
4. Ой және өмір элементі. (Р-фосфор-фосфор-фосфорус)
5. Қай элемент бактериялырды өлтіріп, денсаулығымызды қорғайды?(ll, хлор-хлор-хлорум)
6. Ақыл арымас, алтын шірімес. (Аи-алтын-золото-аурум).
7. Темірді қызған кезінде соқ (Ғе-темір- феррум-железо).
4-кезең.Тестілермен жұмыс.
1.Қайсысы химиялық құбылыс
а) сүттің ашуы ә)қорғасынның балқуы
б)бордың ұнтақталуы
2.Қайсысы айнымалы валенттілік көрсетеді
а) натрий ә)суттегі б) темір
3.Зат мөлшерінің өлшем бірлігі
а) грамм ә) моль б) грамм/моль
4. Судың молярлық массасы нешеге тең
а ) 16г/моль ә ) 17г/моль б ) 18г/моль
5. SO2 затындағы күкірттің массасы
а) 32 б) 64 б)50
Жауабы:
1 2 3 4 5
а б ә б а
5- кезең. Қарапайым тәжірибе « Жанбайтын орамал»
Екі ұжымдық топқа тест кітапшасы бойынша деңгейлік тапсырма беріледі.Екі ұжымдық топ бір-бірін тексереді. 9 жұмыс. (тест) 1-2-3 деңгейде орындау Хим. фор-лар бой. есептеулер. Сабақ соңында топ басшылары ұпай санын санап, оқушыларды бағалайды. Қай топтың білімі басым болғанын анықтау. Сабақты қорытындылау.
| Оқушылардың аты жөні | 1 кезең | 2 кезең | 3 кезең | 4 кезең | 5 кезең | Қорытынды ұпай саны |
| 1. 2. |
|
|
|
|
|
|
Үйге тапсырма: Қайталау.
Сабақтың тақырыбы: Азот қышқылы және оның тұздары.
Сабақтың мақсаты: Азот қышқылының негіздік қасиеттері мен күшті тотықтырғыш ретінде металдармен әрекеттесуін оқып-үйрену. азот қышқылы және оның тұздары нитраттардың қасиеттерін, қолданылуын қарастыру, оқушылардың еске сақтау қабілеттерін дамыту. Нитраттардың айырылу реакциясында шығатын өнімдер металдың белсенділігіне байланысты екендігін түсіндіру.
Құралдар мен реактивтер: HNO3(конц.), мыс сым, HNO3, NaOH, Na2CO3, фенолфталеин ерітінділері, қатты мыс (II) оксиді, сынауықтар.
Сабақтың барысы. I. Жаңа сабақты қабылдауға дайындық.
Үй тапсырмасын сұрақ-жауап әдісі арқылы тексерген жөн.
1.Аммиактың химиялық қасиеттеріне мысалдар келтіру.
2.Аммоний тұздарына мысалдар келтіріп, оның қандай ерекше қассиеті бар екенін айтып беріңдер.
3.Жұмыс дәптерінен 57-, 58- тапсырмалар.
D4. Оқулықтан §16. 5-7-жаттығулар орындаңдар.
II. Жаңа сабақты оқып-үйрену.
Электрондық формуласы Молекулалық формуласы HNO3
:O
:
H :O: N
:
:O
Құрылымдық формуласы 
O
//
H ─ O ─ N
\\
O
Ж., з., ρ = 1,51 г/см3, tбқ = - 420С, tқн = 860С
НNO3 (конц., түтінденетін)
ω = 1, сары
НNO3 (сұйыт. түтінбейтін)
ω = 0,6 түссіз
Концентрлі азот қышқылымен жұмыс істеу ережесі
Резина қолғаптармен жұмыс істеу!
Оттан аулақ тұру!
Қышқыл теріге тигенде тез арада судың көп мөлшерімен жуу керек!
«Азот қышқылы сипаттамалары бойынша басқа қышқылдарға қарағанда өте күшті және өзіне сенімді. Сыртқы күйінен бұл байқалмайды.»
Басқа қышқылдармен ортақ қасиеттері:
НNO3 à H+ + NO3-
НNO3 + лакмус күлгін = ![]()
НNO3 + метилді қызыл сары = ![]()
Негіздік оксидтермен
CuO + 2HNO3 = Cu(NO3)2 + H2O
CuO + 2H+ + 2NO3- = Cu2++ 2NO3-+ H2O
CuO + 2H+ = Cu2+ + H2O
Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
Cu(OH)2 + 2H++ 2NO 3- = Cu2+ + 2NO3- + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
Еритін негіздермен:
NaOH + HNO3 = NaNO3+ H2O
Na+ + OH - + H+ + NO 3- = Na+ + NO3- + H2O
OH - + H+ = H2O
Тұздармен (әлсіз қышқылдардың):
Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O
2Na+ + CO32 - + 2H+ + 2NO3- = 2Na ++ 2NO3-+ CO2 ↑ + H2O
CO32- + 2H+ = CO2 ↑ + H2O
Неміс химигі, дәрігері
ГЛАУБЕР Иоганн Рудольф
(1604-1670) таза азот
қышқылын 1650 жылы алды.
Алынуы
![]()
Конц. күкірт қышқылымен
натрий нитратына (Өндірісте)
( Зертхана)
NaNO 3 + H2 SO4 = NaHSO4 + HNO3
Азот қышқылын өндірісте алу жолы
Азот қышқылын бірізді алу сызбасы:

2. Химиялық реакциялар:
4NH3 + 5О2 = 4NO + 6Н2О + Q
2NO + O2 = 2NO2 + Q
NO2 + H2O = 2HNO3 + NO↑ + Q
![]()
Минералды
тыңайтқыштар
 Жарылғыш Ракеталық заттар отын
Жарылғыш Ракеталық заттар отын
HNO3
Дәрілер Пластмассалар
Концентрациялы азот қышқылы көптеген бейметалдарды олардың өзіне сәйкес қышқылдарына дейін тотықтырады. Ал концентрациялы және сұйылтылған азот қышқылының металдармен әрекеттесу ерекшелігін айтқанда сутек бөлінбейтінін ескертеді. Азот қышқылы химия өнеркәсібінде көп қолданылатын маңызды өнімнің бірі. Шамамен азот қышқылының 75%-і минералды тыңайтқыштар өндірісіне, 15%-і қопарылғыш заттар алуға және 10%-і басқа мақсатқа жұмсалады.
Азот қышқылының тұздарын нитраттар деп атайды. Нитраттар қатты кристалды заттар, бәрі дерлік суда жақсы ериді. Азот қышқылының негіздік оксидтермен, негіздермен әрекеттесу реакция теңдеуін жаздыру арқылы мұғалім нитраттарды алу жолына тоқталады. Есептер жинағынан сәйкес тапсырмаларды оқушылармен бірге талдауға болады.
Басқа оттекті қышқыл тұздарына қарағанда нитраттардың айырылуы ерекше. Бұл тұздарды қыздырғанда реакция оттек О2 бөле жүретіні баса айтылуы тиіс. Оқулықтағы кейбір нитраттардың айырылу мысалына сүйене отырып, қосымша реакция теңдеулерін жазғаызған жөн. Мысалы, калий нитраты, мырыш нитраты, күміс (I) нитратының айырылу реакциясының теңдеулерін жазыңдар.
Азоттың табиғаттағы айналымын оқулықпен жұмыс істеу немес қосымша тапсырмалар беру арқылы оқушылардың өздеріне орындатқан дұрыс.
III. Алған білімді қорытындылап бекіту. Бекіту сұрақтары арқылы сабақ қорытындыланады.
1.Концентрациялы күкірт қышқылы мен азот қышқылына салыстырмалы сипаттама беріңдер.
2.Азот қышқылы HNO3күшті тотықтырғыш болғандықтан металдармен әрекеттескенде шығатын өнімдер оның концентрациясына, металдың белсенділігіне, температураға тәуелді болады. Осыған мысалдар келтіріңдер.
3.Концентрациялы азот қышқылы HNO3, әдетте, Al, Fe,Cr, Ni, Au, т.б. метадарға әсер етпейді. Мысалдар келтіріңдер.
Сұйылтылған азот қышқылының HNO3 металдармен (Fe,Cr,Ni) әрекеттескенде шығатын өнімдері азоттың N+4, N+2, N+1, N-3 тотығу дәрежелерін көрсетеді. Азот қышқылы жарықтың әсерінен азот (IV) оксидіне суға және оттекке ыдырайтынына мысалдар келтіріңдер.
Сендер мына тұжырымдамалармен келісесіңдер ме:
1. Азот қышқылы күшті тотықтырғыш болып саналады.
2. Азот қышқылы еритін негіздермен ғана әрекеттеседі.
3. Азот қышқылы жарықта ыдырайды.
4. Азот қышқылының тұздарын нитриттер деп атайды.
5. Азот қышқылы металдардың электрохимиялық қатарында сутегіне дейінгі металдармен әрекеттеседі.
6. Азот қышқылы алюминийді пассивтейді.
7. Азот қышқылы өндірісте аммиактан алады.
8. Азот қышқылы металдармен әрекеттескенде сутегі бөлінбейді.
Өзіңді тексер!
1. Иә 
2. Жоқ
3. Иә
4. Жоқ
5. Жоқ
6. Иә
7. Иә
8. Иә
Үйге тапсырма. Есептер жинағынан тапсырмалар.
Сабақтың тақырыбы: Кремний және оның қосылыстары
Сабақтың мақсаты: Сабақта химиялық элементтердің периодтық жүйесінде кремнийдің орналасуын атом құрылысы тұрғысынан сипаттап, оның қасиеттері жайлы білімді дамыту. Оксидтері мен силикаттарының табиғатта таралуы туралы мағлұмат беру. Оқыта-үйрету ойын әдісімен оқушылардың өз бетінше жұмыс жасауын, бірін-бірі тыңдауға, пікір айту дағдыларын дамыту.
Сабақтың түрі:Аралас сабақ
Сабақтың типі:жаңа материалды меңгерту
Сабақтың әдісі: Түсіндіру,сұрақ-жауап,тапсырмалар,есептер шығару,сауалнама жұмысы
Көрнекіліктер: Периодтық жүйе, сауалнама, карточкалар, сызбанұсқалар
Сабақтың барысы. I. Жаңа сабақты қабылдауға дайындық. Сыныптағы оқушыларға «Көміртек және оның қосылыстары» туралы оқулықты, анықтамалықтарды, тағы басқа әдебиеттерді пайдаланып, 10 сұрақ даярлап келуге тапсырма беріледі. Бұдан оқушылардың шығармашылық қабілеті дамып, білім деңгейі жоғарылайды.
Үйге берілген тапсырма:
1.Көміртектің периодтық жүйедегі орны
2.Көміртектің атом құрылысы
3.Көміртектің қандай қосылыстары бар?
4.Көміртегі оксидтерінің физикалық,химиялық
қасиеттері
5.Көмір қышқылының құрылымдық формуласы
6.Судағы ерітіндісінде көмір қышқылының
сатылап диссоциациялануы
Сауалнама
1.Көміртегі қай топта ,қай топшада орналасқан?
а)IV топ, негізгі топша ; в)Vтоп,негізгі топша; с)IVтоп,қосымша топша;
2.Көміртек металдармен әрекеттескенде түзілетін зат:
а)нитридтер; в)карбидтер; с)сульфидтер;
3.Көміртегінің тотығу дәрежелері:
а)-4,+2,+4; в)-2,+4,-4; с)-3,+3,-1;
4.Көміртектің аллотропиялық түрөзгерісі:
а)кристалды; в)аморфты; с)алмаз;
5.Көміртекті ашқан француз ғалымы:
а)И.Берцелиус; в)Х.Бранд; с)А.Лавуазье;
6.Көміртек толық жанбағанда қандай зат түзіледі?
а)көміртек монооксиді; в)көміртек диоксиді;
с)көмір қышқылы;
7.Көміртектің салыстырмалы атомдық массасы:
а)24; в)12; с)6:
8.Кальций карбонатының молярлық массасы:
а)100г/моль; в)68г/моль; с)75г/моль;
9.1 моль газ қанша көлем алады?
а)1л; в)10л; с)22,4л;
10.Көміртегі диоксиді қандай оксидке жатады?
а)негіздік; в)қышқылдық; с)екідайлы;
II. Жаңа сабақты оқып-үйрену.


![]()

Табиғатта Химиялық тотығу периодтық
кездесуі таңбасы дәрежесі жүйедегі
орны

 Si
Si
Қосылыстары қолданылуы физикалық химиялық алынуы
қасиеті қасиеті
Кремнезем

 Химиялық SiО2 Физикалық
Химиялық SiО2 Физикалық
қасиеті қасиеті
Табиғатта
кездесуі


 Силикат өнеркәсібі
Силикат өнеркәсібі
Қыш, керамика, Шыны Құрылыс
фарфор өндірісі материалы
кварцты түрлі-түсті
 Шыны қиын
Шыны қиын
 талшық Шыны балқитын
талшық Шыны балқитын
терезе хрусталь
шынысы
III. Алған білімді бекіту.
1. Кремнийдің кристалдық торы не себепті берік болады?
2. Кремнийдің физикалық қасиеттерін сипаттаңдар.
3. Табиғатта креммнийдің көп таралуының себебі неде?
4. Оқулықты пайдаланып, кремнийдің және оның қосылыстарының қолданылуын айтып беріңдер.
5. Айналымдарды іске асыруға болатын реакция теңдеулерін жазыңдар.
SiO2→Si→SiH4→SiO2→Na2SiO3
Пысықтау сұрақтары:
1.Кремний және кремний диоксидінің табиғатта таралуы.
2.Кремний және кремний диоксидінің физикалық қасиеттері.
3.Кремний және кремний диоксидінің химиялық қасиеттері.
4.Кремний және кремний диоксидін қайда қолданылады?
Үйге тапсырма: Мына генетикалық байланысты жүзеге асырыңыз:
Si→SiO2 →H2SiO3 →Na2SiO3
Сабақтың тақырыбы: Бейметалдардың жалпы сипаттамасы
Сабақтың мақсаты:
Білімділік. Бейметалдардың периодтық жүйедегі орны және электрондық құрылысы, физикалық қасиеттері, бейметалдар мен металдардың және олардың қосылыстарының Қазақстанның аймақтарында таралуы туралы білімдерін бекіту.
Дамытушылық: Бейметалдардың алу әдістері туралы білімдерін тереңдету. Элемент,жай және күрделі заттар туралы білімдерін кеңейту. Оқушылардың ғылыми дүниетанымын қалыптастыру
Тәрбиелік: Ұйымшылдыққа, ізденімпаздыққа тәрбиелеу.
Сабақтың барысы:
Белгілі 109 элементтің 22-сі бейметалдарға жатады. Бейметалдар топырақ массасының 84%-ін, өсімдік массасының 98,5% -ін,және адам денесі массасының 97,5%-ін құрайды.
Көміртек, сутек,азот, фосфор,күкірт органогенді элементтер болып табылады.Өйткені олар белок, май, көмірсулар және нуклейін қышқылдары молекулаларының құрамына
кіреді.Біз демалатын ауа бейметалдардан түзілетін жай заттардың қоспасы болып табылады
Бейметалдардың периодтық кестеде орналасуы
|
| I | II | III | IV | V | VI | VII | VIII |
| 1 | H |
|
|
|
|
|
| He |
| 2 |
|
| B | C | N | O | F | Ne |
| 3 |
|
|
| Si | P | S | CI | Ar |
| 4 |
|
|
|
| As | Se | Br | Kr |
| 5 |
|
|
|
|
| Te | I | Xe |
| 6 |
|
|
|
|
|
| At | Rn |
| 7 |
|
|
|
|
|
|
|
|
Элементтер-бейметалдар қалыпты жағдайда әр түрлі агрегаттық күйде болатын жай заттарды түзеді.He, Ne, Ar, Kr, Xe, Rn,H2, O2, N2, F2, CI2-газдар, Br2-сұйық , ал қалғандары –қатты заттар.
Білімділік:2 ұпай Тест тапсырмалары
1.Мына элементтердің арасынан S-элементтерді көрсетіңіздер.
А) Si Б) P С) C Д)H
2. Д.И.Менделеевтің периодтық жүйесінде қанша бейметалл орналасқан?
А)87 Б)22 С)56 Д)35
3.Мына бейметалдардың арасындағы сұйық затты табыңыздар?
А) Ar Б) CI С) Br Д) S
4.Мына қосылыстардың қайсысында азот -4 тотығу дәрежесін көрсетеді?
А) HNO3 Б)NO2 С)NO Д)NaNO3
5.Мына қосылыстардың арасынан қатты затты көрсетіңіз?
А)C Б) Xe С) F Д)N
Түсіну 4 ұпай
|
| II-топ 1.C + O2 2.Zn + S
|
Пайдалану 6 ұпай Қызықты сандар
0
22,4
29
6,02.10-23
109
22
Талдау айналымдарды жүзеге асыру 5 ұпай
Күрделі есеп шығару 10 ұпай
II-есеп
1.Массасы 1кг кремний алу үшін құрамында 10% бөгде қоспалары бар қанша кварц құм қажет? Реакцияның шығымы 80%
хг 1000г
Берілгені. SiO2+C=Si+2CO
60г 28г
m (Si)=1кг 1000г
W (қоспа)=10% х= 60г . 1000г =2143г
W=80% 28г
Ал бөтен қоспасы бар массасы.
2183г – 90% x=2380г
X – 100%
Егер шығымнын 80 екенін ескерсек
2380г – 100% х=2380г . 80 =1904(SiO2)
Хг – 80% 100%
2.Массасы 3,68г алюминий мен мыстың құймасын тұз қышқылының артық мөлшерімен өңдегенде 1,77л (қ.ж)сутек алынады .Құймадағы металдың массалық үлесін есептеңдер.
Берілгені:
m(AI+Cu)=3,68г Шешуі:
xг 1.77л
2AI+6НCI= AICI3+3Н2
54г 6,72л
X= 54г.1.77л\6,72л=1,42г
v(Н2)=1,77л
Т.К w(Ae)-?
W(cu)-?
M(Cu)=m(құйма)-m(AI)=3,68-1,42=2,26
W(Cu)= 2,26\3,68.100%=61,4%
W(AI)=1,42\3,68.100%=38,6%
Бағалау.
Үйге тапсырма беру.
Сабақтың тақырыбы: Натрий, қасиеттері, алынуы, қолданылуы
Сабақтың мақсаты:
Білімділік: Оқушыларға натрий, қасиеттері, алынуы, қолданылуы,
қосылыстары туралы жалпы түсініктер беріп, күшті
тотықсыздандырғыштар, қасиеттерін ажырата білу, алыну
жолы, маңызын түсіндіру, мағлұматтар беру
Дамытушылық: Оқушылардың химиялық білімін одан әрі дамыту, тез
ойлауға, шапшаңдыққа, өз бетімен ізденуге үйрету, ой-
өрісін, шығармашылық мүмкіндігін, ғылыми көз-қарасын
қалыптастыру.
Тәрбиелік: Натрийдің өнеркәсіпте күнделікті тұрмыста қолданылуы, алған білім дағдыларын өмірде пайдалану, өздігінен талпынып, жауапкершілікті сезінетін, өнегелі ұрпақ тәрбиелеу.
Сабақтың түрі: Дәстүрлі сабақ
Сабақтың типі: Аралас сабақ
Сабақтың әдісі: Сұрақ –жауап, практикалық тәжірибе, ойындар, есептер т.б.
Көрнекілігі: Үлестірмелі қағаздар, тәжірибеге қажетті құрал жабдықтар, жаттығу есептері.
Сабақтың барысы: І. Ұйымдастыру кезеңі
ІІ. Үй тапсырмасын тексеру: Қызығушылықты ояту үшін сұрақ –жауап интерактивті тақтадан Д.И.Менделеевтің периодтық таблицасы көрсетіліп сұрақтар койылады.
- Сілтілік металдар қай топта орналасқан?
- Сілтілік металдарды ата?
- Қандай топшада орналасқан?
- Валенттілігі нешеге тең?
- Электртерістілігі қандай?
- Тотығу дәрежесі қанша?
- Ядро заряды +11 ге тең қай элемент?
III. Жаңа сабақты түсіндіру:
Оқушылар тақырыпты дәптерлеріне жазады. Қызығуды ояту.
№1 Тәжірибе:
Натрийдің сумен әрекеттесуі. Метал натрийді пышақпен кесіп алып, суға салып жібереміз, сол кезде натрий судың бетінде жүгіре жөнеледі. Осы тәжірибені қызықтаған оқушылар мына жұмбақты шешеді.
Ақ түйір айналады, тыным таппай,
Жүргендей су бетінде орын жоқтай.
Сәлден соң суға сүңгіп жоқ болады,
Не түзілді қай элемент кім айтады? (Натрий гидрооксиді)
Тақтада сұрақ-жауап түрінде сызбанұсқа құралады.
1.Тірек сызба
Металл күйдегі натрий гидрооксидінің балқымасын электролиздеу арқылы бөліп алды. Қосылыстардың балқымасын электр тогымен ыдыратып алады
3.Тірек сызба.Физикалық қасиеттері:
Оқушыларға натриймен жұмыс істегенде қауіпсіздік техникасының ережелерін сақтау қажет екенін түсіндіремін.
1. 4Naº+O2 º →2Na2+¹O-²
2. 2Na+S→Na2S
3. 2Na+2H2O→2NaOH+H2
Натрий иондары жалынды сары түске бояйды, ол үшін платина сымын алақанға салып ұстап, содан соң спирт шамының жалынына ұстаса жалын сары түске боялады. Неге? (себебі, адам терлегенде алақанда ас тұзы болады.)
Сілтілік MeO күшті негіздік қасиет көрсететін ақ түсті зат.
Na2O +2H2O =2NaOH
Олар теріні, матаны,
қағазды жеп жібереді.
5.Тірек сызба. Табиғатта кездесуі.
Ашылу тарихы.
Натрий “натрон”, “сода”, “сілті”, деген араб сөздерінен шыққан. Натрийдің көмір қышқыл тұзы өте ерте кезден-ақ кір жууға пайдаланған. Сол кезде оның гидрат тотығыда белгілі болған оны сілті деп атаған.
6.Тірек сызба. Қолданылуы:
Алғаш натрийді күшті тотықсыздандырғыш ретінде алюминий өндіруге пайдаланды. Сол кезде алюминий алтыннанда қымбат болды. Қазір натрийді таза алтын алуға қолданады.
IV. Жаңа сабақты бекіту:
Ой толғаныс:
Диктант.
Ия, Жоқ
1. 1807 жылы ағылшын ғалымы Дэви алды (ия)
2. I-ші топтың қосымша топшасында (жок)
3. Сілтілік метал (ия)
4. Тотығу дәрежесі +1 (ия)
5. Ас тұзының минералын галит деп атайды (ия)
6. Натрий қан плазмасында кездеседі (ия)
7. Натрий қатты металл (жоқ)
8. Электр тогын өткізеді (ия)
9. Ядролық реакторларда жылу тасымалдағыш (ия)
10. Су бетінде жүгіреді (ия)
11. Инертті газдармен әрекеттеседі (жоқ)
12. Бейметалдармен әрекеттеседі (ия)
13. Натрий ионы жалынды сары түске бояйды (ия)
14. Натрий судан ауыр (жок)
Есептер шығару
1.Натрий қатыса жүретін реакция теңдеулерін жазып, реакция нәтижесінде түзілген заттарды атаңыздар. (хлор, су, тұз қышқылы, оттек, сутек, азот,)
2.Натрий хлоридінің NaCl, сильвиниттің NaCl*KCl, натрий нитратының NaNO3, мирабилиттің Na2SO4*10H2O құрамындағынатрийдің массалық үлесін есептеңіздер.
V. Үйге тапсырма § 6.4 №1 – 7
VI. Бағалау
Сабақтың тақырыбы: Жану және баяу тотығу. Оксидтер
Сабақтың мақсаты: Оттек мысалында химиялық элементтің қасиеттерін оқып –үйрену. Жану процесінің мағынасы, мәні жайлы оқушылар көзқарастарын дамыту.Оксидтердің күрделі зат екеніне көңіл аудару. Олардың аталуы мен формуласын құруды есте сақтау. Химиялық заттарды класқа жіктеуді жетілдіру
Күтілетін нәтиже: Оттек мысалында химиялық элементтің қасиеттерін оқып –үйренеді. Жану процесінің мағынасы, мәні жайлы оқушылар көзқарастары дамиды.Оксидтердің күрделі зат екеніне көңіл аударып, олардың аталуы мен формуласын құрып есте сақтайды Химиялық заттарды класқа жіктеуді одан әрі жетілдіреді
Сабақтың түрі: Аралас сабақ
Сабақтың өткізу әдісі: әңгімелесу, сыни тұрғыдан ойлау элементтері, жеке, жұппен, топпен жұмыс,
Ұйымдастыру кезеңі
1Амандасу, түгендеу
2.психологиялық ахуал
3.Топқа бөлу
Сабақтың барысы: Үй тапсырмасын тексеру.(Жеке жұмыс)
1. Оттекке жай зат ретінде жалпы сипаттама беріңдер
1.Химиялық формуласы
2.Салыстырмалы молекулалық массасы
3.Табиғатта кездесуі
4.Физикалық қасиеттері
2.Реакция теңдеулерін аяқтаңдар:
1.Mg + O2 =
2. Na + O2 =
3. Ca + O2 =
4.K + O2 =
5.C2H4 + O2 =
Жаңа сабақ І. «Оттегі»
1-тапсырма. Топтық жұмыс.
Жаңа мәтінді жеке , одан барып, жұппен оқып, одан кейін топта талқылайды. (Жигсо әдісі)
2-тапсырма. Жұппен жұмыс жаңа сабақтан бірі-біріне сұрақтар қою. Өзара бағалау.
Білімді қорытындылау Жеке тапсырма. Оксидтерінің формулаларын құрыңдар:
1.S (VI) ________
2.Ba (II) _________
3.AI (III) _________
4.Li (I) ___________
5.N(V) ___________
1-тапсырма. Топтық жұмыс.
Оксидтердің алыну реакцияларының теңдеулерін жазыңдар:
1.Темір (ІІІ) _______________
2.Калий ________________
3.Мыс (ІІ) ________________
4.Натрий ________________
3-тапсырма. Сол жақ бағаннан формулалардың, ал оң жақ бағаннан берілген оксидтердің атауларын тауып, жұптастырып жазыңдар
1.P2O5 а) күкірт (ІҮ) оксиді ______________
2.CO2 ә) фосфор (Ү) оксиді ______________
3.SO2 б) кальций оксиді _______________
4.K2O в) көміртек (ІҮ) оксиді _____________
5.CaO г)калий оксиді _____________
Бағалау Формативті бағалау. Кері байланыс
Үйге 62- бетте 8,9 жаттығуларды орындау
14,15 суреттер салу
Рефлексия
Подтверждение авторства
Пожалуйста, введите ваш Email.
Если вы хотите увидеть все свои работы, то вам необходимо войти или зарегистрироваться
Полезное для учителя
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт

















