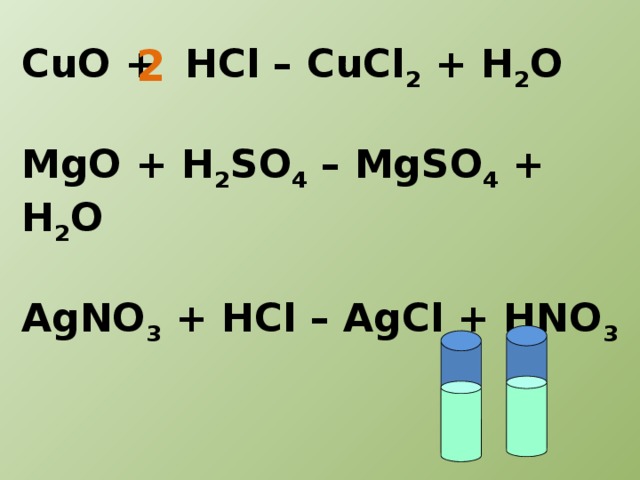Конспект урока
Подготовила
учитель химии
МКОУ «Скороднянская СОШ»
Яковлева Н.И.
Предмет: Химия
Класс: 8
Автор УМК: Габриелян.О.С.
Тема урока: "Типы химических реакций. Реакции обмена."
Тип урока: комбинированный
Цели урока:
Образовательная- актуализация знаний обучающихся о типах химических реакций, классификации веществ, номенклатуре основных классов неорганических соединений, введение понятия о реакциях обмена, их значимости в повседневной жизни человека.
Развивающая – развитие научного мышления обучающихся через установление причинно-следственных связей, умений анализировать результаты наблюдаемых опытов.
Воспитательные -формирование исследовательской компетенции обучающихся при изучении типов химических реакций.
Задачи:
1) обобщить и систематизировать знания о типах химических реакций, закрепить умения составлять уравнения химических реакций и расставлять коэффициенты в уравнениях химических реакций.
2) сформировать комплекс общеучебных познавательных умений - логически мыслить, анализировать, сравнивать, обобщать, делать выводы, аргументировать и отстаивать свою точку зрения.
3)совершенствовать коммуникативные и организационные умения (правильное использование химической терминологии и символики, потребности вести диалог, выслушивать оппонента, способности открыто выражать и аргументированно отстаивать свою точку зрения).
Место урока в школьном курсе: урок изучается в разделе «Изменения, происходящие с веществами», является последним из типов химических реакций, изучаемых в этом разделе.
Планируемые результаты:
урок должен помочь обучающимся 8 класса сформировать следующие универсальные учебные действия:
1)Личностные УУД: определиться в выборе индивидуальных образовательных потребностей; научиться общаться со сверстниками, отстаивать свою точку зрения в процессе беседы, показывать свою убежденность в вопросах значения химических знаний в повседневной жизни; оценивать жизненные ситуации и поступки с точки зрения общечеловеческих норм.
2)Регулятивные УУД: организовывать свое рабочее место под руководством учителя; определять цель и составлять план выполнения задания; развивать практические навыки и умения при решении повседневных проблем связанных с химией.
3)Познавательные УУД: научиться выполнять творческие задания для самостоятельного получения и применения знаний; устанавливать причинно-следственные связи; выдвигать гипотезы и обосновывать их; формулировать проблемы.
4)Коммуникативные УУД: участвовать в диалоге на уроке и в жизненных ситуациях; сотрудничать с одноклассниками в поиске и сборе информации; принимать решения и реализовывать их; точно выражать свои мысли.
Форма учебного процесса: классный урок.
Тип урока: комбинированный.
Оборудование: мультимедийный проектор, электронная презентация, экран, карточки с заданиями, демонстрационное оборудование (штатив с порбирками, пробиркодержатель, растворы соляной кислоты, гидроксида натрия, сульфат меди, карбонат кальция, индикатор)
Хронометраж урока:
Организационный момент ……………………………… 1 мин.
Актуализация опорных знаний …………………………10 мин.
Мотивация учебной деятельности …………………….5 мин.
Изучение нового материала …………………………….. 15 мин. (физкультминутка)
Первичное закрепление знаний ………………………… 10 мин.
Рефлексия ………………………………………………….2 мин.
Подведение итогов урока.
Информация о домашнем задании …………………….. 2 мин.
Ход урока.
I. Организационный момент.(1 мин)
Приветствие.(слайд 2)
Мы – умные, мы – дружные,
Мы – внимательные, мы – старательные,
Мы отлично учимся, всё у нас получится!
II.Актуализация опорных знаний (10 мин)
1.Вставьте пропущенное слово (слайд 3)
Реакции, в результате которых сложное вещество разлагается на несколько других, более простых веществ называются реакциями ….
Реакции между простым и сложным веществом, в результате которых атомы простого вещества замещают атомы одного из элементов сложного вещества, называются реакциями ….
Реакции, в которых из нескольких простых или сложных веществ образуется одно более сложное вещество, называются реакциями….
2.Соотнесите типы химических реакций и схемы реакций:(слайд 4)
| 1 вариант | 2 вариант |
| 1. соединения | А. Fe + O2 → FeO | 1. соединения | А. CuO + Al → Al2O3 + Cu |
| 2. разложения | Б. PbCl2 + Zn→ Pb + ZnCl2 | 2. разложения | Б. N2 + O2 → NO |
| 3. замещения | В. Fe + HCl → FeCl2 + H2 | 3. замещения | В. MgCO3 → MgO + CO2 |
| | Г. H2O → H2 + O2 | | Г. Li + N2 → Li3N |
| | Д. SO2 + H2O → H2SO3 | | Д. Zn + HCl → ZnCl2 + H2 |
| | Е. KNO3 → KNO2 + O2 | | Е. Al(OH)3 →Al2O3 + H2O |
Напишите уравнения реакций и расставьте коэффициенты.
3.Запишите уравнения следующих реакций (слайд 5)
Хлорид меди(II) + алюминий→хлорид алюминия +медь
Кальций + кислород→ оксид кальция
Гидроксид алюминия → оксид алюминия + вода
Расставьте коэффициенты
III. Мотивация учебной деятельности (слайд 6)
1) 2HgO = 2Hg + O2
2) CaCO3 = CaO + CO2
3) CuSO4 + Fe = Cu + FeSO4
4) CuO + H2 = Cu + H2O
5) 2H2 + O2 = 2H2O
6) H2SO4 + 2KOH = K2SO4 + 2H2O
7) BaO + SO2 = BaSO3
Определите тип химических реакций, уравнения которых здесь записаны. Все ли вы реакции смогли отнести к какому –либо типу.
Какое уравнение осталось?
Обратили вы внимание на состав веществ?
Что происходит во втором случае? (обмен составными частями)
Совершенно верно происходит обмен.
Сформулируйте тему урока?
Записать тему урока в тетради. (слайд 1)
IV. Изучение нового материала.
Попробуйте сформулировать определение реакций обмена? Если вы испытываете затруднения, обратитесь к тексту параграфа 32 на с. 165.
(записать в тетрадь) (слайд 8-10)
Проведём с вами небольшой эксперимент.
А теперь уберем учебники и тетради на край стола, пододвинем лотки с реактивами и выполним аналогичный опыт на местах.
Но сначала мы вспомним правила техники безопасности.(слайд 7)
Не спеши хватать пробирку,
А инструкцию читай.
Убедись, что ты все понял,
Вот тогда и начинай.
Это, друг, химкабинет,
Для еды условий нет.
Пусть в пробирке пахнет воблой,
В колбе — будто мармелад.
Вещества на вкус не пробуй!
Сладко пахнет даже яд.
Всякое в опыте может случиться,
Внимательным будь и не оплошай.
Тебе всегда поможет учитель,
Паники только не допускай!
Лабораторный опыт №1 «Взаимодействие соляной кислоты с карбонатом кальция».
К какому классу соединений относится кабонат кальция?
Назвать признак химической реакции? (выделение пузырьков газа). Какой это газ?
Записать уравнение химической реакции (1 обучающийся у доски, остальные в тетради).
Как мы обозначим выделение газа?
Лабораторный опыт №2 «Взаимодействие раствора гидроксида натрия с сульфатом меди».
Каким был раствор сульфата меди? Что произошло после того, как добавили раствор гидроксида натрия
Расставьте коэффициенты в уравнении химической реакции, назовите образовавшиеся соединения:
CuSO4 + NaOH → Cu(OH)2↓ + Na2SO4
По какому признаку вы определили, что протекает химическая реакция?(образовался осадок голубого цвета)
Записать уравнение химической реакции на доске.
Лабораторный опыт №3
Взаимодействие соляной кислоты с раствором гидроксида натрия в присутствии индикатора – фенолфталеина.
ИНДИКАТОРЫ (от лат. indicator – указатель) – вещества, позволяющие следить за составом среды или за протеканием химической реакции.
Какие изменения мы видим? Как изменилась среда раствора?
HCl+NaOH→NaCl + H2O
Подведем итог: в каких случаях химические реакции идут до конца?
Физкультминутка (слайд 12)
Если выделится газ-
Это раз;
И получится вода -
Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок", - говорим мы.
Это третий важный пункт.
Химик "правила обмена"
Не забудет никогда:
В результате - непременно
Будет газ или вода,
Выпадет осадок –
Вот тогда порядок!
Давайте подумаем!!! Где в быту мы встречаемся с реакциями обмена?
(Демонстрационный опыт:Взаимодействие уксусной кислоты и гидрокарбоната натрия)
Разрыхлители теста.
Определение качества воды.
Устранение жесткости воды.
Определение качества продуктов питания.
Определение массовой доли уксусной кислоты в ее растворе.(слайд)
И это далеко не полный перечень областей применения реакций обмена. Сделаем вывод: жизнь современного человека немыслима без реакций обмена!
V. Закрепление изученного материала.
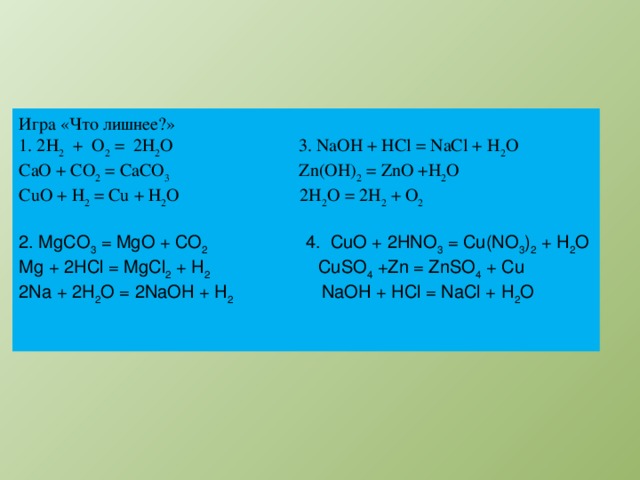
1.Игра «Что лишнее?» (слайд 13)
1. 2Н2 + О2 = 2Н2О 3. NaOH + HCl = NaCl + H2O
СаО + СО2 = СаСО3 Zn(OH)2 = ZnO +H2O
СuО + Н2 = Cu + Н2О 2H2O = 2H2 + O2
2. MgCO3 = MgO + CO2 4. CuO + 2HNO3 = Cu(NO3)2 + H2O
Mg + 2HCl = MgCl2 + H2 CuSO4 +Zn = ZnSO4 + Cu
2Na + 2H2O = 2NaOH + H2 NaOH + HCl = NaCl + H2O
2.Выполните задание. (Взаимопроверка по заготовленному шаблону)
Задание на «3» «Синяя снежинка». Расставьте коэффициенты в уравнениях химических реакций, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) Al + Cr2O3 — Al2O3 + Cr | |
| б) Li + N2 — Li3N | |
| в) K2S + CuCl2 — CuS + KCl | |
| г) N2O — N2 + O2 | |
Задание на «4» «Голубая снежинка». Допишите уравнения реакций, расставьте коэффициенты, укажите типы химических реакций.
| Уравнение реакции | Тип химической реакции |
| а) Ca + Cl2 — .......... | |
| б) HNO3 + Cu(OH) 2 — .......... | |
| в) Mg + FeCl3 — .......... | |
| г) NaCl — .................. | |
Задание на «5» «Белая снежинка». Допишите практически осуществимые уравнения реакций, расставьте коэффициенты, укажите типы химических реакций
| Уравнение реакции | Тип химической реакции |
| а) Mg + O2 — .......... | |
| б) Fe3O4 + Al — .......... | |
| в) H3PO4 + HCl — .......... | |
| г) Ba(OH)2 + H2SO4 — .......... | |
| д) H2O — ............... | |
3.Задание «Крестики-нолики». За 30 с необходимо найти выигрышный путь, состоящий из уравнений реакций замещения (слайд 14)
| Fe2O3 + 3H2 = 3H2O + 2Fe | 4NO2 + 2H2O + O2 = 4HNO3 | 4AgNO3 = 2Ag2O + 4NO2 + O2 |
| Cl2 + 2KI = 2KCl + I2 | Na2SO4 + BaCl2 = BaSO4 + 2NaCl | 2Zn + O2 = 2ZnO |
| 2Al + 6HCl = 2AlCl3 + 3H2 | Cu(OH)2 = CuO + H2O | 2HCl + Zn = ZnCl2 + H2 |
4.«Письмо»
Учитель. Ребята, пока мы работали на уроке, нам по химической почте пришло видеописьмо. Давайте узнаем, что в нем.
Это письмо от одного из персонажей пьесы Н.В. Гоголя «Ревизор», от Аммоса Федоровича Ляпкина-Тяпкина. Все знают этого судью, но не все знают, что он очень увлекается химией. Вот что он сообщает.
| «Многоуважаемые коллеги-химики 8-го класса! Недавно я познакомился с одним из типов химических реакций – реакциями обмена. Несмотря на мои обширные познания в области химических наук, у меня возникла проблема – в моем распоряжении есть следующие реактивы: растворы серной кислоты, соляной кислоты, карбоната натрия, хлорида алюминия, гидроксида натрия. Все эти вещества сложные и, следовательно, они должны вступать в реакции обмена, но на практике оказалось, что не все они между собой взаимодействуют или… взаимодействуют, но я ничего не наблюдал. Почему? Чего я не учел? Помогите мне, пожалуйста, разрешить эту проблему. Буду вам премного благодарен. Искренне ваш коллега – судья А.Ф. Ляпкин-Тяпкин.
Р. S. Вместе с письмом высылаю вам все перечисленные реактивы». |
5.Задача (если позволяет время)
В результате реакции обмена получили гидроксид меди(II) массой 48 г. Какому количеству вещества соответствует такая масса гидроксида меди?
6.Проверочная работа. (Работа в парах с последующей взаимопроверкой по шаблону. )
1 вариант
Расставьте коэффициенты и определите тип реакции в следующих уравнениях реакций:
А) Cu + O2 =
Б) NaOH + HNO3 =
В) H2 + CuO =
Г) Ag2O =
Д) MgO + HF =
Приведены схемы реакций. Составьте уравнения химических реакций, расставьте коэффициенты и укажите их тип:
а) нитрат серебра + хлорид железа (III) → хлорид серебра + нитрат железа (III);
б) гидроксид свинца (II) → оксид свинца (II) + вода.
Выберите на ваш взгляд, правильный ответ.
В реакциях обмена могут образоваться:
а) несколько простых веществ;
б) два сложных вещества;
в) одно сложное вещество;
г) одно простое вещество.
Итоги урока: сегодня на уроке мы с вами изучили новый тип реакции – реакции обмена.
Провели лабораторную работу.
Сформулировали правило, согласно которому протекают реакции обмена между растворами веществ.
VI.Рефлексия
Дети, подведите итоги сегодняшней работы, начните словами: «Я сегодня на уроке узнал…» или «Я сегодня научился…»
Домашнее задание (слайд 15)
обязательное: прочитать §32, задание № 1 на стр. 167;
дополнительное: задание № 2 на стр. 168;
творческое: подготовить сообщение или презентацию на тему «Реакции обмена в быту».
Сейчас прозвенит долгожданный звонок.
Увы, но к концу подошел наш урок.
Прошу, уберите рабочее место.
Давайте без слов, и пожалуй, без жестов.
А я благодарность вам всем объявляю,
Проверив работы, в журнал выставляю
Отметки все ваши, надеюсь привычно
Что будут они «хорошо» и «отлично»
Большое спасибо я вам говорю
Мы цели достигли. Благодарю!
Литература:
Габриелян О.С. химия 8 класс. – М.: Дрофа, 2012.
Габриелян О.С., Березкин П.Н., Ушакова А.А. химия. 8 класс: контрольные и проверочные работы к учебнику Габриелян О.С., химия 8 класс. – М.: Дрофа, 2009 .
Габриелян О.С., Воскобойников Н.П., Яшукова А.В. химия 8 класс. Настольная книга учителя. – М.: Дрофа, 2007 .
12





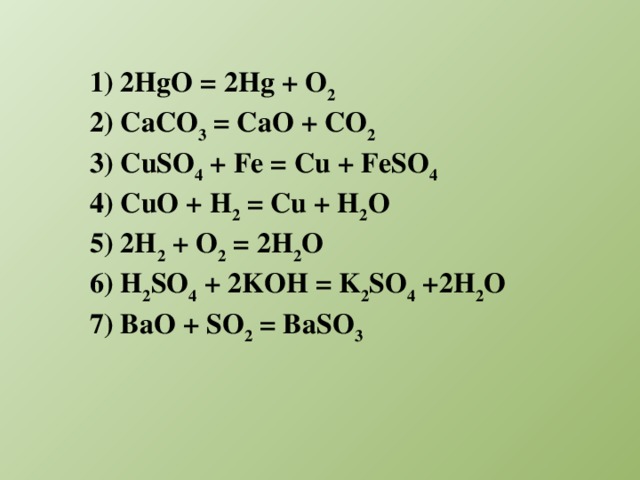


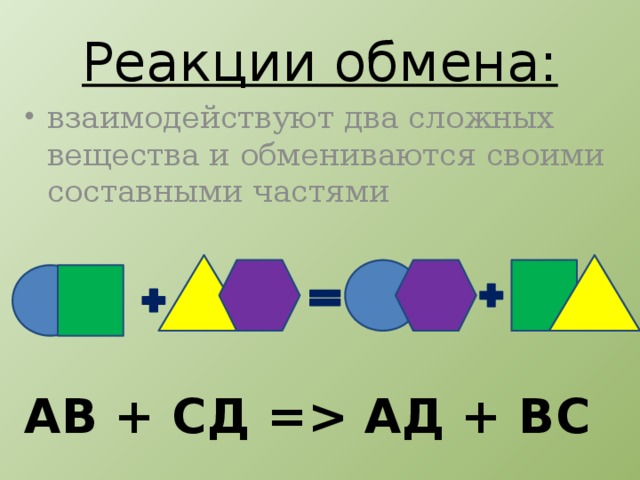 АД + ВС" width="640"
АД + ВС" width="640"