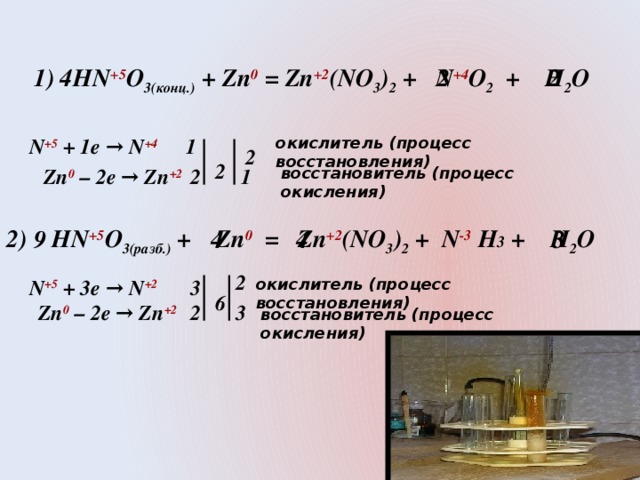
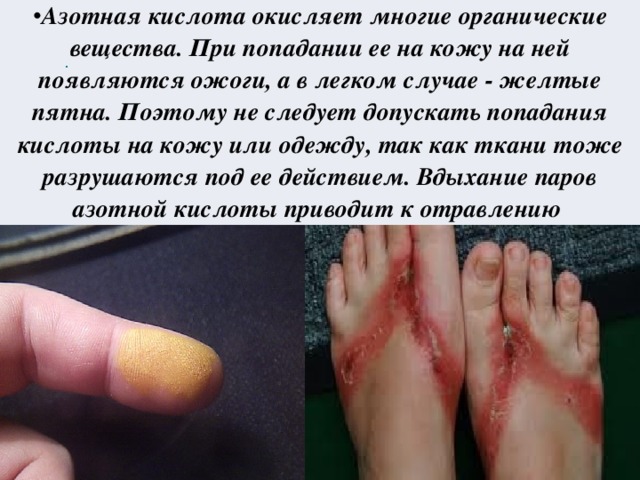
Урок химии в 9 классе. «Окислительные свойства азотной кислоты». Цель урока: Познакомиться с особыми свойствами азотной кислоты как окислителя. Задачи: обучающие: рассмотреть окислительные свойства азотной кислоты, отметить ее особенности взаимодействия с металлами и неметаллами. Уравнивать окислительно-восстановительные реакции с участием азотной кислоты методом электронного баланса; развивающие: продолжить развитие логического мышления, умений наблюдать, анализировать и сравнивать, находить причинно-следственные связи, делать выводы, работать с алгоритмами, формировать интерес к предмету; воспитательные: формировать научное мировоззрение учащихся; научить слушать учителя и своих одноклассников, быть внимательным к себе и окружающим, вести беседу. Тип урока: изучение новой темы
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Конспект урока химии с презентацией "Окислительные свойства азотной кислоты" 9 класс.
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«План конспкт урока»
Просмотр содержимого презентации
«Окислительные свойства азотной кислоты»
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1990 руб.
2840 руб.
1930 руб.
2760 руб.
2200 руб.
3140 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства


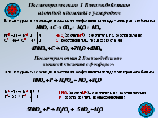
 (слай 7)
(слай 7)








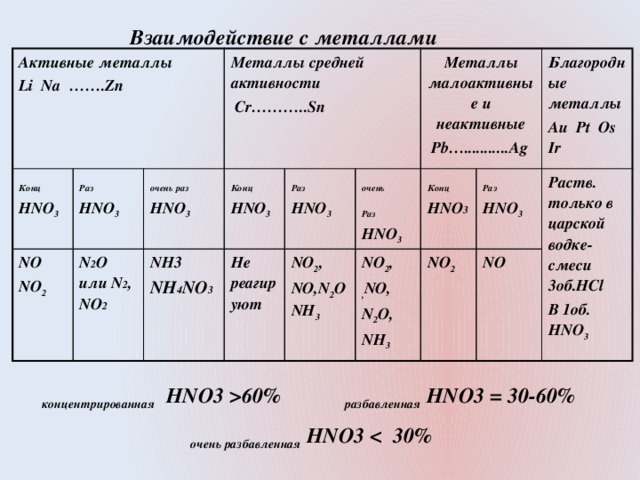 60% разбавленная HNO3 = 30-60% очень разбавленная HNO3" width="640"
60% разбавленная HNO3 = 30-60% очень разбавленная HNO3" width="640"