Сыныбы:
10
Пәні:
Химия
Күні:
23.11.2016 ж
Сабақтың тақырыбы
Ерітінділер мен балқымалардың электролизі
Мақсаты
Электролиз туралы толық мағлұмат беру, электролиздеу теңдеулерін жазып және есептеулер барысында қолдана білуге үйрету, сапалық реакцияларын мультимедиалық көрсетілім арқылы таныстыру, маңызы мен қолданылу салаларын өмірмен байланыстыра отырып түсіндіру
Күтілетін нәтижелер
Электролиз туралы теориялық мәліметті біледі, электролиздік теңдеулерді жаза алады, электролиздік теңдеуді есептеулер кезінде қолданады, Сапалық тәжірибелерін жүргізеді, маңызы мен қолданылуын өмірмен байланыстыра алады.
Керекті жабдықтар
периодтық кесте, ерігіштік кесте, виртуалды зертхана, бейне көрсетілім, постерлер, бояулар,
Қолданылатын әдіс-тәсілдер:
Топтық, жұптық, жеке жұмыс, диологтық әдіс, зертханалық жұмыс, көрнекілік әдіс, формативтік бағалау,
Сабақтың барысы
Кезең
Мұғалімнің іс-әрекеті
Оқушының іс-әрекеті
Кіріспе:
3 мин
Оқушылармен сәлемдесу, сынып оқушыларын түгендеп, сыныптың, оқушылардың сабаққа даярлығын қадағалайды, көңіл-күйлерін сұрау, Сыныптағы психологиялық ахуалды көтеру үшін оқушыларға қолпаштау сөз айтудан бастау, топқа бөлу:
Сабақ жоспарымен, бағалау парағымен таныстырып өтеді. Қажетті құрал – жабдықтарды таратуға нұсқау береді.
Мұғаліммен сәлемдеседі, сабаққа қажетті оқу – құралдарын шығарады. Кезекші сыныптың сабаққа даярлығы мен қатысын баяндайды. Бар зейіндерін сабаққа аудара отырып, мұғалімді тыңдайды. Мұғалімнің нұсқауы бойынша топқа бөлінеді (3 топ).
Топ мүшелері қызметтерін бөліседі. Сабақ жоспарын тыңдай отырып, уақытқа сай бірлесіп жұмыс жасауға кіріседі. Топ басшысы бағалау парағын алып, топ мүшелерін тіркейді және бағалау парағына сәйкес топ мүшелерін бағалауға кіріседі. Топ басшысы топ мүшелерінің міндеттерін бөліп береді.
Үй тапсырмасын тексеру
12 мин
І.Миға шабул (Үй тапсырмасын еске түсіру):
а)Әр топқа жеке –жеке сұрақтар қойылады.
І топқа:
1. Тотығу қандай процес?
2. Тотығу дәрежесі дегеніміз не ?
3. Қандай заттардың тотығу дәрежесі нөлге тең?
4. Сілтілік металдарға қандай тотығу дәрежесі тең ?
ІІ топқа:
1. Тотықсыздану қандай процес?
2. Хлор атомның ең жоғарғы тотығу дәрежесі қаншаға тең?
3. Валенттілік дегеніміз не ?
4. Тотықтырғыш қандай қандай қасиет көрсетеді?
ІІІ топқа:
- Электртерістілік дегеніміз не
- Сутек атомның тотығу дәрежесі қаншаға тең
3. Тотықсыздандырғыш қандай қасиет көрсетеді?
4. Сілтілік жер металдарға қандай тотығу дәрежесі тең
ә) Мұғалімнің әрекеті. Оқушылардың жауаптарын тыңдай жүріп, жұмыс дәптерлеріндегі үй тапсырмасы есептердің шығарылуын тексереді.
Үй тапсырмасын қайталайды. Тақырып және класс аралық сұрақтарға жауап береді. Топ басшысы топ мүшелерінің жауаптарын бағалау парағына түсіріп отырады.
Тексерту үшін жұмыс дәптерлерін дайындап қояды.
Негізгі бөлім
6 мин.
4 мин.
ІІ.Жаңа сабақ: «Ерітінділер мен балқымалардың электролизі» тақырыбы бойынша жаңа материалды өз беттерімен меңгеру үшін әр топқа жеке – жеке тапсырмалар беріледі:
І топқа электролиздің мәні.
ІІ топқа: катодта жүретін процесс.
ІІІ. Топқа:анодта жүретін процесс.
Оқушылар постерді таныстырып болғаннан кейін осы тақырып бойынша слайд арқылы ас тұзы ерітіндісінің электролиздену процесін таныстырамын
электролиздің қолданылуы бойыннша оқушыларға қысқаша түсінідіремін
2H2O+2e= H2+2OH-
2H2O-4e=O2+4H+
Меn+ → Ме0
H2O= H++OH-
Жаңа тақырыпты дәптерлеріне жазып алады.
Әр топ өздеріне берілген тапсырманы жекелей оқиды. Одан жұппен, сосын топта талқылайды, ортақ шешім шығара. Постерді 2 оқушы немесе топ мүшелері түгелдей шығып қорғайды. Қарсы топтың жұмыстарын «Екі жұлдыз, бір тілек» әдісі бойынша бағалайды.
Мұғалімді тыңдай отырып, сызбаларды дәптерлеріне жазып алады,
Зерттеу бөлімі
10 мин.
Мыс хлориді, мыс сульфаты, калий иодиді, натрий сульфатының ерітінділерін электролиздеу.
(тәжірибе виртуалды зертхана арқылы орындалады)
Оқушылар тәжірибені жасайды, пайда болған құбылыстарды бақылайды, тұз ертітінділерінің электролиздену теңдеулерін жазады.
CuCl2 ерітіндісінің электролизі
Диссоциация: CuCl2 = Cu2+ + 2Cl-
Катод: Сu2+ + 2e = Cu
Анод: 2Сl- 2e = Cl2
жалпы: CuCl2 = Cu + Cl2
CuSO4 ерітіндісінің электролизі
Диссоциация: CuSO4 ↔ Cu2+ + SO42-
Катод: Cu2+ + 2e = Cu0 2
Анод: 2Н2О – 4е = О2 + 4Н+ 1
электролиз:
2CuSO4 + 2Н2О = 2Cu0 + О2 + 2H2SO4
KI ерітіндісінің электролизі
Диссоциация: KI = K+ + I-
Катод: 2Н2О + 2е = Н2 + 2ОН-
Анод: 2l- 2e = l2
Жалпы: KI + 2H2O = H2 + I2 + KOH
5-6 мин
Білімді бекіту жұмысы. «Дәрігер» әдісі.
Балалар, өтілген тақырыптарды кім жақсы түсіндім,жақсы меңгердім деп ойлайды? Сол оқушы бүгін сабағымызда Дәрігер-емдеуші ретінде сұрақтарымызға жауап беріп, білімімізді толықтыруға, бекітуге көмектеседі.
Ортаға ынта білдірген оқушы шығады.Дәрігер-оқушыға сыныптағы оқушылар өздері білгісі келген сұрақтарды қояды.
Жауаптарына қарай ортаға шыққан дәрігер-оқушыларға қолдау көрсету.
3минут
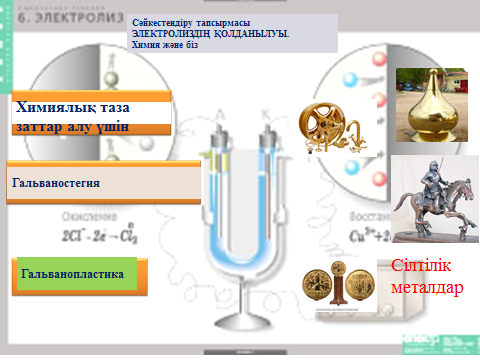
Cәйкестендіру тапсырмалары
Әр топ оқушылар «Электролиздің қолданылуы» (Химия және біз) химиядан таза зат алу үшін, гальваностегия, гальванопластика бөлімдеріне сай күнделікті айналамызда көріп жүрген заттарды сәйкестендіру тапсырмасын орындайды.
Жұмыстарына кері байланыс беру.
Әр топ мүшелері өз мүмкіндіктеріне қарай тапсырмаларды орындайды. Электролиздің қолданылуын түсінеді.
Сәйкесінше бағалау парақтарына ұпайларын түсіріп отырады.
Есеп шығару
CuSO4 ерітіндісінің электролиздеген кезде анодта 44,8л газ бөлінеді, анодтта қанша грам метал бөлінеді?
Оқушылар есепті шығарады, электролиз теңдеуін түсінеді, қанша грам метал алынғанын есептейді.
Есеп шығаруды бағалау критерилері бойынша өзін-өзі бағалайды.
Үй тапсырмасы
1 мин.
ʂ3.3 (1-5) сұрақтармен жаттығулар, есептер шығару.
Эссе « Ерітінділермен балқымалардың электролизі Қазақстан эконмикасына пайдалы деп ойлайсыз ба?»
Рефлекция
1 мин.
Берілген тапсырмалармен жұмыстарды талдау
Тақырып бойынша ой қорытындылау
Рефлекция парағын толтырады
Бағалау парағы оқушының аты- жөні ----
Миға шабуыл
Топтық жұмыс
Зертеу бөлімі
Cәйкестендіру
Есеп шығару
Жалпы баға
Бағалау критерйлері
«5»- барлық сұрақтар ға дүрыс жауап берсе
«4»- Бір сұраққа дұрыс жауап бере алмаса
«3»- үш сұраққа дұрыс жауап бере алмаса
«2» тапсырма орындалмаса
Топ басшысы бағалайды
«5»- барлық электролиз теңдеуі дұрыс жазды
«4»- Бір электролиз теңдеуі дұрыс
болмаса
«3»- екі электролиз теңдеуі дұрыс болмаса
«2» тапсырма орындалмаса
«5»- барлығы дұрыс сәйкестендірілді
«4»- Біреуі дұрыс сәйкестендірілмеді
«3»- екеуі дұрыс сәйкестендірілмеді
«2» тапсырма орындалмаса
-Есептің шарты жазылса -1 ұпай
-электролиз теңдеуін жазыу-1- ұпай
- электролиз теңдеуі теңестірілді – 1 ұпай
Теңдеу бойынша пропортция құрып шығарды-1 есептің нақты жауабы шықса -1 ұпай
Баға
Рефлекция
Білемін
Білдім
Білгім келеді
Көксу ауданы
Н.Алдабергенов атындағы орта мектеп
Арахат Асила
Химия пәні мұғалімі