| Білімділік міндеттері: -оқушылардың өтілген материалды қабылдау ,есте сақтауын қамтамасыз ету; -нақты қорытындылауға ,жүйелеуге әкелетін әдістермен тәсілдерді меңгеруіне жағдай туғызу; - оқушыларды өтілген материалды қайта жаңғыртып, еске түсіру әдістерімен қамтамасыз ету; -түсініктер,заңдар,ережелерді философиялық тұрғыдан түсінуге ,талдауға көмек ету; -оқушылардың оқу материалын өз әдіс -тәсілдерімен бетінше қабылдауын қамтамасыз Мұғалімнің толықтыруы Берілген тақырыпты кітаппен өз бетінше оқу - 2.2 ( 49-53) жоспар бойынша: 1. Элементтердің радиоактивтілігі . 2.Бөлшектердің - шашырауы 3. Атом құрылысының ядролық моделі . 4. Атом құрылысының протонды-нейтрондық теориясы. 5.Изотоптар. 6. Ядролық реакциялар. 7. Радиоактивті элементтер. 8.Қорытынды. ==1. Білімнің дамуының жаңа кезеңі периодтық заңның ашылуымен басталды-атом құрылысын зерттеу кезеңі басталды.Бұл өзара байланыс табиғатын терең түсіндіруге элементтердің бір-бірінен айырмашылығын,ПЗ заңдылықтарын түсіндіруге мүмкіндік берді.19ғасырдың соңында атом құрылысының күрделі екендігі ,олардың бір-біріне айналуы туралы бірқатар дәләлдер анықталды: ==1. 20ғасырда ғалымдар атом ядродан және оның төңірегін айналып үнемі қозғалыста болатын электроннан тұратынын анықтады.Атом құрылысының теориясы ұсынылды. А) 1897 жылы Д.Томсон электронды ашты; Б) Француз ғалымы Беккерелль радиоактивтілікті ашты. В) Ерлі –зайыпты Кюрилер және Резерфорда радиоактивтілік сәуле шығарудың біркелкі еместігін зерттеді ( магнит өрісінде ол үшке айырылады,біреуінде заряд болмайтын сәуле- сәуле, ал қалған екі сәуле қарама қарсы зарядталған .(- )сәулелер электрон ағынына тура келді,- сәулелер (+2) зарядты гелий атомы болады. Химиялық элементтердің қасиеттері не үшін атомдық массаларына периодты түрде тәуелді? Білімнің дамуының жаңа кезеңі периодтық заңның ашылуымен басталды-атом құрылысын зерттеу кезеңі басталды.Бұл өзара байланыс табиғатын терең түсіндіруге элементтердің бір-бірінен айырмашылығын,ПЗ заңдылықтарын түсіндіруге мүмкіндік берді.19ғасырдың соңында атом құрылысының күрделі екендігі ,олардың бір-біріне айналуы туралы бірқатар дәләлдер анықталды: ==1. 20ғасырда ғалымдар атом ядродан және оның төңірегін айналып үнемі қозғалыста болатын электроннан тұратынын анықтады.Атом құрылысының теориясы ұсынылды. А) 1897 жылы Д.Томсон электронды ашты; Б) Француз ғалымы Беккерель радиоактивтілікті ашты. В) Ерлі –зайыпты Кюрилер және Резерфорда радиоактивтілік сәуле шығарудың біркелкі еместігін зерттеді ( магнит өрісінде ол үшке айырылады,біреуінде заряд болмайтын сәуле - сәуле, ал қалған екі сәуле қарама қарсы зарядталған .- сәулелер электрон ағынына тура келді,- сәулелер +2) зарядты гелий атомы болады. Радиоактивтілік –кейбір элементтердің сәуле өткізу құбылысы , заттардан өтуі, фотографиялық пластинкаларды қарайту құбылысы. ==2. Резерфорд қалыңдығы шамамен 10 000 атомға тең алтын пластинкадан а-сәуленің өтуін зерттеді. а-сәуле бөлшектері металл пластинкадан өткенде өзінің жолынан әртүрлі бұрыштарға ауытқып,кейбір жеке бөлшектер бірден өзінің ұшу бағытын өзгертеді –бұл бөлшектердің- шашырауы деп аталады ==3. Бұл құбылысты түсіндіру үшін Резерфорд атом құрылысының «планетарлық» моделін ұсынды: бұл бойышна атомның барлық массасы шоғырланған (+)оң зарядталған ядродан,ядроның төңірегін айналып жүретін электроннан тұрады.Ядролық модельді қазір де қолданады.Химиялық элемент атомының негізгі сипаттамасы –ядро заряды. Ядро заряды элементтің реттік нөмірімен сәйкес келеді. 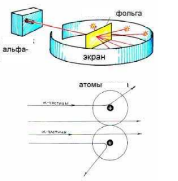
. ==4. Элементарлы бөлшектер ашылған соң Иваненко және Гапон атом құрылысының протонды-нейтрондық теориясын ашты,бұған сәйкес барлық атомдар протон мен нейтроннан тұрады делінді.Ядрода протон мен нейтронды ұстап тұратын күшті ядролық күштер деп атады. ==5. Ары қарай зерттеулер нәтижесі табиғатта бір атомның ядро зарядтары бірдей, бірақ массалары әр түрлі болатын түрлерін ашты.Оларды- изотоптар деп атады.Әрбір изотоп атом массасы және ядро зарядымен сипатталады.Барлық химиялық элементтердің изотоптары бар. ==6. 20ғасырда 1930 жылдан кейін мүмкін болатын ядролық реакциялардың көптеген түрі ашылып,зерттелді.Ядролық реакциялардың көмегімен радиоактивті қасиеті бар изотоптар алынады.Олардың барлығы тұрақсыз,радиоактивті ыдырау нәтижесінде басқа элементтердің изотоптарына айналады.Атом құрылысының күрделілігі туралы алғашқы мәліметтер сұйықтықтар мен газдар арқылы электр тоғын өткізіп зерттегенде алынды. 19 ғасырдың отызыншы жылдарында атақты ағылшын ғалымы Фарадей тәжірибелері электр тоғы жеке зарядтар түрінде болады деген тұжырымға әкелді.Электр тоғының зарядының шамасын электр тоғын газдар арқылы өткізу тәжірибесі арқылы анықталды.Катодтық сәулелер -электрон деп аталатын теріс (-) зарядталған бөлшектер ағыны . Кейбір элемент атомдарының өз бетімен ыдырауы,атом құрылысының күрделілігінің тікелей дәлелі,ол радиоактивтілік деп аталды (Беккерель, 1896 жыл). Бұдан кейін радиоактивті ыдырау кезінде түзілетін α және β сәулелердің табиғаты анықталды.(Э.Резерфорд, 1899-1903), атом ядросының ашылуы (Э.Резерфорд, 1909-1911) электронның зарядының ашылуы (Р.Милликен, 1909), Резерфорд 1911жылы атом құрылысының планетарлық моделін ұсынды. Артықшылығы: Атомның ортасында(+ ) зарядталған ядро орналасады. Барлық оң заряд(+),атомның массасы ядродға шоғырланған. Ядро төңірегінде электрон айналып жүреді,оның саны (+) ядро санына тең. Бұл модель арқылы көптеген тәжірибелерді түсінуге мүмкіндік берді. Кемшілігі: Бұл теория бойынша электрон айналғанда энергия шығару керек болған,бұл оның спираль бойымен қозғалып,ақырында құлап түсуіне әкелер еді.Бірақ атомның жоғалып кетуінің ешқандай дәделі жоқ. Электрон ядроны тек нақты дөгеленген орбита бойымен қоззғалады. Орбита радиусы мен электронның жылдамдығы Бордың кванттық қатынасына тең : mvr=nh, m- электрон массасы, n- орбита номері, h- Планка тұрақтысы (1.05*10 Дж/сек) Электрон өзіне тән орбитамен қозғалғанда электрон жоғалмайды, энергия сіңірмейді. Ол атомдағы электронның физиканың классикалық заңдарына бағынбайтынын болжады. Кемшілігі: Атом құрылысының кванттық моделі .Француз Бройль, неміс Гейзенберг, австриялық Шредингер, ағылшын Дирак Электронның екі жақты табиғаты бар. (корпускулалық- толқындық) . Электрон үшін біруақытта координатасы мен жылдамдығын өлшеу мүмкін емес. Неғұрлым дәл жылдамдығын өлшесек,соғұрлым оның кординатасы нақты болмайды немесе керісінше. Атомда электрон белгілі траекториямен қозғалмайды, ядро кеңістігінің кез келгени жерінде болуы мүмкін. Орбиталь туралы түсінік Атом ядросы протон және нейтроннан тұрады.Изотоптар. ==7. Қорытынды: Атом құрамына элементар бөлшектер кіреді: протондар, нейтрондар, электрондар. Химиялық элемент атомының негізгі сипаттамасы - ядро заряды. Ядро заряды элементтің реттік нөміріне сәйкес келеді. Бір химиялық элемент ядродағы нейтрон саны әртүрлі изотоп түрінде бола алады. Мұғалімнің толықтыруы. Атом өте кішкентай бөлшектерден тұрады.Ең кішкентай бөлшектің бірі электрон,электр заряды бірге тең. Электрон атауын бұрынғы ғасыр соңында алды,оған дейін физиктер сым арқылы жүретін электр тоғы деп жорамалдады. Белгісіздік принципі ,электронның траекториясын анықтаудың керек еместігін айтты.Тек электронның кез-келген уақытта ядро кеңістігінде шамамен болатын орнын көрсетуге болатынын айтты.Бұл ықтималдықты матеметикалық әдістер көмегімен есептеді.
Сонымен толқындық әдісте әр түрлі орбиталдар болады: s-орбиталь (сфера формалы), p-орбиталь (сегіздік пішінді), d-орбиталь (рис. 2-7) , f-орбиталь одан да құрылысы күрделі.    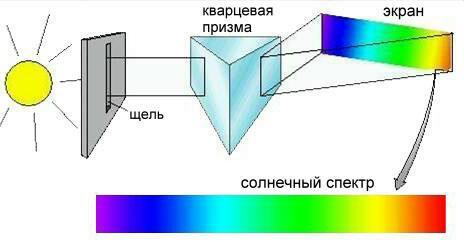 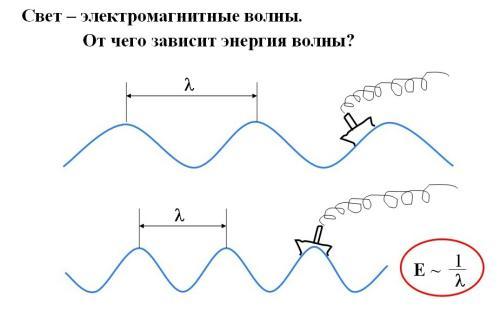
|