
ВОДА
8 класс

Вода… Ты не имеешь ни вкуса, ни цвета, ни запаха, тебя невозможно описать – тобой наслаждаешься, не ведая, что ты такое.
Ты не просто необходима для жизни, ты и есть сама жизнь.
Ты божество, ты совершенство, ты самое большое богатство на свете
А. де Сент-Экзюпери
МБОУ «Обоянская СОШ №1»

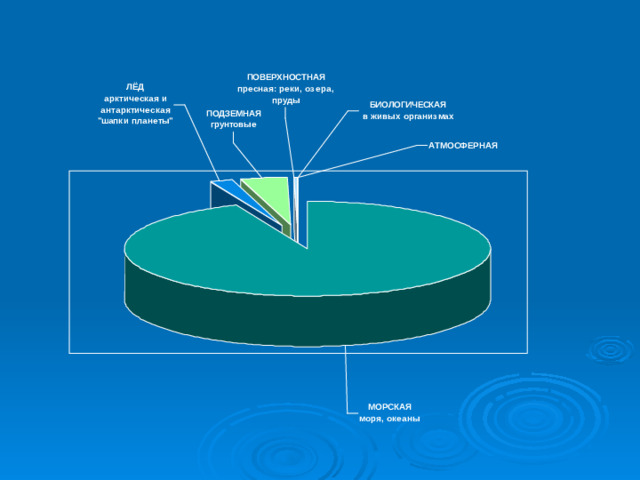
Вода в природе
МБОУ «Обоянская СОШ №1»

МБОУ «Обоянская СОШ №1»
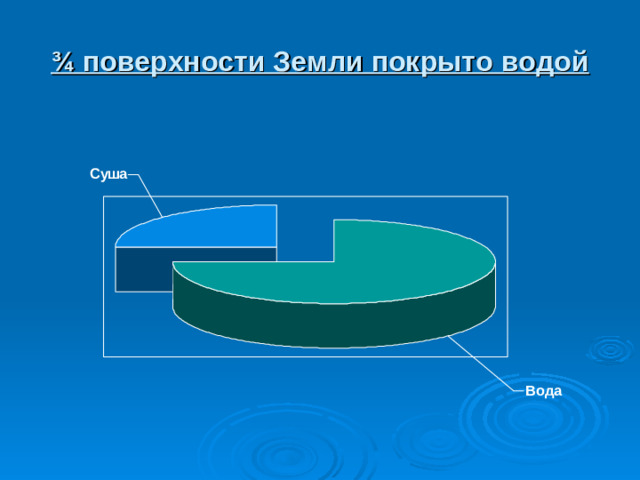
¾ поверхности Земли покрыто водой
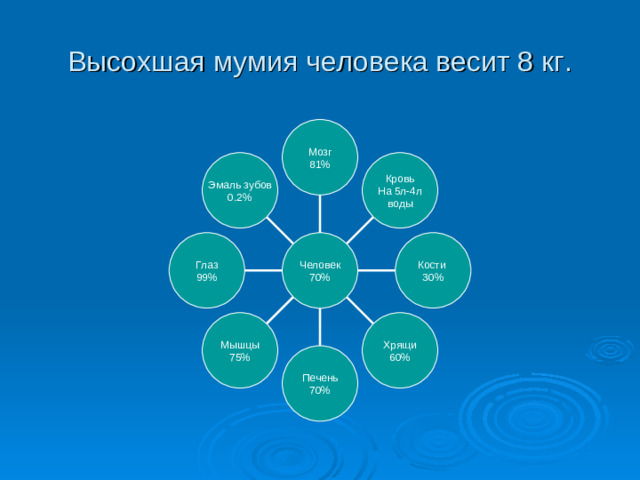
Высохшая мумия человека весит 8 кг.
Мозг
81%
Эмаль зубов
0.2%
Кровь
На 5л-4л
воды
Кости
30%
Глаз
99%
Человек
70%
Хрящи
60%
Мышцы
75%
Печень
70%

СВОЙСТВА ВОДЫ
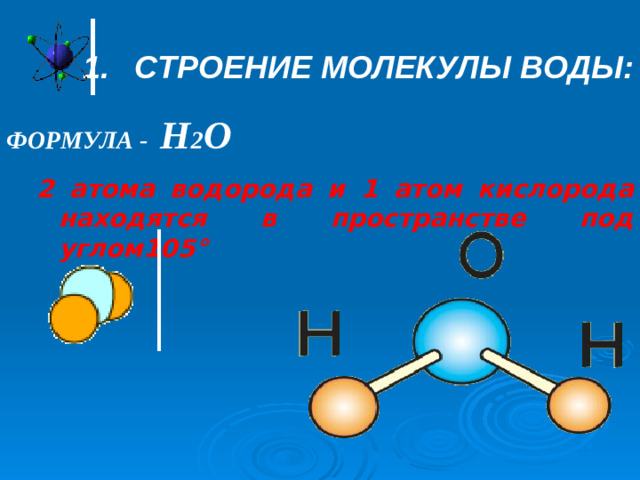
ФОРМУЛА - Н 2 О
2 атома водорода и 1 атом кислорода находятся в пространстве под углом105 °

2. Физические свойства воды

2. ФИЗИЧЕСКИЕ СВОЙСТВА ВОДЫ:
- ЖИДКОСТЬ - БЕЗ ЦВЕТА, ВКУСА И ЗАПАХА
- СУЩЕСТВУЕТ В ТРЕХ АГРЕГАТНЫХ СОСТОЯНИЯХ
- КИПИТ ПРИ 100 ° С
- ЗАМЕРЗАЕТ (ПЛАВИТСЯ) ПРИ 0 ° С
- ПЛОТНОСТЬ 1 Г/МЛ
- ОБЛАДАЕТ САМОЙ БОЛЬШОЙ ТЕПЛОЁМКОСТЬЮ
- НЕ ПРОВОДИТ ЭЛЕКТРИЧЕСКИЙ ТОК
- ПЛОТНОСТЬ ЛЬДА МЕНЬШЕ ПЛОТНОСТИ ВОДЫ
- УНИВЕРСАЛЬНЫЙ РАСТВОРИТЕЛЬ

3. Химические свойства воды
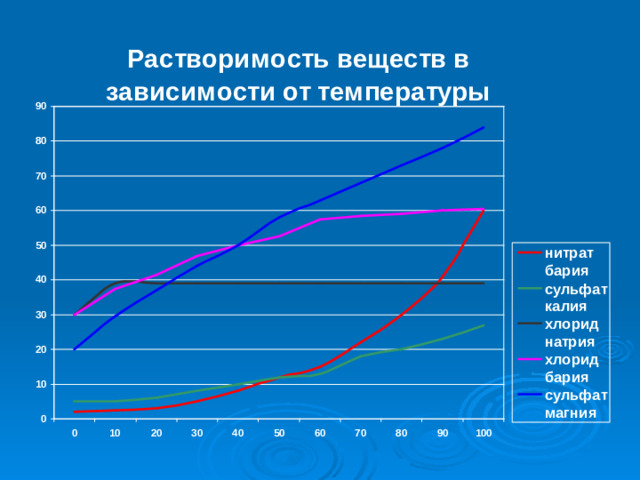
Растворимость

3. ХИМИЧЕСКИЕ СВОЙСТВА ВОДЫ
1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ:
а) очень активные металлы при взаимодействии с водой образуют гидроксид металла и водород:
2 Na + 2H 2 O = 2NaOH + H 2
гидроксид натрия
2K + 2 H 2 O = 2KOH + H 2
гидроксид калия
Ca + 2H 2 O = Ca(OH) 2 + H 2
гидроксид кальция

Взаимодействие воды с кальцием

б) металлы средней активности взаимодействуют с водой при нагревании , образуя оксид металла и водород :
Zn + H 2 O = ZnO + H 2
оксид цинка
3Fe + 4H 2 O = Fe 3 O 4 + 4H 2
железная окалина
в) малоактивные металлы с водой
не реагируют :
Cu + H2O =

2. ВЗАИМОДЕЙСТВИЕ ВОДЫ С ОКСИДАМИ:
а) оксиды активных металлов при взаимодействии с водой образуют гидроксиды :
CaO + H 2 O = Ca(OH) 2
гидроксид кальция
K 2 O + H 2 O = 2 KOH
гидроксид калия

б) оксиды неметаллов при взаимодействии с водой образуют кислоты:
SO 2 + H 2 O = H 2 SO 3
c ернистая кислота
SO 3 + H 2 O = H 2 SO 4
серная кислота
- серная кислота
- серная кислота
- серная кислота
- серная кислота

P 2 O 5 + 3H 2 O = 2H 3 PO 4
ортофосфорная кислота

3. Разложение воды под действием электрического тока (электролиз):
2H 2 O = 2H 2 ↑ + O 2 ↑
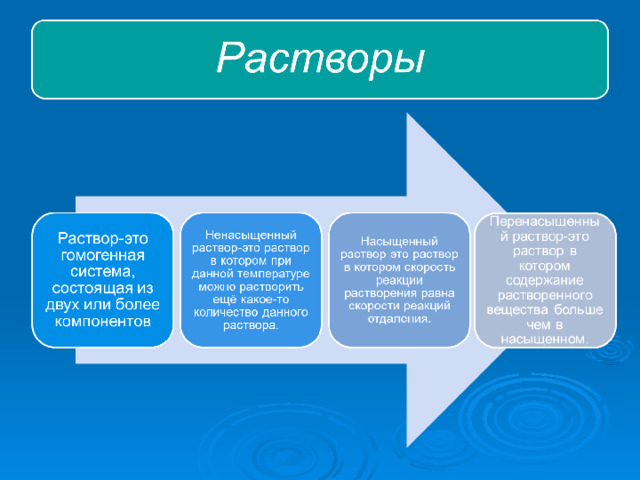

Растворение
Химический процесс –взаимодействие вещества с водой и образование гидратов
Физический процесс –
результат диффузии веществ
Состав раствора
Растворенное вещество
Гидраты растворенных веществ
Растворитель

Растворимость -
- Способность вещества образовывать с другими веществами (растворителями) однородные системы – растворы

Факторы влияющие на растворимость веществ
- природа растворенного вещества
- природа растворителя
- температура
- масса растворенного вещества

Природа растворенного вещества
Карбонат кальция CaCO 3
Гидроксид кальция Ca ( OH) 2
Хлорид кальция CaCl 2
хорошо растворимые (в 100г H 2 O больше 1г вещества)
нерастворимые (в 100г H 2 O меньше 0,01г вещества)
малорастворимые (в 100г H 2 O меньше 1г вещества)
Вещества
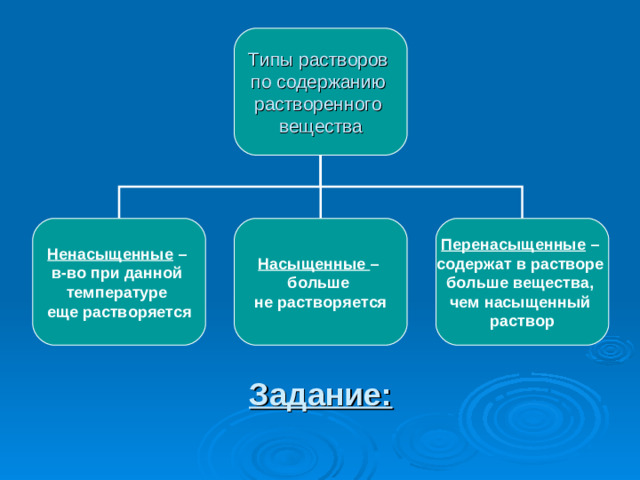
Типы растворов
по содержанию
растворенного
вещества
Ненасыщенные –
в-во при данной
температуре
еще растворяется
Насыщенные –
больше
не растворяется
Перенасыщенные –
содержат в растворе
больше вещества,
чем насыщенный
раствор
Задание:

Классификация растворов по признаку растворимости
Ненасыщенный раствор: при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе
Насыщенный раствор: при данной температуре вещество больше не растворяется
Пересыщенный раствор: в растворенном состоянии больше вещества, чем его в насыщенном растворе

Применение растворов в промышленности

Применение растворов в сельском хозяйстве

Применение растворов в быту и медицине

СПАСИБО ЗА УРОК!