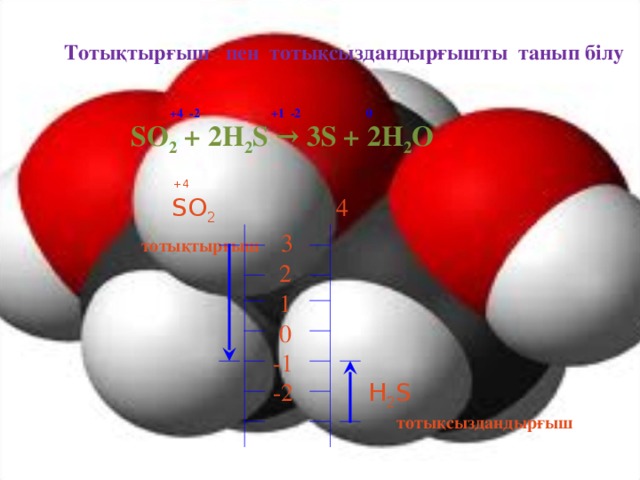
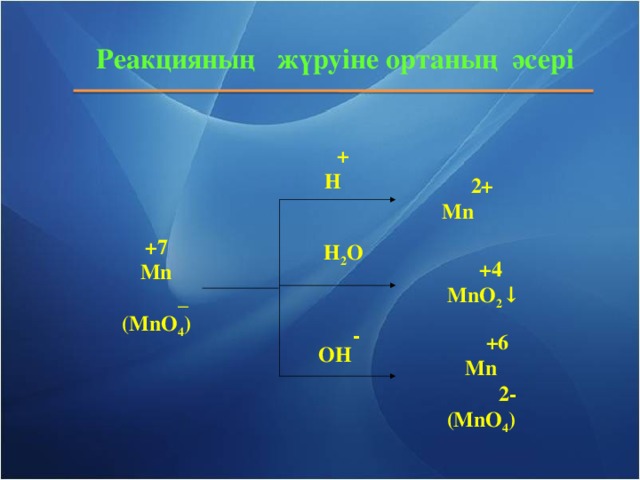
Тотығу - тотықсыздану процесі ең кеңінен тараған және теориямен практикада маңызды роль атқаратын реакция болып табылады. Тірі ағзаларда жүретін зат алмасу, шіру, ашу, фотосинтез процестері тығыз байланысты. Тотығу - тотықсыздану процесі табиғаттағы заттар айналымын жүзеге асырады. Отынның жануы, металдар коррозиясы, металдар құймаларын дайындау және электролиз процестерінде жүзеге асырады.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
"Тотығу- тотықсыздану раекциялары!"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«"Тотығу- тотықсыздану раекциялары!"»
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1930 руб.
2760 руб.
1970 руб.
2820 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства





 реакция тотығу - тоты қсыздану реакциясы болмайды + 4 -2 +1 -1 +2 -1 0 +1 -2 PbO 2 + 2HCl → PbCl 2 + Cl 2 + 2H 2 O Тотығу дәрежесі өзгеретін болса реакция тотығу - тоты қсыздану реакциясы болып табылады" width="640"
реакция тотығу - тоты қсыздану реакциясы болмайды + 4 -2 +1 -1 +2 -1 0 +1 -2 PbO 2 + 2HCl → PbCl 2 + Cl 2 + 2H 2 O Тотығу дәрежесі өзгеретін болса реакция тотығу - тоты қсыздану реакциясы болып табылады" width="640"