В презентации по химии в 8 классе: "Кристаллические решетки" раскрыты главные понятия темы.
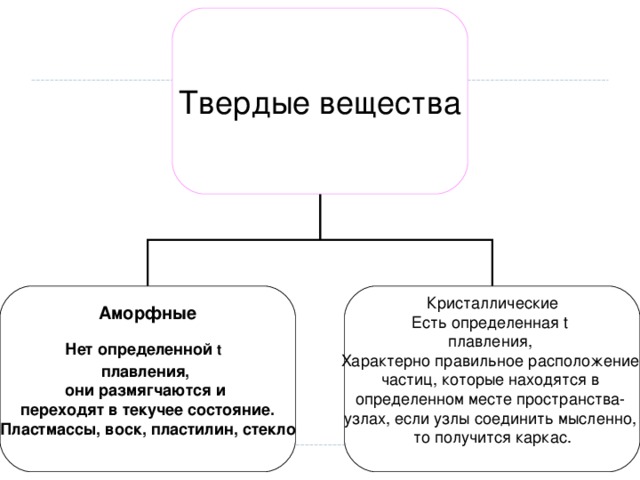
Кристаллические решетки- это строго упорядоченные частицы твердого вещества в пространстве.
Структурные вещества- это атомы, молекулы и ионы, из них состоят вещества.
Если твердые вещества нагреть, то скорость движения частиц увеличится и нарушится упорядоченная структура, т.е. произойдет плавление вещества.
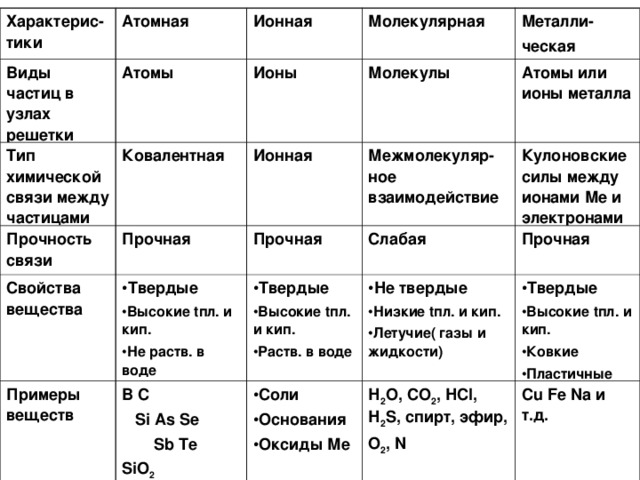
Показаны причины образования основных типов кристаллических решеток. Приводятся примеры агрегатных состояний веществ и зависимость свойств веществ от типа решеток. Основной материал систематизирован в виде таблицы.
Описана сущность Закона постоянства состава (1808 г. Ж.Л.Пруст)
Молекулярные химические соединения, независимо от способа получения, имеют постоянный состав и свойства.
Каждому веществу соответствует одна формула.