В данной презентации рассматриваются понятия "электролит", "неэлектролит", "электролитическая диссоциация". Также приведена таблица с сильными, слабыми электролитами и неэлектролитами.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация урока химии в 9 классе по теме "Теория электролитической диссоциации" УМК О. С. Габриелян
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация урока химии в 9 классе по теме "Теория электролитической диссоциации" УМК О. С. Габриелян»
Полезное для учителя
Распродажа видеоуроков!
1930 руб.
2760 руб.
1930 руб.
2760 руб.
1930 руб.
2760 руб.
1990 руб.
2840 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства



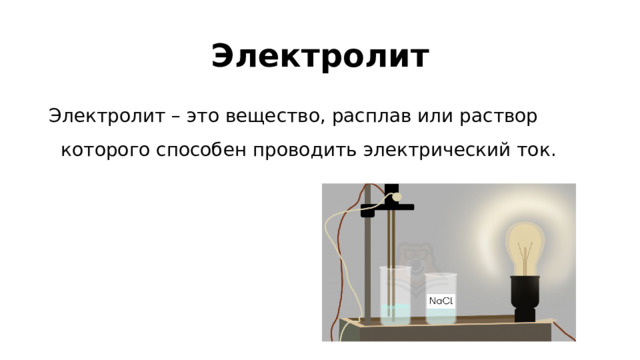


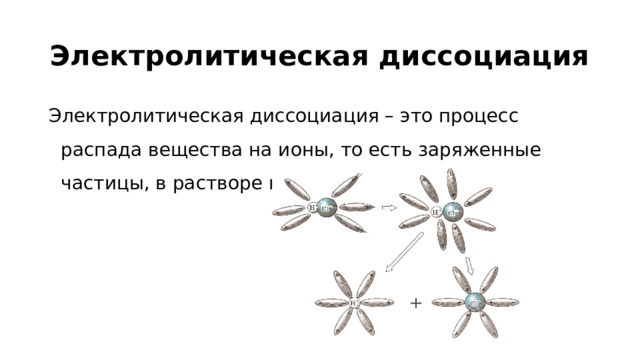
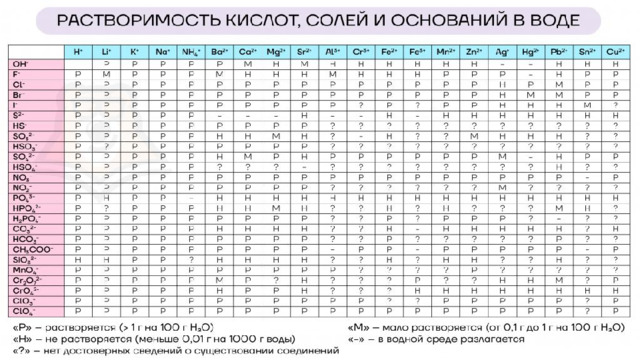
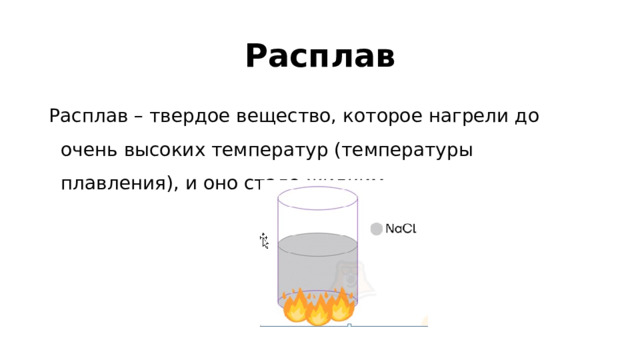

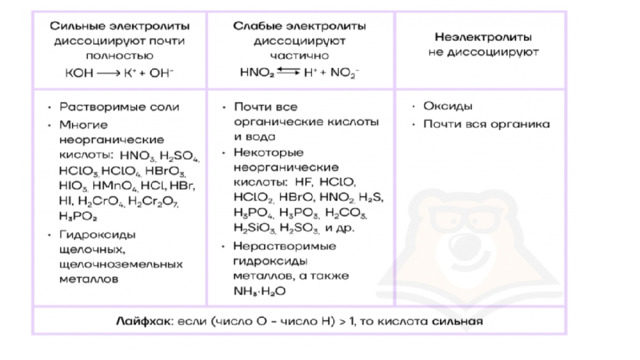
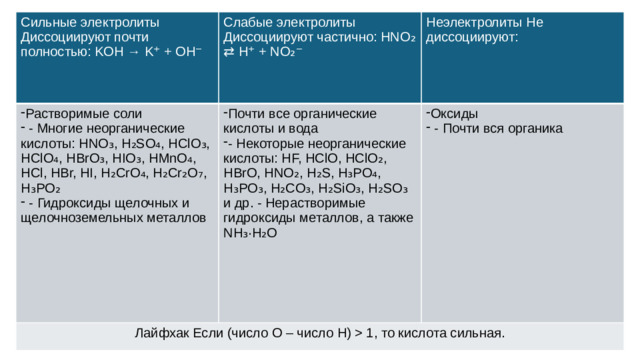 1, то кислота сильная. Неэлектролиты Не диссоциируют:" width="640"
1, то кислота сильная. Неэлектролиты Не диссоциируют:" width="640"


![Диссоциация солей Соли- вещества, диссоциирующие на катион металла или аммония и анион кислотного остатка. Na₂CO₃ = 2Na⁺ + CO₃²⁻ К[Al(OH)₄] = K⁺ + [Al(OH)₄]⁻](https://fsd.kopilkaurokov.ru/up/html/2025/12/27/k_69504711b7858/img_user_file_69504713a882d_15.jpg)


















