Презентация подготовлена для более легкого усвоения материала.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
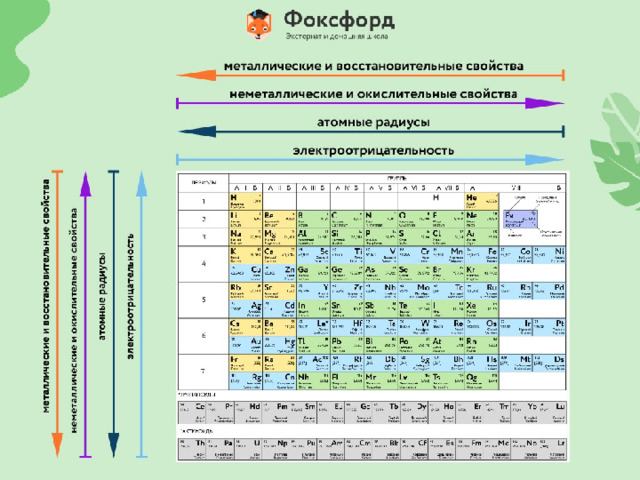
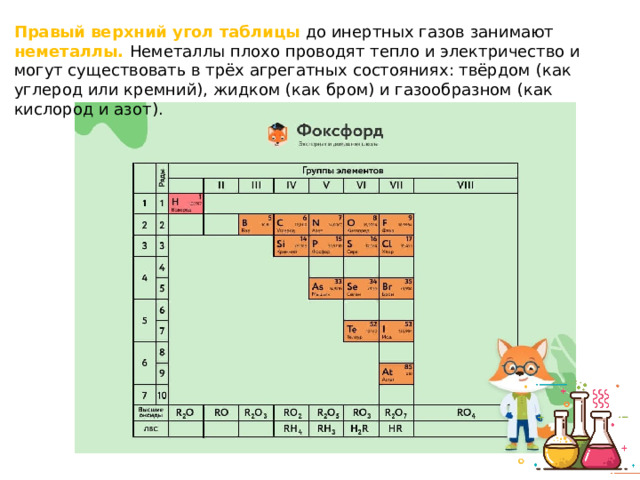
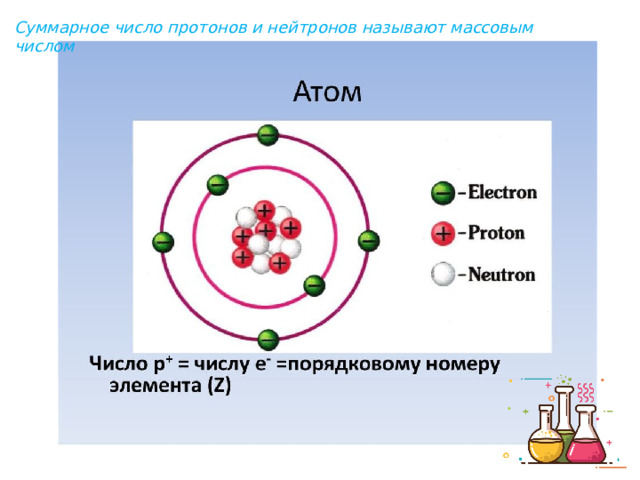
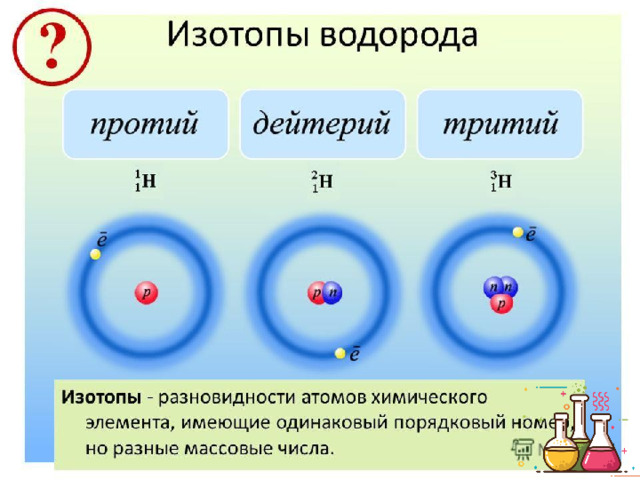
Презентация к уроку химии для восьмых классов по теме: "Периодический закон и строение атома"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация к уроку химии для восьмых классов по теме: "Периодический закон и строение атома"»
Скачать
Презентация к уроку химии для восьмых классов по теме: "Периодический закон и строение атома"
Презентация к уроку химии для восьмых классов по теме: "Периодический закон и строение атома"
Полезное для учителя
Распродажа видеоуроков!
1990 руб.
2840 руб.
1930 руб.
2760 руб.
1770 руб.
2530 руб.
2200 руб.
3140 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства