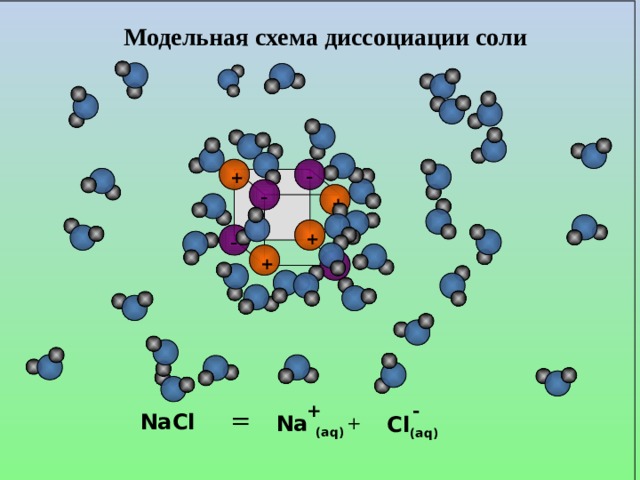
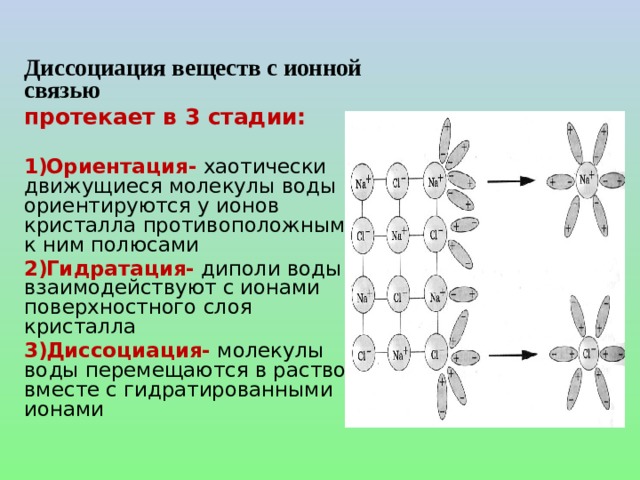
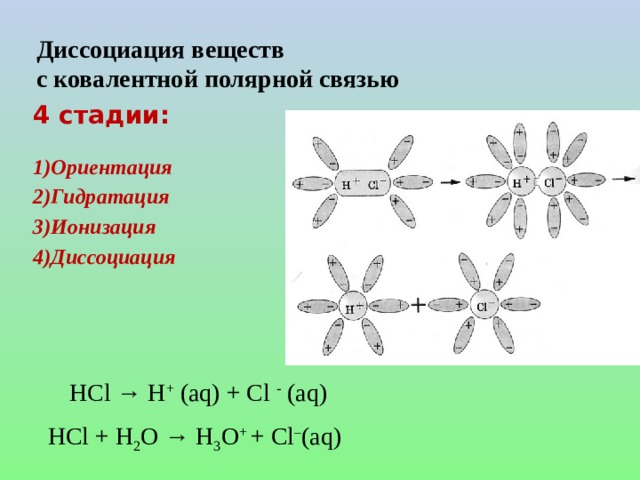
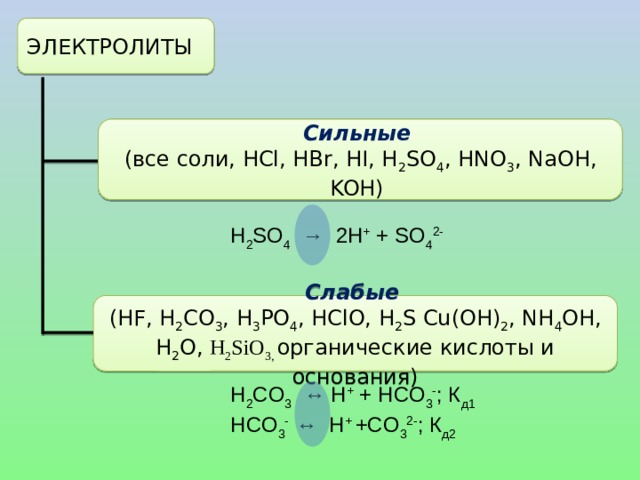
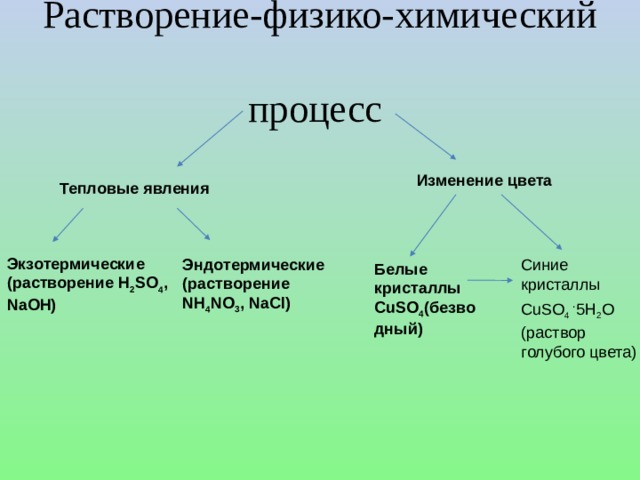
Рассмотрены понятия: электролит, неэлектролит, электролитическая диссоциация, ионы и их отличия от нейиральных атомов, механизмы диссоциации веществ с ионной и ковалентной полярной связью, степень диссоциации и деление веществ на слабые и сильные электролиты, константа диссоциации слабых электролитов и её зависимость от различных факторов. Сформулированы положения ТЭД. Представлен вывод значения ионного произведения воды. Рассмотрено понятие водородного и гидроксильного показателей воды и как значение рН и рОН определяют среду раствора. Рассмотрены решения задач на рН.
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация к уроку "Электролитическая диссоциация. Диссоциация воды. Водородный показатель."
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация к уроку "Электролитическая диссоциация. Диссоциация воды. Водородный показатель."»
Скачать
Презентация к уроку "Электролитическая диссоциация. Диссоциация воды. Водородный показатель."
Презентация к уроку "Электролитическая диссоциация. Диссоциация воды. Водородный показатель."
Полезное для учителя
Распродажа видеоуроков!
2200 руб.
3140 руб.
1930 руб.
2760 руб.
1930 руб.
2760 руб.
1930 руб.
2760 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства

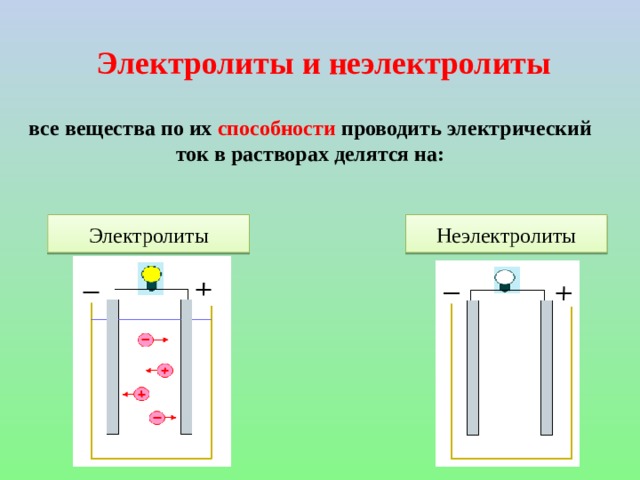




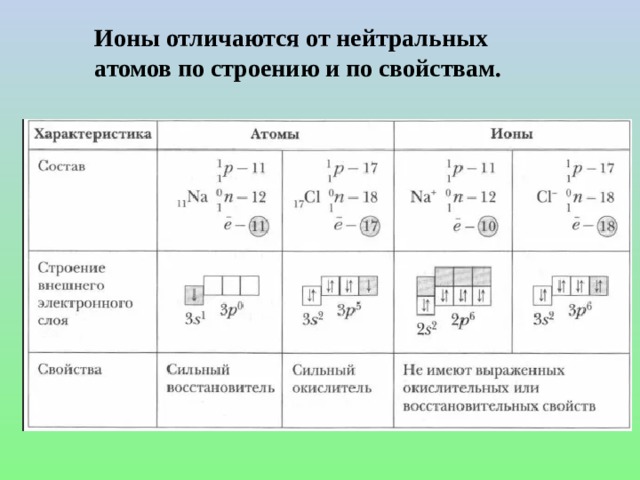

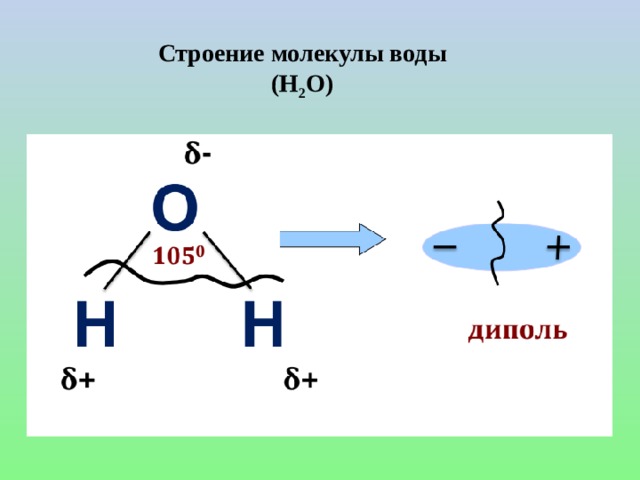

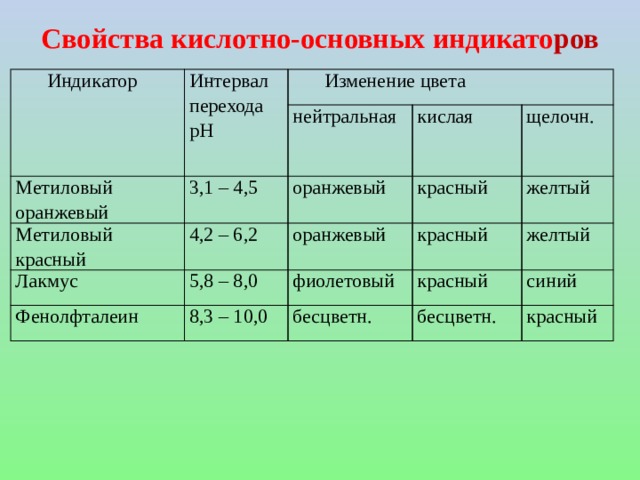
![Диссоциация слабых электролитов. СН 3 СООН ↔ СН 3 СОО - + Н + Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации . К равн. = К дис. = Константа диссоциации — это отношение произведения молярных концентраций ионов к молярной концентрации недиссоциированных молекул. Величина К дис . зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. [СН 3 СОО - ][Н + ] [СН 3 СООН]](https://fsd.kopilkaurokov.ru/up/html/2020/08/19/k_5f3d371f09689/img_user_file_5f3d37205b2bd_14.jpg)




![Так как вода - очень слабый электролит, то концентрация недиссоциированных молекул может быть принята равной общему числу молей в 1 дм 3 воды, то есть: [Н 2 О] = 1000/18 = 55,56 моль/дм 3 . Тогда К дис [Н 2 О] = [H + ] [ОН - ] = 1,8∙10 -16 ∙55,56 = 10 -14 = К w Величина [Н + ][ОН - ] = 10 -14 называется ионным произведением воды. Так как в воде концентрации гидратированных ионов равны, то [H + ]= [ОH - ] = √10 -14 = 10 -7 моль/дм 3](https://fsd.kopilkaurokov.ru/up/html/2020/08/19/k_5f3d371f09689/img_user_file_5f3d37205b2bd_20.jpg)

![Водородный показатель рН В 1909 г. Сёренсен ввел значение отрицательного десятичного логарифма концентрации водородных ионов, которое называют водородным показателем рН рН= - lg[H + ]. Отрицательный десятичный логарифм концентрации гидроксильных ионов называется гидроксильным показателем pОH = -lg[ОH - ].](https://fsd.kopilkaurokov.ru/up/html/2020/08/19/k_5f3d371f09689/img_user_file_5f3d37205b2bd_22.jpg)
![Примеры решения задач Пример: В растворе соляной кислоты концентрация [H + ] = 10 -2 моль/дм 3 . Определите среду раствора. Решение Среда кислая рН = - lg10 -2 = 2.](https://fsd.kopilkaurokov.ru/up/html/2020/08/19/k_5f3d371f09689/img_user_file_5f3d37205b2bd_23.jpg)
![Пример: Дан раствор КОН концентрацией 0,001 моль/дм 3. Найти рН этого раствора. Решение: КОН ↔ К + + ОН - 0,001 0,001 [H + ][ОH - ] = 10 -14 [H + ] = 10 -14 / 10 -3 = 10 -11 рН = - lg10 -11 = 11 Специальные вещества, с помощью которых можно приблизительно оценить реакцию раствора, называются индикаторами.](https://fsd.kopilkaurokov.ru/up/html/2020/08/19/k_5f3d371f09689/img_user_file_5f3d37205b2bd_24.jpg)