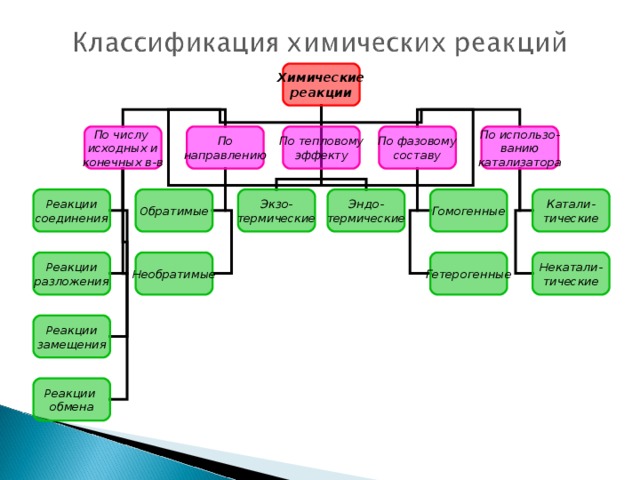
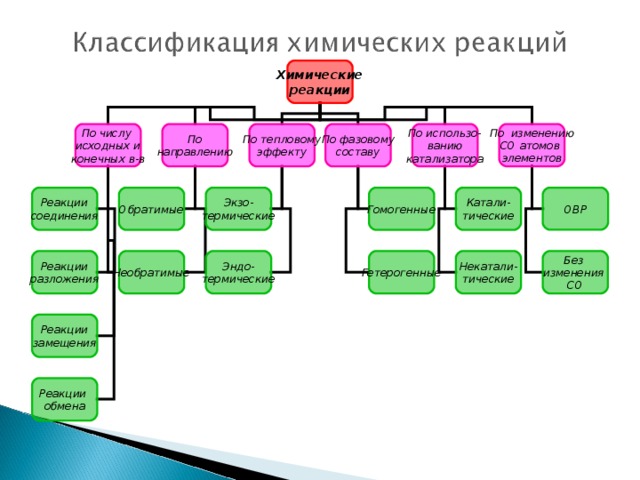
Презентация разработанна учащимися с учителем. В данной презентации показывает, что окислительно-восстановительные реакции - это реакции при которых изменяется СО, процессы - окисление, восстановление и т.д.
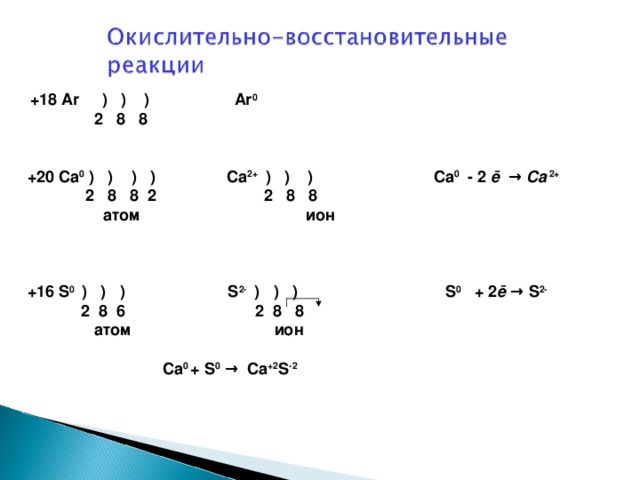
ОВР – это такие реакции, которые сопровождаются изменением степени окисления у элементов, которое связано с переходом электронов от одних атомов, ионов или молекул к другим.
Окисление всегда сопровождается восстановлением, а восстановление окислением.
ОВР – это единство двух противоположных процессов: окисления и восстановления.









 СаО + СО 2 KMnO 4 = K 2 Mn О 4 + Mn О 4 + О 2 CuS + О 2 = С u О + S О 2" width="640"
СаО + СО 2 KMnO 4 = K 2 Mn О 4 + Mn О 4 + О 2 CuS + О 2 = С u О + S О 2" width="640"


















