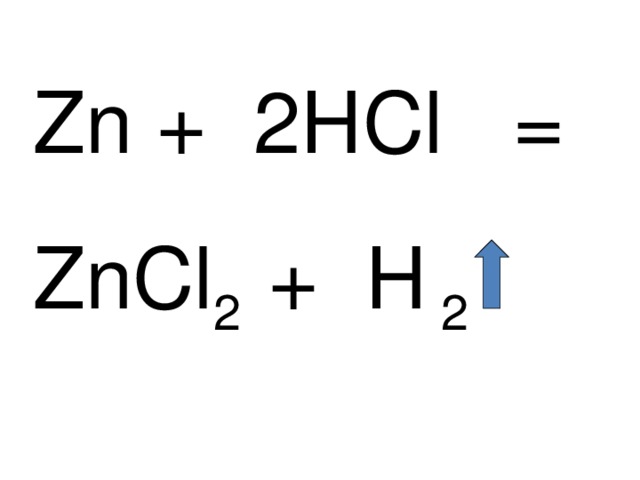/////////////////////////// Тема: Окислительно-востановительные реакции.////////////////////////////////////////////////
////////////////////////// Цель: Познакомить со свойствами окисления и востановления химических веществ и связь с жизненными процессами.
//////////////////////// План: 1. Вступительное слово.
2. Горение.
3. Определение ОВР
4. Самостоятельная работа.
5. Рефлексия.
6. Домашнее задание.
Просмотр содержимого документа
«Окислительно-востановительные реакции »

Преподаватель химии Штейникова И.В.





Брожение
Гниение
 C 6 H 12 O 6 + 6O 2" width="640"
C 6 H 12 O 6 + 6O 2" width="640"
это единственно важный первичный источник энергии для всего живого
6CO 2 + 6H 2 O - C 6 H 12 O 6 + 6O 2

ОВР - это такие реакции, при которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества.

переход электронов от одних атомов, молекул или ионов к другим .

О КИСЛЕНИЕ – О ТДАЧА ЭЛЕКТРОНОВ
(повышение с.о.)
В ОССТАНОВЛЕНИЕ- В ЗЯТИЕ ЭЛЕКТРОНОВ
(понижение с.о.)

Восстановители (отдающие электроны): металлы, водород, уголь, СO,сероводород, аммиак.
Окислители (принимающие электроны): O 2 ,галогены, азотная и серная кислоты,KMnO 4 , K 2 Cr 2 O 7 .


Ход действий
Наблюдения и уравнения химических реакций

КУСОЧЕК ЦИНКА ОПУСТИТЕ
В ПРОБИРКУ С РАСТВОРОМ СОЛЯНОЙ
КИСЛОТЫ
Zn + HCl =
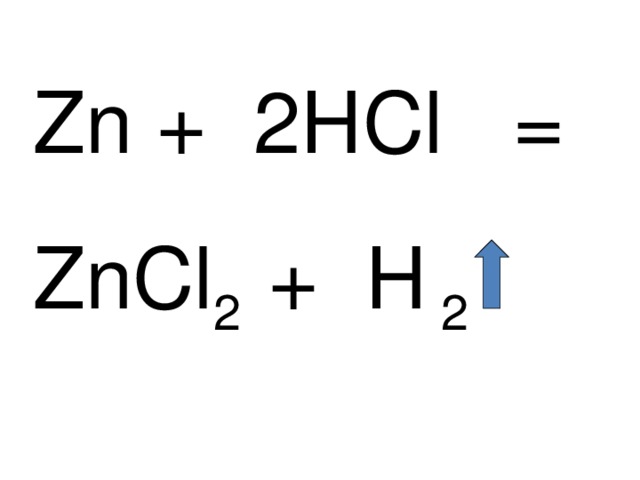
Zn + 2HCl =
ZnCl 2 + H 2

Железный гвоздик опустите в раствор сульфата меди (II)
Fe + CuSO 4 =
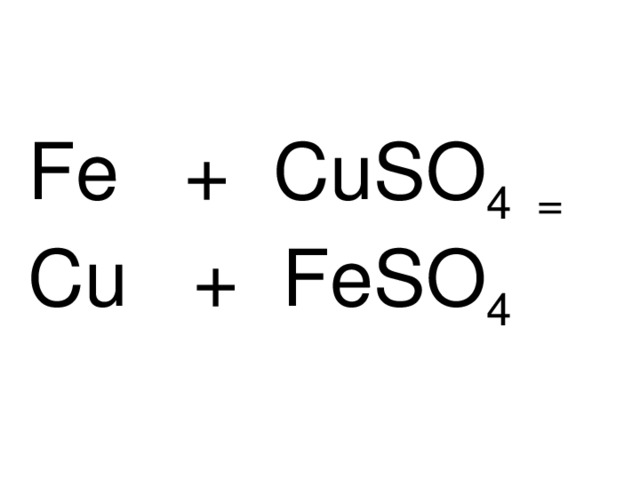
Fe + CuSO 4 = Cu + FeSO 4
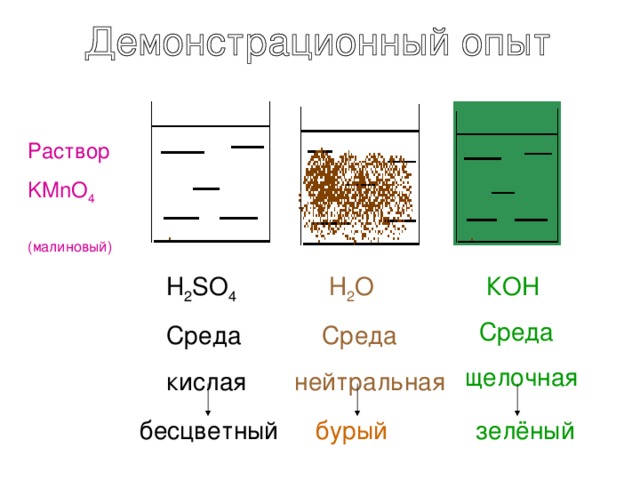
Раствор
KMnO 4
(малиновый)
H 2 SO 4
Среда
кислая
Н 2 О
Среда
нейтральная
КOH
Среда
щелочная
бесцветный
бурый
зелёный
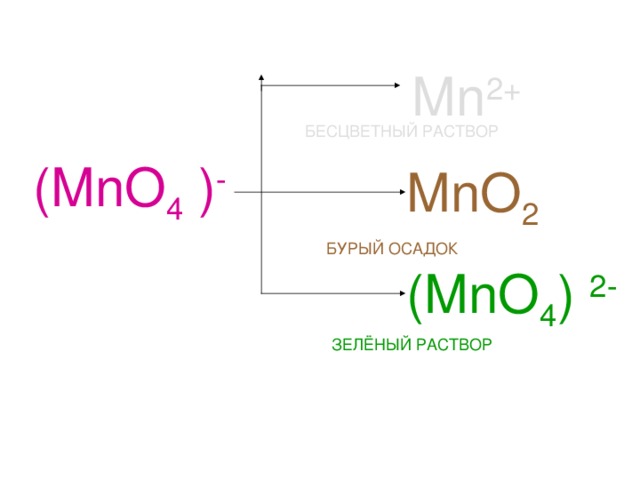
Mn 2+
БЕСЦВЕТНЫЙ РАСТВОР
(MnO 4 ) -
MnO 2
БУРЫЙ ОСАДОК
(MnO 4 ) 2-
ЗЕЛЁНЫЙ РАСТВОР
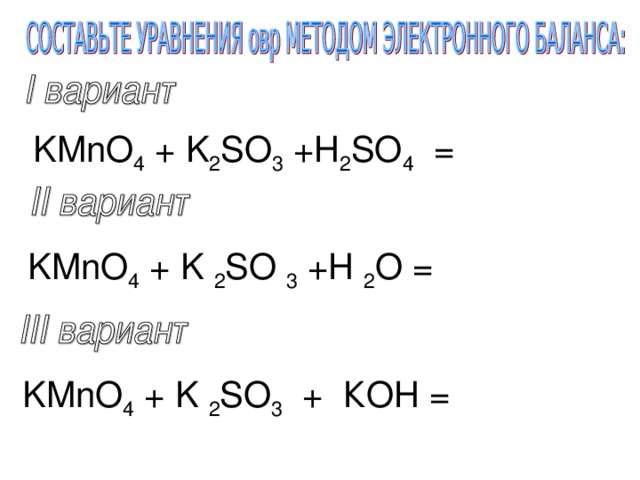
KMnO 4 + K 2 SO 3 +H 2 SO 4 =
KMnO 4 + K 2 SO 3 +H 2 O =
KMnO 4 + K 2 SO 3 + КOH =


Hg + KMnO 4 + HCl= Hg Cl 2 + KCl + MnO 2 + H 2 O
Hg + FeCl 3 = HgCl 2 + FeCl 2






 C 6 H 12 O 6 + 6O 2" width="640"
C 6 H 12 O 6 + 6O 2" width="640"