oСЕРА И ЕЕ СОЕДИНЕНИЯ
oСЕРА
oЭто элемент 6 группы
главной подгруппы, 3 периода ПСХЭ .
oПорядковый номер – 16.
oЭлектронная формула – 2е 8е 6е.
oНа внешнем энергетическом уровне 6 е.
oДо завершения уровня не хватает
2е, поэтому эти электроны
принимает от МЕТАЛЛОВ и от
менее ЭО НЕМЕТАЛЛОВ.
oСера являются НЕМЕТАЛЛОМ.
o
oСТЕПЕНЬ ОКИСЛЕНИЯ
СЕРА – менее окислитель.
oМожет быть ОКИСЛИТЕЛЕМ – с металлами и неметаллами с меньшей ЭО – с.о. -1,-2
oМожет быть ВОССТАНОВИТЕЛЕМ – с неметаллами с большей ЭО – I, Br, Cl, N, O, F – с.о. +4, +6.
o
oАллотропия
oСпособность атомов одного химического элемента образовывать несколько простых веществ называется АЛЛОТРОПИЯ.
oЭти вещества – называются АЛЛОТРОПНЫМИ ВИДОИЗМЕНЕНИЯМИ.
oПричина аллотропии:
oОбразование различных типов кристаллических решеток.
oРазная структура кристаллических решеток.
oРазличное число атомов в молекуле
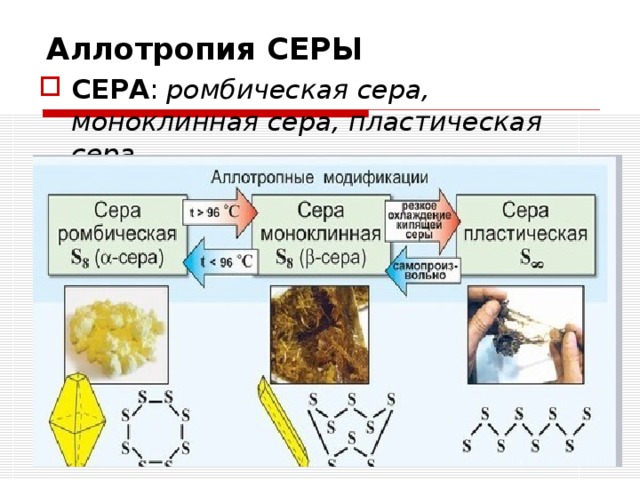
oАллотропия СЕРЫ
oСЕРА: ромбическая сера, моноклинная сера, пластическая сера.
o
oАЛЛАТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ
oРОМБИЧЕСКАЯ сера –состоит из 8 атомов серы, цвет – лимонно-желтый, кристаллы имеют вид – ОКТАЭДРОВ, tплав = 112,8 градусов.
oМОНОКЛИННАЯ сера - состоит из 8 атомов серы, кристаллы имеют ИГОЛЬЧАТЫЙ вид, tплав = 119,3 градусов.
oПЛАСТИЧЕСКАЯ сера - состоит из множества атомов серы, цвет – темно-коричневый, tплав = 160 градусов.
oДЕМЕРКУРИЗАЦИЯ
oСера при обычных условиях может реагировать с ЩМ, ЩЗМ, Hg, Cu, Ag.
oНапример: Hg + S = HgS
oПроцесс демеркулизации – используется при разливе ртути, так как жидкую ртуть можно собрать посыпав на нее серу.
oХимические свойства серы
o1. С МЕТАЛЛАМИ
o- с щелочными – при обычных условиях
o2Na + S = Na2S
o- с щелочноземельными - при обычных условиях
oCa + S = CaS
o- при нагревании с Zn, Al, Fe.
oZn + S = ZnS
o- с золотом никогда не взаимодействует.
oAu + S – реакция не идет.
oХимические свойства серы
o2. С НЕМЕТАЛЛАМИ
o - с водородом – при нагревании – образуется сероводородная кислота
oH2 + S = H2S
o- с кислородом – при нагревании – образуются оксиды.
oS + O2 = SO2
o- с ЙОДОМ, АЗОТОМ – не реагирует.
oЗНАЧЕНИЕ СЕРЫ
oСера — один из биогенных элементов. Сера входит в состав некоторых аминокислот, витаминов, ферментов.
oСера участвует в образовании третичной структуры белка.
oТакже сера участвует в бактериальном фотосинтезе.
oОкислительно-восстановительные реакции серы — источник энергии в хемосинтезе.
oУчаствует в окислительно-восстановительных процессах организма.
oПри ее недостатке – наблюдается хрупкость и ломкость костей, выпадение волос.
oСеры много в бобовых растениях, в овсяных хлопьях и яйцах.
oЧеловек содержит примерно 2 г серы на 1 кг своего веса.
oПРИМЕНЕНИЕ СЕРЫ
o«СИРА» - «светло-желтый».
oВ Древнем Египте – изготавливали краски, белили ткани, косметику.
oВ Древнем Риме и Греции – при лечении кожных заболеваний, при дезинфекции.
oИспользуют при изготовлении – спичек, бумаги, резины, красок, лекарств, пластмассы, косметики, для борьбы с вредителями, для производства серной кислоты.
oСОЕДИНЕНИЯ СЕРЫ
oСЕРОВОДОРОД – газ, с резким запахом. Очень ядовит.
oСУЛЬФИДЫ – соли сероводородной кислоты.
oОКСИД СЕРЫ (4) – сернистый газ – бесцветный, с резким запахом, хорошо растворим в воде. Используют для – отбеливания шерсти, шелка, бумаги, в качестве консервирующего средства для сохранения свежих продуктов.
oДОМАШНЕЕ ЗАДАНИЕ
oПрочитать параграф 22, 23.
oВыполнить задания № 2,3 страница 134.