Государственное краевое бюджетное специальное (коррекционное) образовательное учреждение для обучающихся, воспитанников с ограниченными возможностями здоровья «Специальная (коррекционная) общеобразовательная школа-интернат для незрячих и слабовидящих учащихся» г. Пермь
Использование
и
биологическая роль
ИОДА
ДДД
| 
|
Реферат выполнила ученица 10б класса Иванова Юлия Руководитель: Л.Ю. Захарова, учитель химии
|
2015г.
ОГЛАВЛЕНИЕ
|
| ВВЕДЕНИЕ
| 3 |
| I. | ОТКРЫТИЕ ИОДА
| 4 - 5 |
| II. | HАХОЖДЕНИЕ И КРУГОВОРОТ ИОДА В ПРИРОДЕ
| 6 - 7 |
| III. | ХАРАКТЕРИСТИКА ЭЛЕМЕНТА ИОД
| 8 |
| IV. | ХАРАКТЕРИСТИКА ПРОСТОГО ВЕЩЕСТВА | 9 - 13 |
| 1. | Физические свойства | 9 |
| 2. | Химические свойства | 10 - 11 |
| 3. | Получение иода
| 12 - 13 |
| V. | ПРИМЕНИЕ ИОДА И ЕГО СОЕДИНЕНИЙ
| 14 - 16 |
| VI. | БИОЛОГИЧЕСКАЯ РОЛЬ ИОДА | 17 |
| 1. | Иод внутри нас | 17 - 18 |
| 2. | Реакция организма на недостаток элемента иод | 19 - 21 |
| 3. | Избыток иода в организме | 22
|
| VII. | ИНТЕРЕСНЫЕ ФАКТЫ О ИОДЕ
| 23 |
| VIII. | ПРАКТИЧЕСКАЯ ЧАСТЬ
| 24 – 27 |
|
| ЗАКЛЮЧЕНИЕ
| 28 |
|
| ИСТОЧНИКИ ИНФОРМАЦИИ | 29
|
|
| ПРИЛОЖЕНИЕ |
|
ВВЕДЕНИЕ
С иодом знакомы все. Иод, точнее его спиртовый раствор, служит для смазывания ссадин и царапин, т.к. он является очень сильным антисептическим препаратом.
Но, оказывается, этот элемент в микро-количествах чрезвычайно важен нашему организму. Мне попалась такая заметка в газете «Ва-Банк»: «Беда, точнее катастрофа, бушует на планете! Из – за постоянной нехватки иода люди порой не блещут умом, даже взрослые. Такие люди отличаются взрывным характером, а потому часто терпят неудачи на работе и в личной жизни. Учёные ВОЗ однозначно пришли к выводу, что коэффициент интеллекта IQ напрямую зависит от содержания иода в организме. В нашем городе применение иодосодержащих добавок очень актуально, т.к. в почве, и соответственно в продуктах, очень маленькое содержание иода. Поэтому для сохранения здоровья и интеллектуального потенциала населения недостаток этого элемента нужно восполнять». Так начиналась реклама иодосодержащего препарата.
Меня очень заинтересовала эта информация. Я решила посвятить свою работу изучению своеобразного элемента.
Иод — химический элемент, который можно найти в йодированной соли и в повседневной пище. Оказывается, в небольших объемах йод необходим в человеческом рационе. Каждому человеку будет полезна подборка интересных фактов о йоде, которую я решила сделать.
Цель работы: Изучить литературные и интернет-источники по теме «Использование и биологическая роль иода». Для этого
1) найти данные по следующим пунктам:
- история открытия иода;
- нахождение в природе;
- характеристика элемента и простого вещества;
- применение иода и его соединений;
- биологическая роль иода – содержание, вред недостатка и избытка в организме человека;
2) выполнить все возможные для лабораторных условий опыты с иодом и объяснить их химизм.
I. ОТКРЫТИЕ ИОДА
Иод (Jodum) был открыт в 1811 г. французским химиком Бернаром Куртуа путём обработки серной кислотой золы морских водорослей.
Конец XVII и начало XVIII века были отмечены в Европе непрекращающимися войнами. Требовалось много пороха и, следовательно, много селитры. Производство селитры приняло невиданные масштабы, наряду с обыкновенным растительным сырьём в дело шли и морские водоросли. В них и обнаружили новый химический элемент.
Промышленник селитровар Б. Куртуа был наблюдательным человеком. Это помогло ему стать первооткрывателем нового химического элемента.
Однажды он заметил, что медный котёл, в котором выпаривался щелок, полученный из фукуса, ламинарий и других бурых водорослей, быстро разрушается, как будто его разъедает какая–то кислота. Куртуа решил выяснить, в чём тут дело. В маточном растворе после упаривания и осаждения кристаллических сульфатов натрия и калия оставались их сульфиды и, видимо, что-то еще. Осадив и удалив из раствора соли натрия, он выпарил раствор, обнаружил в котле сульфид калия и чтобы разложить его, прилил к осадку концентрированной серной кислоты – и тут появился фиолетовый дым. Куртуа повторил опыт, на этот раз в реторте, и в приёмнике реторты осели блестящие чёрные пластинчатые кристаллы.
Иодид натрия из водорослей, взаимодействуя с серной кислотой, выделяет иод I2; одновременно образуется сернистый газ – диоксид серы SO2 и вода:
2NaI + 2H2SO4 = I2 + SO2+ Na2SO4 + 2H2O
При охлаждении пары иода превращались в темно-серые кристаллы с ярким блеском. Куртуа писал: «В маточном растворе щелока, полученного из водорослей, содержится довольно большое количество необычного вещества. Его легко выделить: для этого достаточно прилить серную кислоту к данному раствору и нагреть смесь в реторте... Новое «вещество Х» осаждается в приемнике в виде черного порошка, который при нагревании превращается в пары великолепного фиолетового цвета. Удивительная окраска паров нового вещества позволяет отличить его от всех доныне известных веществ, и у него наблюдаются другие замечательные свойства, что придает его открытию величайший интерес». 
Существует и другая версия открытия иода, виновником которого был любимый кот Куртуа: у работавшего в лаборатории химика на плече лежал кот, который, желая развлечься, прыгнул на стол и столкнул на пол стоявшие рядом сосуды, в одном из которых находился спиртовой раствор золы морских водорослей, а во втором — серная кислота. После смешения жидкостей появилось облако сине-фиолетового пара, которое было не чем иным как иодом. 
В 1813 г. появилась первая научная публикация об этом веществе, его стали изучать химики разных стран.
Название новому элементу присвоил в 1813г. французский химик Жозеф-Луи Гей-Люссак за фиолетовый цвет его паров («иодос» по-гречески значит «фиолетовый», букв. «фиалкоподобный»). Он же получил многие производные нового элемента – иодоводород HI, иодноватую кислоту HIO3, оксид иода(V) I2O5, хлорид иода ICl и другие.
Практически одновременно элементарную природу иода доказал и английский химик Гэмфри Дэви. В 1813г. он предположил, что «вещество X» является химическим элементом, сходным с хлором и предложил назвать его йодином (англ. «iodine» — «йод») за фиолетовый цвет его газообразной формы.
В русской химической литературе начала XIXв. иод называли иодиний, иодис, иодий, иод. Часто встречающее теперешнее написание йод - неправильное, следует писать иод.
| 
| 
| 
|
| Бернар Куртуа (1777 – 1838) | Ж. Л. Гей-Люссак (1778–1850) | Гэмфри Дэви (1778–1829) |
II. HАХОЖДЕНИЕ И КРУГОВОРОТ ИОДА В ПРИРОДЕ
Иод никогда не встречается в природе в свободном состоянии и не концентрируется в достаточных для формирования самостоятельного минерала количествах. 
Иод — элемент редкий, более редкий, чем другие галогены (кроме At), его даже меньше, чем самых труднодоступных элементов семейства лантаноидов. Его кларк всего 400 мг/т (4·10–5%).
Но у иода есть одна особенность — крайняя рассеянность в природе. Будучи очень редким элементом, он присутствует практически везде. Иод есть в почве, в морской и речной воде, в растительных клетках и организмах животных, даже в сверхчистых кристаллах горного хрусталя.
А вот минералов, богатых иодом, очень мало. Наиболее известный из них – лаутарит Ca(IO3)2. Но промышленных месторождений лаутарита на Земле нет. Есть и другие минералы, но их ещё меньше — иодобромит Ag(Br, Cl, I), эмболит Ag(Cl, Br), майерсит CuI•4AgI. 
Запасы природных минералов иода оцениваются в 15 млн. тонн, 99% запасов в виде йодата NaIO3 и чилийской селитры NaNO3 находятся в Чили и Японии. В настоящее время в этих странах ведётся интенсивная добыча иода.
Известен иод в природе также и в свободной форме, в качестве минерала I2, но такие находки единичны, — в термальных источниках Везувия и на о. Вулькано (Италия).
Основным резервуаром иода для биосферы служит Мировой океан. В 1 литре морской воды в среднем содержится 5∙10-5 г иода (50 мг на 1 т воды) в качестве иона I- в составе иодида (соли йодистоводородной кислоты). Он также находится в морских водорослях, устрицах, печени трески и других обитателях соленых вод.

Как и большинство жизненно важных элементов, иод в природе совершает круговорот. Поскольку многие соединения иода хорошо растворяются в воде, иод выщелачивается из магматических пород, выносится в моря и океаны. Морская вода, испаряясь, подымает в воздух массы элементарного иода. Именно элементарного: соединения элемента №53 в присутствии углекислого газа легко окисляются кислородом до I2.
Из океана соединения иода, растворенные в каплях морской воды, попадают в атмосферу и переносятся ветрами на континенты. Местности, удаленные от океана или отгороженные от морских ветров горами, обеднены иодом. Иод легко адсорбируется органическими веществами почв и морских илов. При уплотнении этих илов и образовании осадочных горных пород происходит десорбция, часть соединений иода переходит в подземные воды. Так образуются используемые для добычи иода иодо-бромные воды, особенно характерные для районов нефтяных месторождений (местами 1 литр этих вод содержит свыше 100 мг иода).
Ветры, переносящие воздушные массы с океана на материк, переносят иод и дальше. Он вместе с атмосферными осадками выпадает на землю, попадает в почву, грунтовые воды, в живые организмы. Последние концентрируют иод, но, отмирая, возвращают его в почву, откуда он снова вымывается природными водами, попадает в океан, испаряется, и все начинается заново. Это лишь общая схема, в которой опущены все частности и химические преобразования, неизбежные на разных этапах этого вечного коловращения.
А изучен круговорот иода очень хорошо, и это не удивительно: слишком велика роль микроколичеств этого элемента в жизни растений, животных, человека.
III. ХАРАКТЕРИСТИКА ЭЛЕМЕНТА I
Иод (лат. Iodum) – химический элемент главной подгруппы 7 группы, V периода ПСХЭ Д.И. Менделеева.
Галоген, порядковый номер 53, относительная атомная масса 126.90447.
Электронная формула иода: 1s22s22p63s23p63d104s24p64d105s25p5.
Радиус нейтрального атома иода 0,136 нм. По шкале Полинга электроотрицательность иода 2,66, иод принадлежит к числу неметаллов.

Природный иод состоит только из одного изотопа — иода-127. Конфигурация внешнего электронного слоя …5s2p5. В соединениях проявляет степени окисления −1, 0, +1, +3, +5 и +7 (валентности I, III, V и VII).
Известны 37 изотопов иода с массовыми числами от 108 до 144. Из них только 127I является стабильным, период полураспада остальных изотопов иода составляет от 103 мкс до 1,57•107 лет; отдельные изотопы используются в терапевтических и диагностических целях.
Радиоактивный 125I образуется в результате естественного спонтанного деления урана. Из искусственных изотопов иода важнейшие – 131I и 133I; их используют в медицине для проверки функций щитовидной железы, для лечения зоба и рака щитовидной железы. Радиоактивный нуклид 131I распадается с испусканием β-частиц, а также с излучением γ-квантов, с периодом полураспада 8 дней.
IV. ХАРАКТЕРИСТИКА ПРОСТОГО ВЕЩЕСТВА
1. Физические свойства
Иод – единственный из галогенов находится в твердом состоянии при н.у. Иод - неметалл, но при этом обладает и некоторыми свойствами, характерными для металлов. В обычных условиях простое вещество йод – кристаллы фиолетово-черного цвета с металлическим блеском. Красивые кристаллы иода больше всего похожи на графит. Отчётливо выраженное кристаллическое строение, способность проводить электрический ток – все эти «металлические» свойства характерны для чистого иода. 
Иод летуч. В отличие от графита и металлов, иод очень легко переходит в газообразное состояние. При нормальном давлении кристаллы йода возгоняются (превращаются в пар минуя жидкое состояние), образуя фиолетовые пары с резким запахом. При охлаждении пары иода кристаллизуются, минуя жидкое состояние, оседая в виде блестящих тонких пластинок. Этим пользуются на практике для очистки иода от нелетучих примесей в лабораториях и в промышленности.
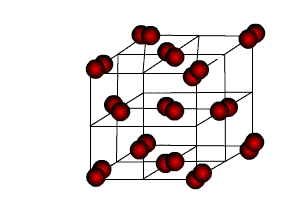
Молекула вещества двухатомна I2. Кристаллическая решетка молекулярная.
При быстром нагревании или нагревании в запаянном сосуде иод плавится, превращаясь в черную жидкость.
Плотность иода 4,94 г/см3, t пл. 113,5°С, t кип. 184,35°С. Молекулы жидкого и газообразного иода двухатомны (I2). Заметная диссоциация I2 ↔ 2I наблюдается выше 700°С, а также при действии света.
Иод плохо растворим в воде (0,33 г/л при 25°С), хорошо - в сероуглероде и органических растворителях (бензоле, спирте), а также в водных растворах иодидов, образуя фиолетовые или коричневые растворы. Фиолетовые растворы иода проводят электричество, так как в растворе молекулы I2 тоже частично диссоциируют на ионы I+ и I-.

2. Химические свойства
Химически иод довольно активен, хотя и в меньшей степени, чем его «братья» хлор и бром.
1. С металлами иод при легком нагревании энергично взаимодействует, образуя иодиды:
Hg + I2 = HgI2
2. С водородом иод реагирует только при нагревании и не полностью, образуя иодистый водород:
I2 + H2 = 2HI
3. Элементный иод — окислитель, хотя и менее сильный, чем хлор и бром, используется при различных синтезах и анализах. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I-:
I2 + H2S = S + 2HI
При взаимодействии с тиосульфатом натрия даёт йодид и тетратионат натрия. Реакция лежит в основе аналитического метода, называемого иодометрией:
2Na2S203 + I2 = Na2S4O5 + 2NaI
4. При растворении в воде иод частично реагирует с ней:
I2 + H2O = HI + HIO
5. В горячих водных растворах щелочей образуются соли йодноватистой (HIO) и йодноватой (HIO3) кислот иодид и иодат:
3I2 + 6NaOH = 5NaI + NaIO3 + 3H2O
6. Реакция образования нитрида трииода:
3I2 + 5NH3 = 3NH4I + NH3∙NI3↓
Нитрид трииода в сухом кристаллическом состоянии разлагается с выделением фиолетовых паров иода, что демонстрируется как эффектная химическая реакция.
7. Иод – как слабый восстановитель реагирует с концентрированными серной и азотной кислотами, образует соединения с другими галогенами.
А хлор и другие сильные окислители в водных растворах переводят его в IO3-:
5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl
8. Иодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трииодид калия, дихлороиодат(I) калия:
KI + I2 = KI3
Соединения. Иод образует ряд кислот: иодоводородную (HI), иодноватистую (HIO), иодистую (HIO2), иодноватую (HIO3), иодную (HIO4).
Иодиды интенсивно окрашены: AgI – светло-жёлтый, PbI – ярко-жёлтый, HgI – тёмно-красный и т. д.
Для получения HI из йодидов металлов можно использовать концентрированную фосфорную кислоту. Иодоводород (HI) ещё более неустойчив, чем бромоводород (HBr):
3NaI + H3PO4 = 3HI + Na3PO4
Концентрированная серная кислота является окислителем и поэтому для этой цели не годится:
8NaI + 5H2SO4(конц.) = 4Na2SO4 + H2S + 4I2 + 4H2O
Довольно известной качественной реакцией на иод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен и Анри-Франсуа Готье де Клобри.
Адсорбируясь на крахмале, иод окрашивает его в темно-синий цвет; это используется в иодометрии и качественном анализе для обнаружения иода.
Пары иода ядовиты и раздражают слизистые оболочки. На кожу иод оказывает прижигающее и обеззараживающее действие. Пятна от иода смывают растворами соды или тиосульфата натрия.

3. Получение иода
Существуют следующие способы добычи иода:
1. Переработка природных накопителей иода - морских водорослей и получение иода из их золы.
В 1т высушенной морской капусты (ламинарии) содержится до 5кг иода, в то время как в 1т морской воды его всего лишь 20-30мг. До 60-х годов XIX столетия водоросли были единственным источником промышленного получения иода. В России вплоть до 1915г. своего иода не было, его завозили из-за границы. Первый иодный завод был построен именно в 1915г. в Екатеринославе (сейчас Днепропетровск). Получали иод из черноморской водоросли филлофоры. За годы Первой мировой войны на этом заводе было добыто около 200 кг иода.
2. Получение иода из отходов селитряного производства - маточных растворов чилийской (натриевой) селитры, содержащей до 0,4 % иода в виде идата и иодида натрия.
Этот способ начал применяться с 1868г. и в силу дешевизны сырья и простоты получения микроэлемента получил широкое распространение в мире. Но в первую мировую войну поступление чилийской селитры и иода прекратилось, и начались новые пояски рентабельных способов получения иода.
3. Получение иода из природных иодсодержащих растворов, например воды некоторых соленых озер или попутных (буровых) нефтяных вод, содержащих обычно 20-40 мг/л иода в виде иодидов (местами 1 литр этих вод содержит свыше 100 мг иода). 
В нашей стране в годы советской власти иод стали получать из подземных и нефтяных вод Кубани, позже Туркмении и Азербайджана. В настоящее время нефтяные буровые воды служат основным сырьем для промышленного получения иода в России.
Но содержание иода в подземных водах и попутных водах нефтедобычи очень мало. В этом и заключается основная трудность получения иода. Нужно найти «химическую приманку», которая образует с иодом прочное соединение.
Первоначально такой «приманкой» оказался крахмал, потом соли меди и серебра, которые связывали иод в нерастворимые соединения. Испробовали керосин – иод хорошо растворяется в нем. Но все эти способы оказались дорогостоящими, а порой и огнеопасными.
Советский инженер В.П. Денисович разработал угольный метод извлечения иода из нефтяных вод, и этот метод уже довольно долго является основой советского иодного производства. В килограмме угля за месяц накапливается до 40 г иода. Процесс идет примерно так:
Для извлечения иода из нефтяных вод (содержащих обычно 20 – 40 мг/л иода в виде иодидов) на них сначала действуют хлором или азотистой кислотой. Выделившийся иод либо адсорбируют активным углем, либо выдувают воздухом. На иод, адсорбированный углем, действуют едкой щелочью или сульфитом натрия. Из продуктов реакции свободный иод выделяют действием хлора или серной кислоты и окислителя, например дихромата калия. При выдувании воздухом иод поглощают смесью двуокиси серы с водяным паром и затем вытесняют иод хлором. Сырой кристаллический иод очищают возгонкой.
4. Ионитный способ основанн на избирательном поглощении иода особыми химическими соединениями - высокомолекулярными ионообменными смолами.
Этот способ был разработан сравнительно недавно, успешно используется в иодной промышленности Японии. Применяли его и в России, но низкое содержание йода в природных водах не позволяет извлечь из них весь иод. Нужны более избирательные к иоду и более "емкие" иониты, и тогда появятся новые производства, о которых пока можно лишь мечтать.
V
V. ПРИМЕНИЕ ИОДА И ЕГО СОЕДИНЕНИЙ
Иод и его соединения применяют главным образом в медицине. Препараты, содержащие йод, обладают антибактериальными и противогрибковыми свойствами, они оказывают также противовоспалительное и отвлекающее действие; их применяют наружно для обеззараживания ран, подготовки операционного поля.
При приеме внутрь препараты йода оказывают влияние на обмен веществ, усиливают функцию щитовидной железы.
5%-ый спиртовой раствор иода используется для дезинфекции кожи вокруг повреждения (рваной, резаной или иной раны), но не для приёма внутрь. Продукты присоединения иода к крахмалу, другим ВМС (т. н. «Синий йод» — Йодинол, Йокс, Бетадин и др.) являются более мягкими антисептиками.
При большом количестве внутримышечных уколов, на месте уколов пациенту регулярно делается иодная клетка (это научный медицинский термин), в просторечии называемая иодной сеткой, — иодом рисуется сетка на площади, в которую делаются уколы (напр. на ягодицах). Это нужно для того, чтобы быстро рассасывались желваки, образовавшиеся в местах уколов.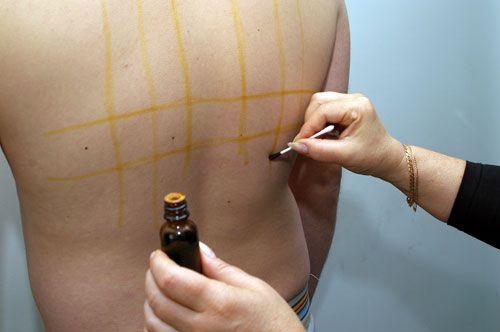
В медицинской практике иодорганические соединения используется для рентгенодиагностики. Достаточно тяжелые ядра атомов иода рассасывают рентгеновские лучи. При введении внутрь организма такого диагностического средства получают исключительно чёткие рентгеновские снимки отдельных участков тканей и органов.
Иод нужен не только медикам, но ещё он нужен геологам и ботаникам, химикам и металлургам…
В промышленности применение иода пока незначительно по объему, но весьма перспективно. Так, на термическом разложении иодидов основано получение высокочистых металлов – кремния, титана, гафния, циркония.
Иодные препараты используют в качестве сухой смазки для трущихся поверхностей из стали и титана. Всего 0,6% иода, добавленного к маслам, во много раз снижает трение в подшипниках из нержавеющей стали и титана. Это позволяет увеличить нагрузку на трущиеся детали более, чем в 50 раз. 
В радиоэлектронной промышленности в последние годы резко повысился спрос на иод для производства жидкокристаллических дисплеев. 
Химическая промышленность использует иод как катализатор в производстве искусственных каучуков.
В технике иод используется в источниках света: в металлогалогеновых дуговых лампах в качестве газовой среды разряда используются галогениды ряда металлов, использование различных смесей которых позволяет получать лампы с большим разнообразием спектральных характеристик. 
Иод используется в качестве компонента положительного электрода (окислителя) в литиево-иодных аккумуляторах для электромобилей.
Некоторые иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах иода (исследования в области лазерного термоядерного синтеза в промышленности). 
Сравнительно недавно иод стали использовать в производстве ламп накаливания, работающих по иодо – вольфрамовому циклу. Иод соединяется с частичками W, испарившегося со спирали лампы, образует соединение WI2, которое, попав на нагретую спираль, разлагается. Вольфрам при этом вновь возвращается на спираль, а иод опять соединяется с испарившимся вольфрамом. Иод как бы заботится о сохранении вольфрамовой спирали и тем самым значительно увеличивает время работы лампы. Колба такой лампы заполнена не инертным газом, а парами иода. 

Иод применяют для изготовления специального поляроидного стекла. В стекло вводят кристаллы солей иода, которые распределяются строго закономерно. Колебания светового луча не могут проходить через них во всех направлениях. Получается своеобразный фильтр, называемый поляроидом, который отводит встречный слепящий поток света. Такое стекло используют в автомобилях. Комбинируя несколько поляроидов или вращая поляроидные стёкла, можно достигнуть исключительно красочных эффектов – это явление используют в кинотехнике и в театре.
Так же соединения иода используют в фотоделе (фотографии и кинопромышленности) для приготовления специальных фотоэмульсий и фотопластинок.
Современный способ фотографирования был изобретён англичанином У.Толботом. В основе его способа фотографии лежит фотохимическая реакция разложения галогенидов серебра под действием света:
Ag (Галл) + hγ = Ag + (Галл), где hγ – квант света.
В современном фотографическом процессе для получения негативов используется слой фотографической эмульсии – смеси мельчайших кристалликов иодистого или бромистого серебра (AgI, AgBr) с желатиной (белковым веществом, «животным клеем»), - нанесённый на прозрачную подложку из стекла или полимерной плёнки. Под действием света в этой эмульсии образуется лишь ничтожное количество металлического серебра. При последующем проявлении, т.е. при обработке фоточувствительного материала водным раствором органического восстановителя, реакция восстановления ускоряется под действием первичных частиц металлического серебра, она идёт преимущественно в тех местах, куда падал свет. Затем с помощью тиосульфта натрия (Na2S2O3∙5H2O), образующего водорастворимую комплексную соль с галогенидом серебра, с фотографии удаляют невосстановленный избыток галогенида. Эта стадия называется закреплением или фиксацией изображения. Промывка, сушка – и негатив готов.
Иод и его соединения используются в лабораторной практике для анализа и в хемотронных приборах, действие которых основано на окислительно-восстановительных реакциях иода... Например, в криминалистике пары иода применяются для обнаружения отпечатков пальцев на бумажных поверхностях, например на купюрах.
Подобно другим галогенам, иод образует многочисленные иодорганические соединения, которые входят в состав некоторых красителей.
И наконец, если грозовое облако «засеять» иодистым серебром или иодистым свинцом, то вместо града в облаке образуется мелкодисперсная снежная крупа: засеянное такими солями облако проливается дождем и не вредит посевам.
БИОЛОГИЧЕСКАЯ РОЛЬ ИОДА
1. Иод внутри нас
Иод – один из важнейших микроэлементов и присутствует во всех живых организмах. Его содержание в растениях зависит от присутствия его соединений в почве и водах.
Морские водоросли (морская капуста, или ламинария, фукус и другие) накапливают до 1% иода. Иод входит в скелетный белок губок и скелетопротеинов морских многощетинковых червей.
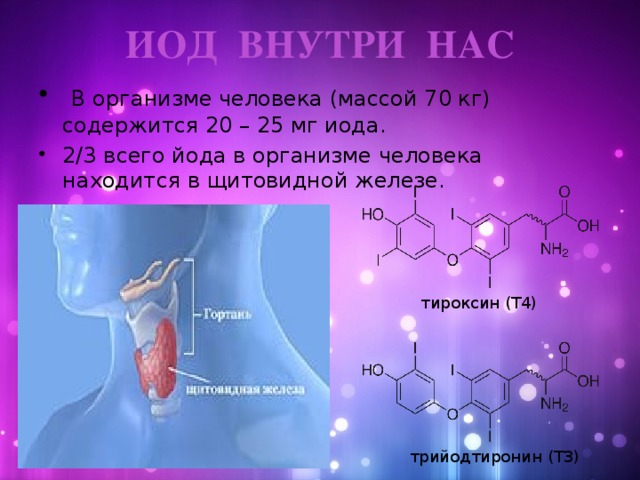
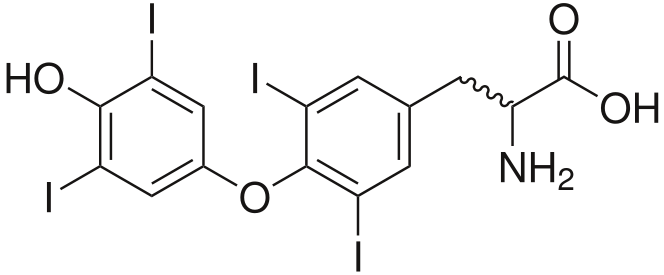
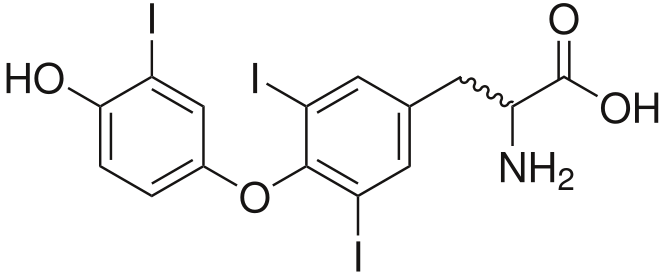
В организме человека (масса тела 70 кг) содержится 20 – 25 мг иода. Это довольно маленькое количество, но значение этого элемента очень велико. 2/3 всего йода в организме человека находится в щитовидной железе. Биологическое значение йода состоит в том, что он является составной частью молекул тиреоидных гормонов вырабатываемых щитовидной железой: тироксина (Т4), содержащего 4 атома йода, и трийодтиронина (ТЗ) с 3 атомами йода. 
|  | 
|
| тироксин (Т4) | трийодтиронин (ТЗ) |
Эти гормоны оказывают многостороннее воздействие на рост, развитие и обмен веществ организма. Тиреоидные гормоны повышают:
- потребность тканей в кислороде;
- системное артериальное давление, частоту и силу сердечных сокращений;
- уровень бодрствования, психическую энергию и активность;
- скорость мыслительных ассоциаций;
- двигательную активность;
- температуру тела и уровень основного обмена.
Иод выполняет в организме очень важные функции. При наличии в организме достаточного количества, иод, сосредоточиваясь в основном в щитовидной железе, за каждый цикл кровообращения – 17 минут – убивает нестойких микробов, тем или иным способом попавших в кровь. Стойкие микробы ослабляются при прохождении крови через щитовидную железу и через несколько циклов кровообращения погибают. При низком содержании иода щитовидная железа лишается необходимого ей для нормального функционирования элемента.
Иод облегчит соблюдение диеты, сжигая избыточный жир, способствует правильному росту, придает больше энергии, улучшает умственную активность, делает волосы, ногти, кожу и зубы здоровыми.
Суточная потребность в иоде определяется возрастом, физиологическим состоянием и массой тела. ВОЗ установила, что человеку среднего возраста нормальной комплекции (нормостеник, масса тела 70 кг) в сутки нужно 100 - 200 мкг (мкг - это миллионная доля грамма) иода. Суточная потребность в иоде увеличивается у беременных и кормящих грудью женщин, в условиях очень высоких или низких температур окружающей среды, при недостатке кислорода.
За всю жизнь человек потребляет около 3–5 граммов йода, что эквивалентно содержимому примерно одной чайной ложки.
Поступление йода в организм происходит, в основном, через пищеварительный тракт, а также через легкие с вдыхаемым воздухом и меньше - через кожу.
Основные источники йода:
• морепродукты, растущие в богатых йодом морских водах: морская капуста, рыба, рыбий жир, мидии, креветки;
• овощи: свекла, салат, шпинат, помидоры, морковь, картофель, лук репчатый, фасоль, чеснок;
• фрукты, ягоды, орехи: хурма, яблоки, виноград, вишня, сливы, абрикосы, фейхоа, земляника, грецкие и кедровые орехи;
• крупы: гречневая, пшено;
• молочные продукты: сыр, творог, молоко.
В мясе животных йода не много. (См. Приложение)
Отсутствие или недостаток иода в рационе (что типично для некоторых местностей) приводит к заболеваниям.
2. Реакция организма на недостаток элемента иод
Медики давно обратили внимание на то, что многие болезни связаны с недостаточностью поступления и содержания в организме определенных макро- и микроэлементов. В конце прошлого века была доказана роль дефицита иода в патогенезе эндемического зоба.
Постоянная нехватка йода в организме становится видна «невооружённым глазом» практически сразу – увеличивается щитовидная железа, а с этим - сухая кожа, ломкие ногти, долго не проходящие синяки, герпес. Также при небольшом недостатке иода отмечается быстрая утомляемость, головная боль, подавленное настроение, нервозность и раздражительность, снижение физических и интеллектуальных возможностей, иммунитета, слабеет память и интеллект. Со временем появляется аритмия, повышается артериальное давление, падает уровень гемоглобина в крови.
Прогрессируя, развивается болезнь – эндемический зоб (базедова болезнь) – она поражает многие системы организма, нарушается обмен веществ, замедляется рост. В отдельных случаях эндемический зоб может привести к глухоте, к кретинизму... Недостаточность иода считается главной причиной задержки умственного развития.
История заболеваний щитовидной железы, вызванных дефицитом иода, стара как сама цивилизация. Древнекитайские врачи первыми заметили связь между увеличением щитовидной железы - зобом, низкой умственной деятельностью и качеством питьевой воды. Они применяли для лечения зоба щитовидную железу оленя, а также морские водоросли.
А вот в Средневековье слегка увеличенную и отекшую шею у женщин считали признаком привлекательности, даже изображения Иисуса и Мадонны имели выраженный зоб.
В XVIII веке уже была известна зависимость нормального функционирования щитовидной железы от поступления йода в организм. В 1750г. Руссел применил иодсодержащую морскую воду для лечения зоба, а в 1852г. Шатен привел доказательства зависимости между низким содержанием йода в питьевой воде и зобом.
О широком распространении болезни можно судить по произведениям живописи. Один из лучших женских портретов Рубенса - «Соломенная шляпка». У красивой женщины, изображенной на портрете, заметна припухлость шеи (врач сразу сказал бы: увеличена щитовидка). Те же симптомы (признаки иодной недостаточности) видны у некоторых людей, изображенных на портретах и картинах многих известных художников.
| 
| 
| 
|
| Рубенс, Петер Пауль – «Соломенная шляпа» | Леонардо да Винчи, «Мадонна с гвоздикой» | II жена короля Англии Генриха VIII Анна Болейн |
В начале XIX века проблема зоба была актуальна. Наполеон приказал исследовать зоб новобранцев своей армии. Как выяснилось многие из них, особенно из ряда горных районов были непригодны к воинской службе.
В настоящее время признано, что иодный дефицит является естественным и всеобщим природным феноменом. Отсутствие дефицита иода в той или иной популяции может быть связано либо с адекватно проводимой массовой иодной профилактикой, либо со специфическим характером питания, например, как в Японии, где потребляется очень большое количество богатых йодом морепродуктов.
Российская статистика неутешительна. Базедовой болезнью в той или иной форме болеют около 20% граждан. Иодный дефицит имеет место во многих других странах. Дефицитом иода страдают около 1,5 миллиарда человек в мире, в России – 70%.
Эндемический зоб больше распространен в горных районах и в местах, сильно удаленных от моря.
В нашей стране, большинство областей которой удалены от моря, борьба с эндемическим зобом ведется постоянно – прежде всего, средствами профилактики. Простейшее и надежнейшее средство – добавка микродоз иодидов к поваренной соли. Это значит: к поваренной соли NaCl, поступающей в продажу с профилактической целью, добавляют иодид калия KI, иодид натрия NaI или иодат калия KIO3 (иодированная соль). 
Значение иодированной соли в профилактике зоба было ярко продемонстрировано в Швейцарии. Зоб и кретинизм были широко распространены на территории всей страны, что связано с ее расположением в высокогорных районах Европейских Альп. При использовании иодированной соли распространенность зоба резко снизилась. Вскоре были закрыты или перепрофилированы учреждения для глухих и слабоумных.
Применение удобрений, содержащих иод, может удвоить и утроить его содержание в сельскохозяйственных культурах. Кроме иодирования соли в последние годы стали широко применять иодирование других продуктов. Иод добавляют в некоторые хлебобулочные изделия, молоко и пр.
Сегодня ученые разработали новационный препарат - "Йодис", который содержит активный йод, защищающий щитовидную железу и весь организм. Именно йод в воде Йодис способствует восстановлению жизненных сил и тонуса, предотвращая проблемы со щитовидной железой.
| 
| "Йодис-концентрат"- вода, насыщенная биологически активным йодом. 2 чайные ложки обеспечат суточную потребность человека в йоде! Через 2 недели йодный статус будет в норме! | 
|
Всё большее распространение получают так называемые БАДЫ «биологически активные добавки», содержащие иод, такие как Иод – актив, Иодомарин, Цыгапан, Кламин, и некоторые другие. Одним из самых известных препаратов для восполнения содержания иода в организме считается «Иод – актив». Но помним, что дополнительные препараты назначает врач.



 Проблема нехватки иода все ещё волнует граждан во всём мире.
Проблема нехватки иода все ещё волнует граждан во всём мире.
Весной 2013г. Г. Онищенко, будучи на посту руководителя Роспотребнадзора, предложил йодирование хлеба (KI), мотивируя свое решение данными о хроническом недостатке йода в организмах россиян.
3. Избыток иода в организме
Как недостаток, так и избыток йода в организме оказывается вреден для него, хотя встречается очень редко.
Если принять йода чуть больше положенного - свыше 2 г, то может возникнуть:
отек горла или легких;
галлюцинации;
бессонница;
во рту присутствует металлический привкус;
жжение и боль в зобе;
постепенно затрудняется дыхание;
начинает мучить жажда;
появляется насморк;
возможны и аллергические реакции: тошнота, кровавая рвота;
нередки случаи смертельного исхода.
Смертельная доза 3 г. Вызывает поражение почек и сердечно-сосудистой системы. Интересно, что иод более токсичен для людей с дефицитом селена.
Накопление повышенного содержания йода в органах и тканях организма приводит к гипертиреозу. В этом случае наблюдаются такие симптомы избытка йода, как мышечная слабость, повышенная раздражительность, нередко потливость. Человек худеет, появляется склонность к диарее. Ускоряются обменные процессы.
Но всё это касается только чистого элемента иода. А неорганические соли иода – иодиды – вполне безвредны.
Даже если после приема большого количества иодидов концентрация иода в крови повысится в 1000 раз, то уже спустя 24 часа она придет в норму. Выводится иод из организма почками и слюнными железами.
При этом не следует забывать, что у некоторых людей выражена индивидуальная непереносимость иода, тогда даже малые его количества приведут к практическим заболеваниям.
ПДК иода в воде 0,125 мг/дм³, в воздухе 1 мг/м³.
VII. ИНТЕРЕСНЫЕ ФАКТЫ О ИОДЕ
В среде, насыщенной иодом, наблюдаются совершенно необычные формы жизни животных и растений. Так, например, позвоночные, обитающие в океане, имеют рекордный вес и высокую продолжительность жизни, типичными представителями которых являются самое крупное животное нашей планеты - голубой кит (его длина достигает 30 м, а вес - 150 т), а так же морские черепахи, живущие по 2-3 столетия и т.д. При этом родственники черепах - ящерицы, живущие на суше, где среда обитания не насыщенна иодом, имеют весьма скромные размеры, с продолжительностью жизни не более 20-30 лет.
Аналогичные явления наблюдаются и в растительном мире. В приморских областях высота хлебных злаков достигает 2.5 м, дикорастущих трав - до 4-х м. Вдоль Тихоокеанского побережья Калифорнии произрастают исполинские секвойи, или мамонтовые деревья. Диаметр их стволов равен 10 м и более, а высота 140-160 м. Средний возраст секвойи - около 4500 лет, а самые старые из них могут достигать возраста 6-9 тысяч лет.
Известный учёный, а также пропагандист иодотерапии В. О. Мохнач считал, что единственным условием для произрастания этих чудо-деревьев является насыщенный иодом морской туман Тихоокеанского побережья.
А знаете ли вы что:
• Уделяли внимание заболеваниям щитовидной железы не только медики, но и главнокомандующие. Например, Наполеон, осуществляя набор солдат в свою армию, с особенной тщательностью осматривал у претендентов шею. Причем наибольшее внимание уделялось призывникам, выросшим в горных местностях, где болезни щитовидной железы были наиболее часты.
• По данным исследований, проведенных Научным центром охраны здоровья детей, больше половины младенцев имеют нарушения в телосложении и отставание в физическом развитии. У некоторых даже отмечается глухонемота. А причина этого кроется в дефиците йода.
• Если грозовое облако «засеять» йодистым серебром или йодистым свинцом, то вместо града в облаке образуется снежная крупа: засеянное такими солями облако проливает дождём и не вредит полям.
VIII. ПРАКТИЧЕСКАЯ ЧАСТЬ
Мы выполнили несколько практических опытов с участием иода.
1. Взаимодействие алюминия с йодом - занимательный опыт по химии, вызывает большой интерес у школьников. Мы его продемонстрировали детям 5-х классов.
Компоненты: порошок алюминия и кристаллический йод, мелко растертый в ступке.
Все смешали в пропорции примерно 2 части алюминия к 1 части йода, насыпали небольшой горкой в фарфоровую чашечку, стоящую на огнеупорной поверхности. Сверху кучки сделали углубление, куда накапали 2-3 капли воды. Через некоторое время начал появляться фиолетовый дымок паров йода, и мы увидели горение металла.



Почему же после добавления воды начинает идти реакция? Здесь все просто. После добавления воды, йод вступает в реакцию с ней, образуя йодоводородную кислоту. Оксидная пленка алюминия, растворяется в ней, и начинает идти реакция непосредственно алюминия и йода.
I2 + H2O = HI + HIO
Al2O3 + 6HI = 2AlI3 + 3H2
2. Получение взрывчатого вещества из иода – этот опыт называют «приколом» юного химика.
Компоненты: 10% раствор аммиака, кристаллический иод.
Кристаллы иода растерли в ступке, высыпали в стакан, добавили туда же охлажденный аммиак, чтобы он полностью покрыл кристаллы. Образовался черный осадок (азид иода или нитрид трииода):
3I2 + 5NH3 = 3NH4I + NH3∙NI3↓
Выделившийся осадок отфильтровали, используя несколько фильтров. Фильтры оставили сушиться.
Мы знали, что во влажном виде этот порошок не взрывается, но если дать ему высохнуть, то он становится таким чувствительным, что взрывается от самого слабого воздействия, например от простого прикосновения. Это термодинамически неустойчивое вещество. Мы планировали показать эту «волшебную взрывчатую бумагу» детям, кстати, она совершенно безопасна.
Но опыт до конца не удался. Дело в том, что порошок высох слишком быстро (вследствие рядом находящейся батареи) и его детонация произошла без нас. Звуки слабых взрывов, похожие на пулеметную очередь, услышали воспитатели, у которых в соседнем кабинете состоялось совещание. А мы на следующий день увидели только то, что осталось.
3. Получение «синего иода» - чудо-опыт, при котором прозрачная жидкость в одно мгновение становится темно-синей. Но по большому счету, «синий иод» – это лекарство, которое можно сделать в домашних условиях и успешно употреблять.
Иод, включенный в молекулу высокополимера (крахмала), полностью сохраняет и даже усиливает свои антимикробные свойства и вместе с тем щадяще действует на микрофлору желудочно-кишечного тракта.
Но сегодня бурный расцвет антибиотиков вновь возвращается к натуральным средствам, одними из которых являются иодвысокополимеры.
Компоненты: 3 емкости для жидкости, 1 таблетка (1000 мг) витамина С, раствор йода спиртовой 5%, перекись водорода 3%, крахмал, мерные ложки, мерные чашки.
План работы:
1. Хорошенько разомяли 1000 мг витамина С ложкой в чашке, превратив таблетку в порошок. Добавили 60 мл теплой воды, тщательно перемешали. Полученная жидкость - Раствор А (условно).
2. Налили 1 чайную ложку (5 мл) Раствора А в другую емкость, добавили в нее: 60 мл теплой воды и 5 мл спиртового раствора йода. Обратили внимание, что коричневый йод, втупив в реакцию с витамином С, стал бесцветным. Полученная жидкость - Раствор В. (Раствор А больше не нужен).
3. В третьей чашке смешали 60 мл теплой воды, 1/2 чайных ложки (2.5 мл) крахмала и одну столовую ложку (15 мл) перекиси водорода. Это - Раствор С.
4. Теперь все приготовления завершены, следует сам эффект. Перелили весь Раствор В в чашку с Раствором С. Несколько раз попереливали полученную жидкость из одной чашку в другую и обратно. Через какое-то время жидкость из бесцветной превратилась в темно-синюю.
Объяснение опыта: йод, вступая в реакцию с крахмалом, окрашивает его в синий цвет. Витамин С, наоборот, старается сохранить йод бесцветным. В борьбе между крахмалом и витамином С, в конце концов, побеждает крахмал, и жидкость через какое-то время окрашивается в темно-синий цвет..
В интернете можно найти и немного другие рецепты по приготовлению синего иода. Но, все они дают полезный продукт.
В старые времена синий йод применяли для лечения дизентерии, отложения солей, а главное, заболевания щитовидной железы при ее пониженной функции. Принимая по одной чайной ложке синего йода в день, можно избавиться от хронического стресса и раздражительности.
Сейчас средство полезно, как профилактическое средство для восполнения йода в организме, а его дефицит приводит к серьезным нарушениям здоровья.
Пить его рекомендуется 1 раз в день через 30 минут после еды от 1 до 8 чайных ложек, детям — в 2 раза меньше, запивая молоком или киселем. После пяти дней приема сделать пятидневный перерыв, затем лечение продолжить, время от времени повторяя пробу на содержание йода в организме.
При аллергической реакции можно принять натощак две таблетки активированного угля. Противопоказания: гиперфункция щитовидной железы, кровотечения, язва желудка и двенадцатиперстной кишки.
Хранить синий йод лучше всего на нижней полке холодильника.
4. Проведение теста на содержание иода в организме учащихся 10б класса.
Прежде чем прибегать к лечению синим йодом или другим лекарственным средством, надо проверить, достаточно ли йода в организме. Для этого можно нанести немного обычного йода на внутреннюю сторону локтевого сгиба. Если за 8 часов пятно исчезнет, то организм испытывает йододефицит; если пятно будет заметно в течение 12 часов, йода в организме хватает и принимать его не следует.
Именно такую проверку я выполнила с моими одноклассниками.
Через несколько часов я проверила результат. У всех наших ребят следов на локтевом сгибе не осталось. Значит, увы, иода у нас не хватает.
При проведении такого теста надо помнить, что у некоторых людей есть химическая чувствительность к йоду. При нанесении им на кожу йода может образовываться сыпь. В редких случаях использование йода может привести к анафилактическому (аллергическому) шоку.
ЗАКЛЮЧЕНИЕ
Мое знакомство с элементом иод оказалось очень полезным. Я узнала, насколько он нужен и важен! В наше время иод нашёл широкое применение в промышленности, технике, фотоделе, даже в вопросах влияния на погоду. Но самое главное, он нужен в медицине и не только как антисептическое средство, а как микроэлемент, который поддерживает здоровье щитовидной железы. А это значит, что иод - жизненно важный человеческому организму элемент.
ВОЗ признала глобальной проблему заболеваний, возникающих вследствие дефицита йода в рационе питания. Статистические данные свидетельствуют о том, что от недостатка йода в мире страдает примерно 1,5 млрд. человек, половина из этого числа – в зоне риска. Россия, к сожалению, входит в число стран, в которых потребление иодосодержащих продуктов на душу населения, намного ниже нормы.
Оказывается, ребенок, экс-отличник, может резко съехать на тройки и стать каким-то вялым… У человека, ранее способного к обучению, появились проблемы с памятью? Появились другие симптомы? Сделайте самодиагностику, а ещё лучше - тесты на гормоны: Т3, Т4 и ТТГ. С их результатами, конечно, надо обратиться к медикам. Возможно, и у вас дефицит иода.
Озабоченность медиков объясняется тем, что йододефицит угрожает не только состоянию здоровья, но и жизни.
Изучение свойств иода привело к появлению биологически активных добавок, которые содержат этот микроэлемент. И я надеюсь, что дальнейшее изучение иода приведёт к открытию новых возможностей применения этого элемента.
Однако, насколько опасна нехватка иода в организме человека, настолько же негативно сказывается на здоровье и повышенное содержание этого микроэлемента.
Я думаю, что весь изложенный мною материал поможет не только мне, но и остальным людям, избежать болезней и узнать, что же в действительности представляет иод, и для чего он нужен.
В практической части своей работы я выполнила опыты с иодом, которые мне понятны и интересны. Я убедилась, что работа над подобным проектом дает большой шаг в моем развитии, и надеюсь, что для меня эта работа – не последняя.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Популярная библиотека химических элементов. Изд. «Наука» Москва 1973г.
2.Химия. Энциклопедия для детей. Под редакцией Виктора Володина – «Аванта+» Москва 2000г.
3. Человек. Энциклопедия для детей. Под редакцией Виктора Володина – «Аванта+» Москва 2002г.
4. Любознательным о химии. Б.Н.Токарев. Москва, издательство «Химия», 1978г.
5. Аликберова Л.Ю. Занимательная химия: Книга для учащихся, учителей и родителей. – М.: АСТ-ПРЕСС, 1994.
6. Степин Б.Д; Аликберова Л.Ю. Книга по химии для домашнего чтения. – 2-е изд. – М.: Химия, 1995.
7. http://www.calorizator.ru - Анализируй то, что ты ешь! Йод (I, Iodum)
8. http://tatyana68.ucoz.ru Любознайка. 9 фактов о йоде: и польза, и вред, и… суши.
9. https://ru.wikipedia.org/ Википедия - свободная энциклопедия. Иод.
10. http://n-t.ru/ri/ps/pb053.htm Популярная библиотека химических элементов. Иод.
11. http://xreferat.ru. Реферат. Йод.
12. http://www.medeffect.ru/ Эффективная медицина. Добыча иода.
13. http://eto-vredno.ru/yod/ Польза и вред. Йод - вред и польза.
14. http://iodis.com.ua/Kompaniya/company. Интересное о йоде.
15. http://zoj.org.ru/nakladyivaem-yodnuyu-setku/Лечение в домашних условиях. Йодная сетка на горло и грудь при кашле.
17













































 Проблема нехватки иода все ещё волнует граждан во всём мире.
Проблема нехватки иода все ещё волнует граждан во всём мире.