Цель работы:
Методическая разработка темы “Окислительно-восстановительные реакции” с использованием инновационных технологий.
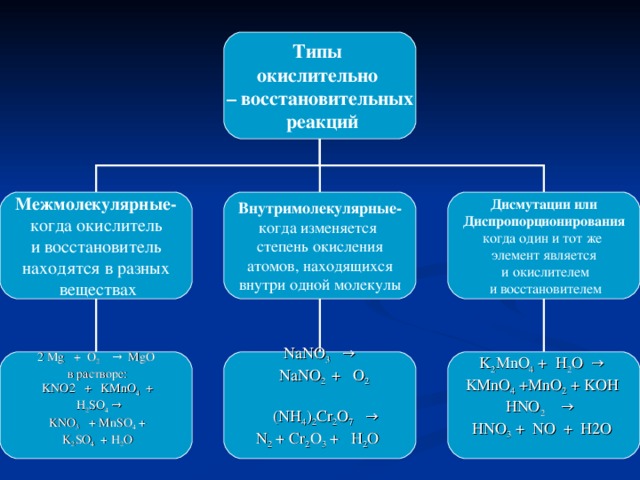
Окислительно-восстановительные реакции
nэто процессы, в результате которых происходит переход или смещение валентных электронов от атомов с меньшей электроотрицательностью к атомам с большей электроотрицательностью. Примеры:
nH2 + Cl2 = 2HCl
nCl2 + H2O = HClO + HCl
n2KClO3 = 2KCL + 3O2
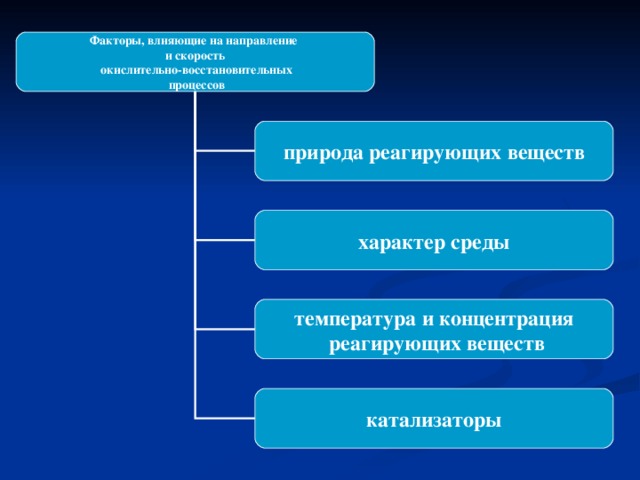
....
Инновация – нововведение, новация, новизна, введение новизны.
Инновационные технологии в обучении – это введение нового содержания, новых методов, приёмов, средств в обучении.
Схема перегруппировки учащихся
...
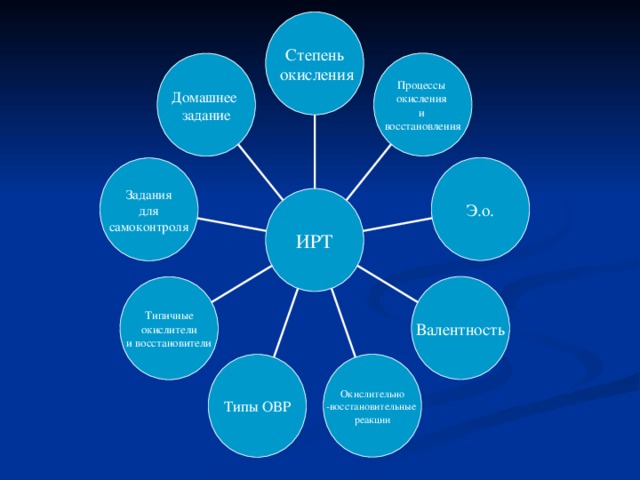
Интерактивная рабочая тетрадь(фрагмент I )
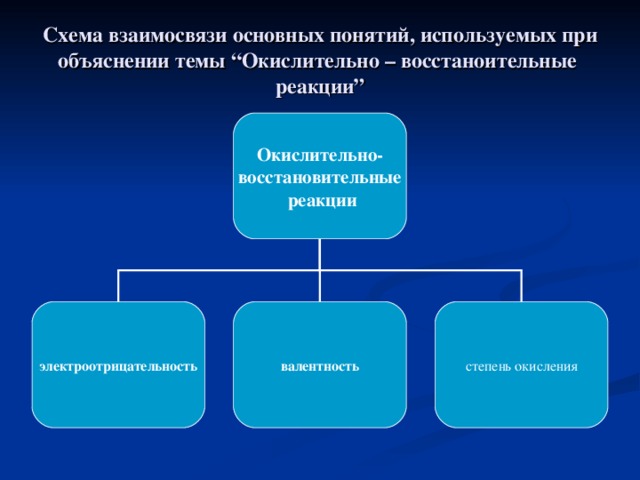
nОпределите степень окисления марганца, хрома в следующих соединениях: K2MnO4, KMnO4, K2CrO4, K2Cr2O7.
nДана схема уравнения реакции: K2SO3+H2SO4+KMnO4=K2SO4 + MnSO4 + … составьте уравнения ОВР и укажите возможный “пропущенный” продукт реакции.
nВалентность – это число общих связей в молекуле. Определите валентность элементов по формулам: HgO, K2S, B2O3, ZnO, MnO2, NiO, Cu2O, SnO2.
nДаны уравнения реакций: Zn + Cl2 = ZnCl2 , Zn + 2HCl = ZnCl2 + H2. Проставьте над знаками соответствующих химических элементов степени окисления и покажите переход электронов.
nСоставьте уравнение ОВР, используя метод полуреакций: MnO2 + KClO3 + KOH = …... Чему равна сумма коэффициентов уравнения реакции? а) 14, б) 16, в) 11, г) 17.
n
Интерактивная рабочая тетрадь(фрагмент II )
nСтепень окисления – это ......................................
nПорассуждайте, в чём сходство и отличие понятия “степени окисления” с понятием ”валентность”.................................................................................................................................................
nОпределите типы ОВР: а) H2S+ 8HNO3 = H2SO4 +8NO2 + 4H2O (….); б) 2H2S + H2SO3 = 3S + 3H2O (….); в) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 (….)
nУкажите восстановитель и окислитель в реакциях: a) 2Al + 6HCl = 2AlCl3 + H2(….); б) 2H2S + H2SO3 = 3S + 3H2O (….); в) 8HI + H2SO4 = 4I2 + H2S + 4H2O (….); г) 2KClO3 = 2KCL + 3O2 (….)
nСтепень окисления – это ......................................
nПорассуждайте, в чём сходство и отличие понятия “степени окисления” с понятием ”валентность”.................................................................................................................................................
nОпределите типы ОВР: а) H2S+ 8HNO3 = H2SO4 +8NO2 + 4H2O (….); б) 2H2S + H2SO3 = 3S + 3H2O (….); в) 2Pb(NO3)2 = 2PbO + 4NO2 + O2 (….)
nУкажите восстановитель и окислитель в реакциях: a) 2Al + 6HCl = 2AlCl3 + H2(….); б) 2H2S + H2SO3 = 3S + 3H2O (….); в) 8HI + H2SO4 = 4I2 + H2S + 4H2O (….); г) 2KClO3 = 2KCL + 3O2 (….)
...
Проведённая работа:
nПодготовлена методическая разработка проведения занятия по теме: ” Окислительно-восстановительные реакции”, с использованием инновационных технологий, рассчитанного в соответствии с календарно-тематическим планированием по химии для 8 классов на 3 часа по 1 часу;
nДля занятий разработана, в соответствии с учебной программой для общеобразовательных школ, интерактивная рабочая тетрадь(ИРТ)по данной теме.
...