Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Газовые законы.Изопроцессы.
Цели урока:
1. Создать условия по изучению изопроцессов термодинамических параметров, графики изопроцессов, математическая запись законов, объяснение с точки зрения МКТ.
2. Продолжить формирование стремления к глубокому усвоению знаний через решение задач.
3. Научить применять полученные знания в нестандартных ситуациях для решения задач.
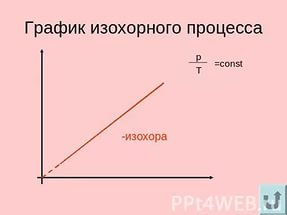
На этом уроке мы продолжим изучать связь между тремя макроскопическими параметрами газа, а конкретнее – их взаимосвязь в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных.
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Газовые законы.Изопроцессы.»
Полезное для учителя
Распродажа видеоуроков!
1770 руб.
2530 руб.
1880 руб.
2690 руб.
2100 руб.
3000 руб.
1830 руб.
2620 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства

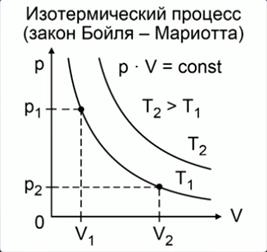
 пределение. Изобарный (или изобарический) процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении давления. Впервые такой процесс рассмотрел французский учённый Жозеф-Луи Гей-Люссак (рис. 4), поэтому закон носит его имя. Запишем этот закон
пределение. Изобарный (или изобарический) процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении давления. Впервые такой процесс рассмотрел французский учённый Жозеф-Луи Гей-Люссак (рис. 4), поэтому закон носит его имя. Запишем этот закон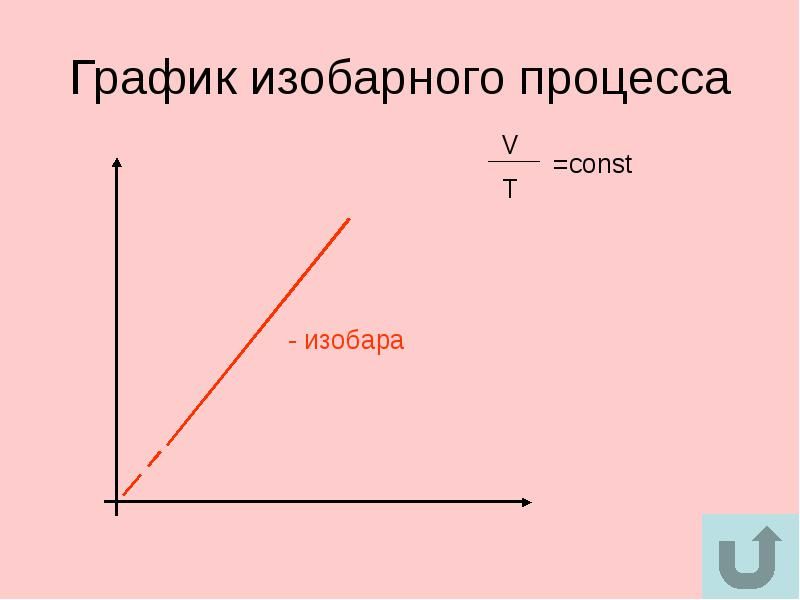 ис. 3. Графики изобарных процессов в координатах V-T (Источник)
ис. 3. Графики изобарных процессов в координатах V-T (Источник)