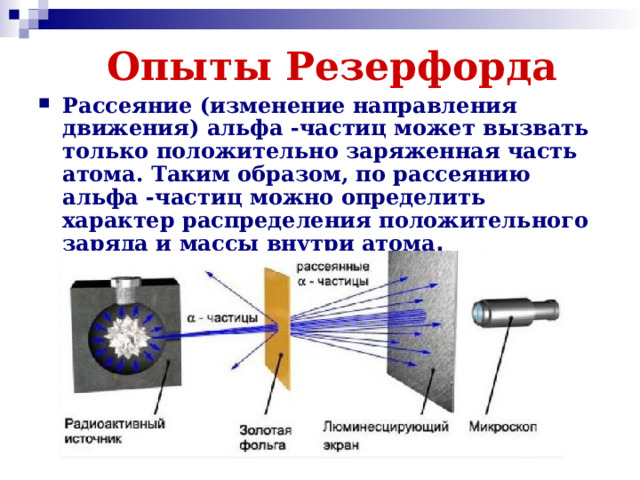
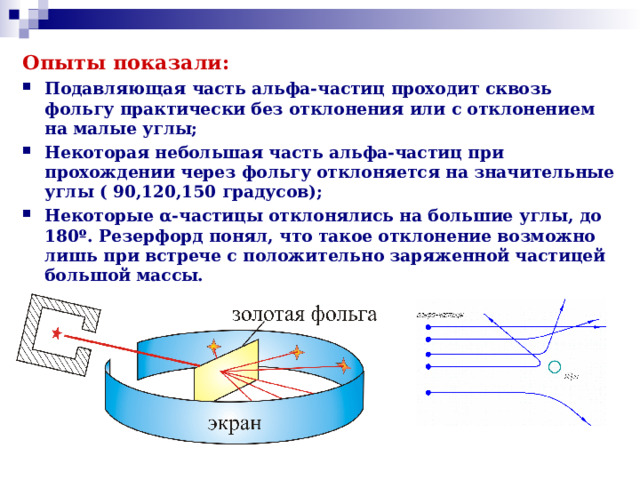
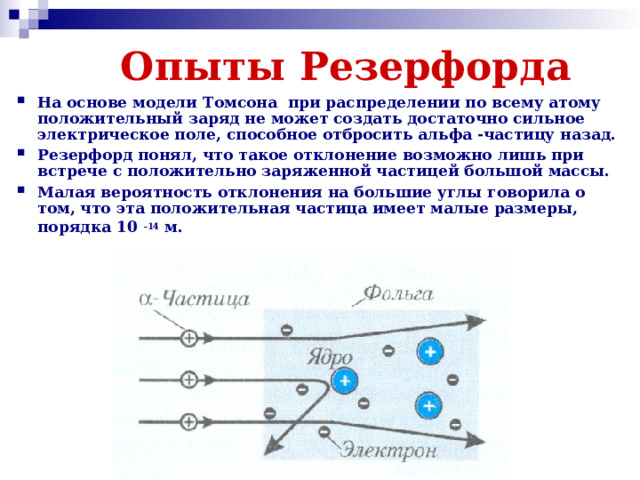
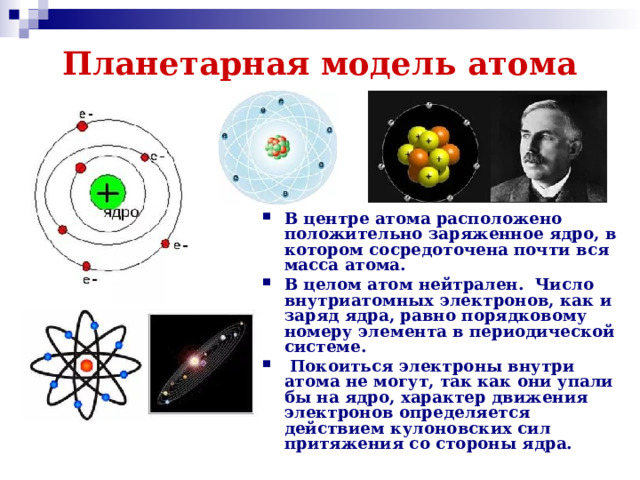
Презентация к двум урокам физики в 11 классе (углубленный уровень) по темам: "Доказательства сложной структуры атомов", "Строение атома. Опыты Резерфорда".
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
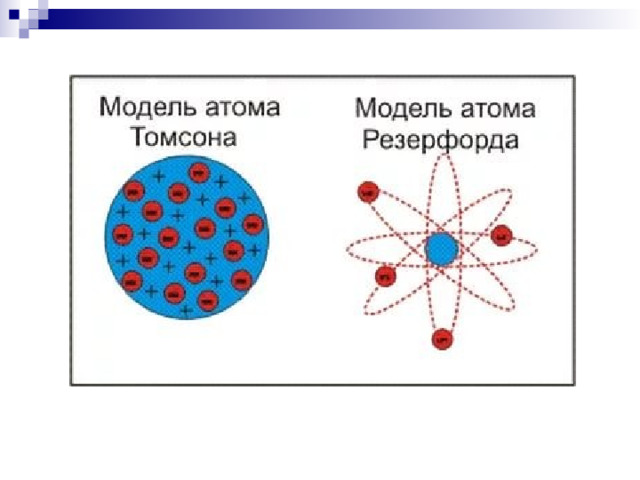
Физика 11 класс "Доказательства сложной структуры атомов. Строение атома. Опыты Резерфорда"
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Физика 11 класс "Доказательства сложной структуры атомов. Строение атома. Опыты Резерфорда"»
Полезное для учителя
Распродажа видеоуроков!
2320 руб.
3320 руб.
2040 руб.
2920 руб.
1950 руб.
2780 руб.
1970 руб.
2820 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства