Презентация на тему:Урок-исследование уравнения Менделеева-Клапейрона.В данной презентации полностью раскрыт принцип уравнения Менделеева-Клапейрона.После презентации,все ученики поняли эту тему.В презентации взяты задачи из дополнительных учебников.Презентация для 10 классов.Презентация была проведена в городе Атырау(Казахстан)
Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Презентация на тему:Урок-исследование уравнения Менделеева-Клапейрона
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Презентация на тему:Урок-исследование уравнения Менделеева-Клапейрона »
Полезное для учителя
Распродажа видеоуроков!
1670 руб.
2780 руб.
1570 руб.
2620 руб.
1690 руб.
2820 руб.
1670 руб.
2780 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства





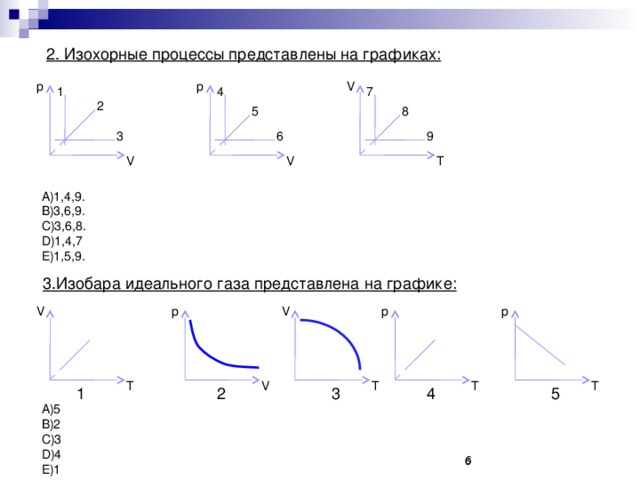


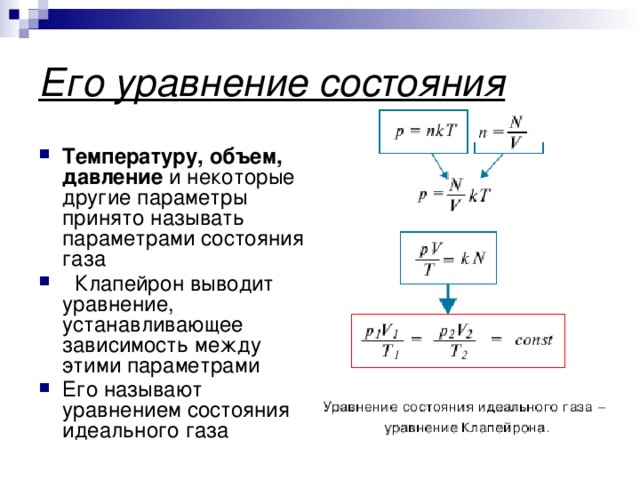

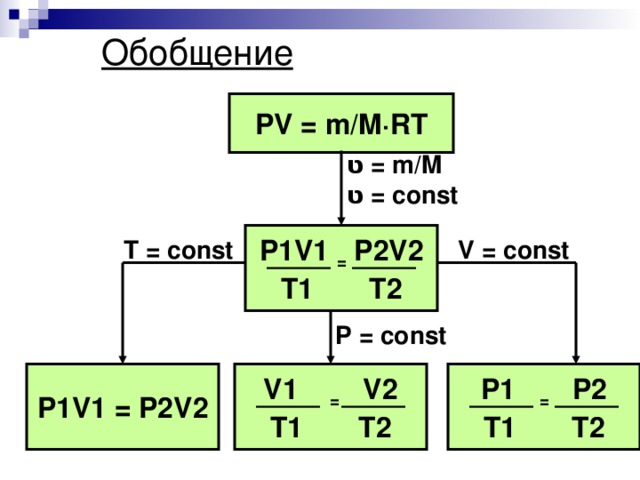
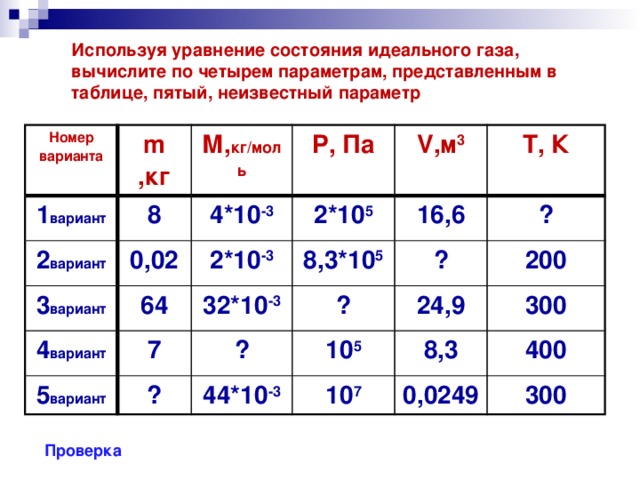
![Уравнение Менделеева-Клапейрона m=const PV m =const PV= RT T M Уравнение Клапейрона Основные термодинамические параметры P 2 V 2 P 1 V 1 = Т [К, кельвин] – термодинамическая температура T 2 T 1 V [м 3 , кубический метр] - объём p [Па, паскаль] - давление](https://fsd.kopilkaurokov.ru/uploads/user_file_5482b946bb39a/img_user_file_5482b946bb39a_10.jpg)