Создайте Ваш сайт учителя Видеоуроки Олимпиады Вебинары для учителей
Итоговый урок по теме : "Изменение агрегатных состояний вещества" - Путешествие по стране калория.
Данный урок является последним в теме "Изменение агрегатных состояний вещества". На предыдущих занятиях учащиеся изучали различные агрегатные состояния вещества, тепловые явления и процессы.
На этом уроке они должны:
• Вспомнить основные формулы для тепловых процессов.
• Решить расчётные и качественные задачи на тепловые явления.
А девиз урока таков:
Незнающие пусть научаться, а знающие вспомнят еще раз.
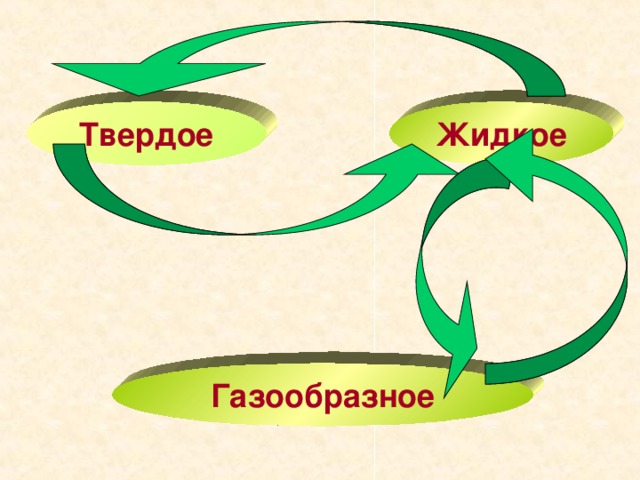
В природе изменение агрегатных состояний происходит в широких масштабах. С поверхности океанов, морей, озер и рек испаряется вода, а при охлаждении водяного пара образуются облака, роса, туман и снег. Реки и озера зимой замерзают, а весной снег и лед тают.
Для понимания этих процессов и для того, чтобы управлять многими из них, учащиеся должны знать, когда, при каких условиях вещество находится в том или ином агрегатном состоянии, каковы свойства каждого из этих состояний и что нужно для превращения вещества из одного состояния в другое.
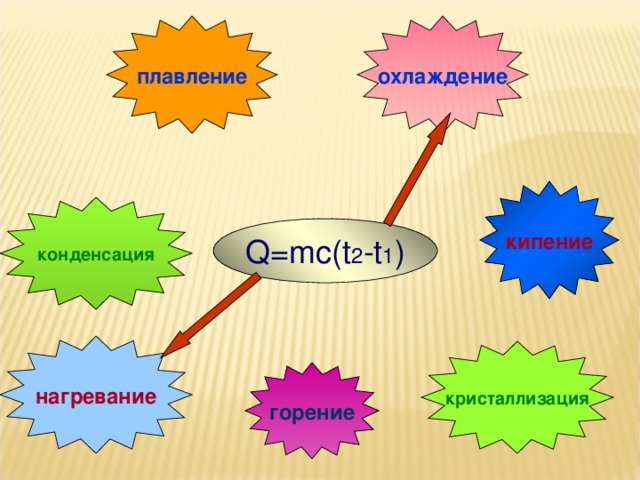
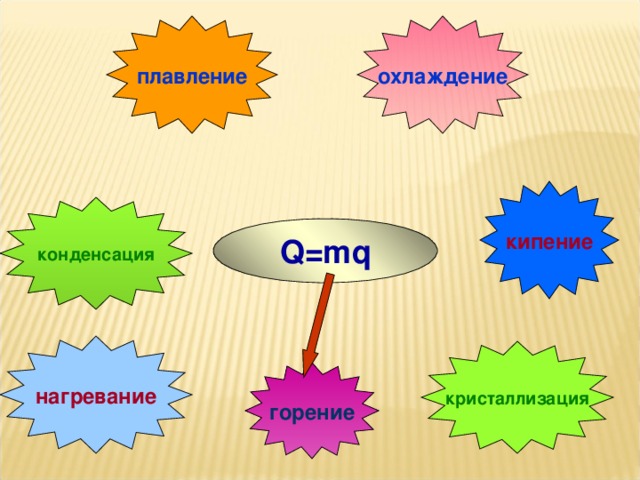
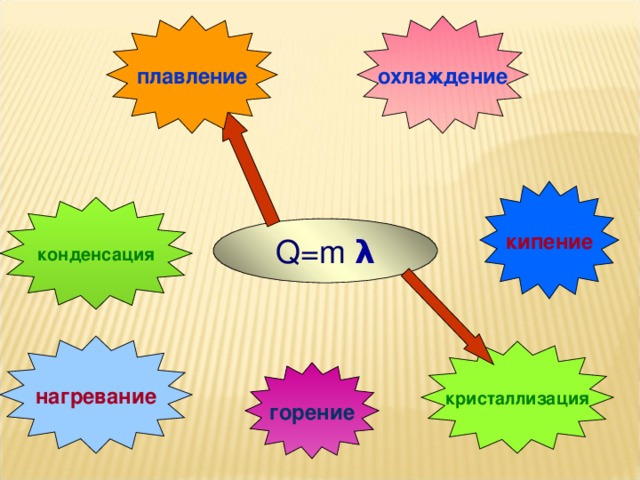
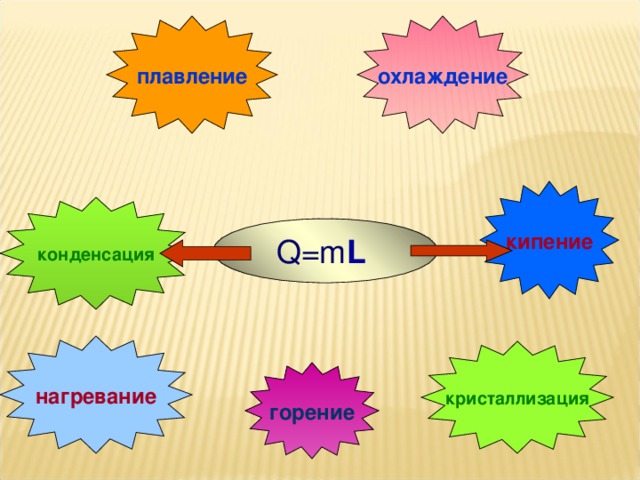
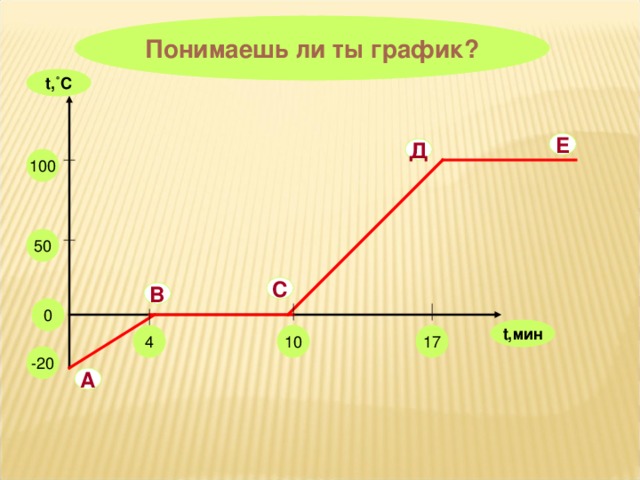
На уроке повторяются основные понятия, формулы для расчета количества теплоты, графики тепловых процессов.
Цели урока.
Образовательная:
• повторить основные формулы раздела «Тепловые явления» с помощью решения задач;
• закрепить знания, умения, навыки, полученные при изучении раздела «Тепловые явления»;
• обеспечить усвоение формул расчёта количества теплоты для различных тепловых процессов;
• научить ребят пользоваться таблицами и формировать у них умение осуществлять самоконтроль с помощью конкретных вопросов и использования дидактического материала.
Развивающая:
• совершенствовать навыки самостоятельной работы, активизировать мышление школьников, умение самостоятельно формулировать выводы, развивать речь;
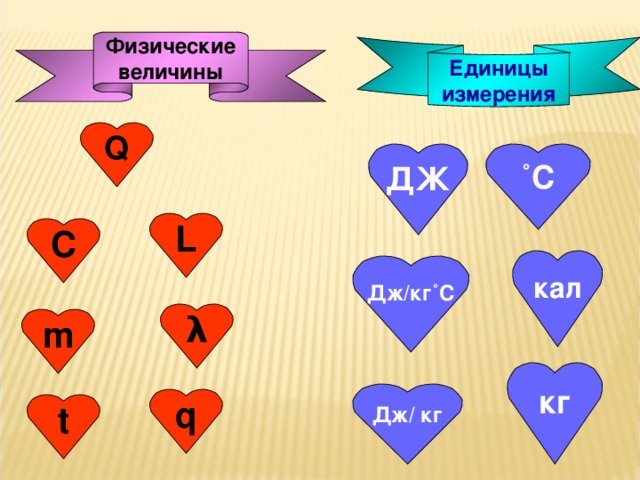
• тренировка в переводе значения массы, количества теплоты из дополнительных единиц измерения в основные.
Воспитательная:
• развитие познавательного интереса к предмету,
• тренировка рационального метода запоминания формул,
• развитие чувства взаимопонимания и взаимопомощи в процессе совместного решения задач.
Задачи урока.
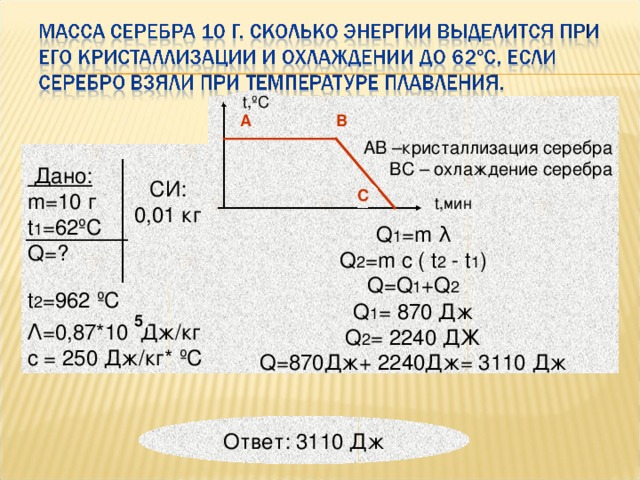
• Уметь решать расчётные задачи;
• Научиться формулировать чёткие ответы на качественные задачи;
• Уметь пользоваться формулами;
• Отрабатывать навыки перевода значения массы, количества теплоты из дополнительных единиц измерения в основные;
• Отрабатывать навыки соотношения полученных результатов с реальными значениями;
• Уметь пользоваться таблицами:
а) удельная теплоёмкость вещества;
б) температура плавления и кристаллизации;
в) удельная теплота плавления;
г) удельная теплота парообразования.
• Уметь, используя жизненный опыт, распознавать основные тепловые явления.
План урока.
1. Организационный момент.
2. Переходный момент.
3. Фронтальная работа.
4. Решение качественных задач.
5. Решение расчётных задач.
6. Самостоятельная работа.
7. Домашнее задание.
8. Задания на рефлексию.
9. Подведение итогов.
10. Резерв. (Коллекция интересных фактов).
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Итоговый урок по теме : "Изменение агрегатных состояний вещества" - Путешествие по стране калория. »
Полезное для учителя
Распродажа видеоуроков!
1880 руб.
2690 руб.
1950 руб.
2780 руб.
2040 руб.
2920 руб.
1770 руб.
2530 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Проверка свидетельства