Организационный этап | Приветствие. Разделить класс на 4 группы, используя технологию «Атомы и молекулы»:
Атомы и молекулы Участники группы разбредаются по классу. Учитель произносит: «Каждый из вас — одинокий атом, блуждающий в пространстве. Вы встречаетесь с другими атомами, иногда даже случаются легкие столкновения. Но иногда вы получаете возможность объединиться в молекулы. Вы будете делать это по моей команде. Число атомов в молекуле я назову». Через некоторое время учитель хлопает в ладоши и произносит, например: «Четыре». Учащиеся быстро составляют группы по четыре человека. Те, кто не успел войти ни в одну «молекулу» (скажем, игроков осталось трое), выбывают из игры. «Молекулы» снова распадаются на атомы, продолжающие блуждать в пространстве до следующей команды учителя. В результате можно либо создать две команды (из тех, кто выбыл, и из тех, кто остался в игре), либо в определенный момент дать команду собраться в молекулы с таким числом атомов, какое нужно для дальнейших процедур (хорошо, если это число будет равно количеству выбывших участников, которые тогда смогут образовать свою группу).
Проверка домашнего задания.
1. Как доказать, что все вещества состоят из частиц? 2. В чем заключается предположение о строении вещества? 3. Почему не видны частицы, из которых состоит вещество? 4. Как объяснить высыхание белья после стирки? 5. Почему твердые тела, состоящие из частиц, кажутся сплошными? Назвать тему, цели урока, критерии оценивания. | Выполняют необходимые действия. Демонстрируют готовность к учебной деятельности |
| Диалогическое обучение Саморегулируемое обучение Критическое мышление |
Изучение нового материала | Учитель: «Люди давно догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют атомами. В подавляющем большинстве случаев атомы не существуют по одиночке, а объединяются в группы - молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике.По сравнению с многообразием веществ число атомов весьма ограничено. Атомы могут различным образом соединяться друг с другом. Как из букв алфавита можно составить сотни тысяч слов, так из одних и тех же атомов образуются молекулы или кристаллы огромного количества различных веществ, из которых состоит окружающий мир.Молекула - это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию. Молекулы построены из атомов».Простое вещество состоит из атомов только одного вида или из молекул, построенных из атомов одного вида.Сложное вещество состоит из молекул, построенных из атомов разных видов.Все вещества в разных условиях могут быть подразделены на три состояния: твердое, жидкое и газообразное. Чтобы убедиться в этом, приведите пример различных состояний тел и выполните задание, представленное на рисунке 1. 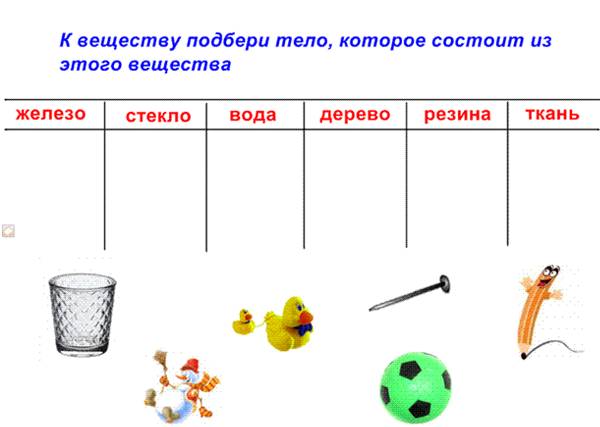 Рис. 1. Из каких веществ могут состоять твердые вещества.Всякое вещество состоит из молекул или атомов в различных энергетических состояниях.Молекула какого-либо вещества — это самая мелкая частица вещества, существующая в обычных условиях и при этом сохраняющая все признаки этого вещества. На рисунке 2 можно увидеть молекулу вещества. 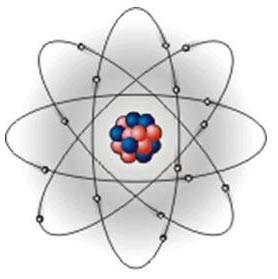 Рис. 2. Молекула веществаСредняя цифра для размера t молекулы— порядка 1х10-9 м. Весьма трудно наблюдать размеры настолько малые, как 10-9 м. Это означает, что одна тысяча миллионов молекул, помещенных рядом, растянется вдоль однометровой линейки. Тысячу миллионов также почти невозможно пред¬ставить.Молекула может состоять из группы еще более малых частиц, назы-ваемых атомами. Например, молекула водорода (газа) состоит из двух ато¬мов водорода, соединенных между собой (рисунок 3). 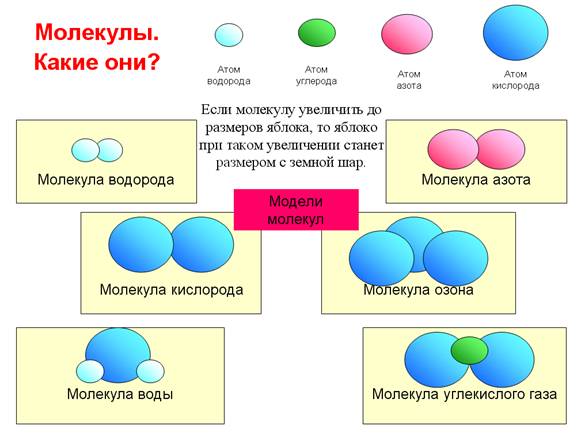 Рис. 3. Молекулы водорода, кислорода, воды, азота, озона и углекислого газа. На видео представлена динамика молекул воды, аммиака, метана и т.д.:Молекулы могут состоять из одного атома, как в инертном газе аргоне, из двух одинаковых атомов, соединенных вместе, как в случае с газом кислородом, или же из малой группы атомов, соединенных между собой, как в случае с водой, молекула которой состоит из одного атома кислорода и двух атомов водорода. Очень большие группы атомов тоже могут соединяться друг с другом, образуя полимеры, и т. д.Кроме того, молекулы любого вещества постоянно двигаются, причем делают это по-разному. Пример движения молекул можно увидеть на рисунке 4. 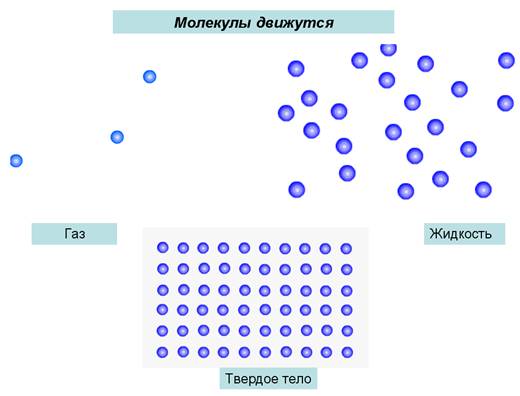 Рис. 4. Движение молекул.Молекулы невозможно увидеть невооруженным глазом. Они настолько малы, что их нельзя разглядеть даже с помощью микроскопа, дающего 1000-кратное увеличение. Биологам известны микроорганизмы (например, бактерии) размером 0,001 мм. Молекулы же в сотни и тысячи раз меньше. Для определения размеров молекул были проведены разные опыты. Опишем один из них:В чисто вымытый большой сосуд налили воду и на ее поверхность поместили каплю масла. Масло начало растекаться по поверхности воды, образуя пленку. По мере растекания масла толщина пленки становилась все меньше и меньше. Через некоторое время растекание прекратилось. Если предположить, что это произошло из-за того, что все молекулы масла оказались на поверхности воды, то для определения диаметра молекулы достаточно найти толщину образовавшейся пленки.Толщина пленки равна отношению ее объема V к площади S: h=V/S.Объем пленки - это объем той капли, которую поместили на поверхность воды. Его измеряют заранее; для этого пользуются измерительным цилиндром - мензуркой. В описываемом опыте капля имела объем V = 0,0009 см3, а площадь образовавшейся из нее пленки была равна S = 5500 см2. Подставив эти значения в формулу, получим h = 0,00000016 см. Этим числом и выражается примерный размер молекулы масла. На рисунке 5 представлен примерный размер молекулы.  Рис. 5. Примерный размер молекулы. Молекулы одного и того же вещества одинаковы во всех агрегатных состояниях (рисунок 6).  Рис. 6. Молекула воды в различных агрегатных состояниях вещества.Атомы Хотя молекулы и очень маленькие частицы, но и они делимы. Частицы, из которых состоят молекулы, называют атомами. Атомы каждого вида принято обозначать специальными символами. Например, атом кислорода - О, атом водорода - Н, атом углерода - С.Атомы очень малы. Их невозможно разглядеть не только простым глазом, но и с помощью даже самого мощного оптического микроскопа.Глаз человека не способен разглядеть атомы и промежутки между ними, поэтому любое вещество кажется нам сплошным. В 1951 году Эрвин Мюллер изобрёл ионный микроскоп, позволивший в деталях разглядеть атомную структуру металла. Современная же техника позволяет получить фотографии отдельных атомов и молекул. На рисунке 7 приведен снимок атома гелия. 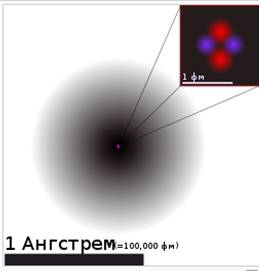 Рис. 7. Атом гелия. Сами атомы по современным представлениям состоят из трех основных частиц: протонов, нейтронов и электронов. Модель атома можно представить следующим образом: в маленькой сердцевине атома находится ядро, в котором ядерными силами удерживаются протоны и нейтроны; вокруг ядра по своим орбитам вращаются электроны, похожие на планеты, обращающиеся вокруг Солнца. Атомы различных химических элементов отличаются друг от друга. Различия атомов химических элементов можно определить по периодической таблице Менделеева. Давайте посмотрим на видео, с помощью которого постараемся разобраться в структуре атома:Выводы 1. Все вещества в разных условиях могут быть подразделены на три состояния: твердое, жидкое и газообразное. 2. Всякое вещество состоит из молекул или атомов в различных энер-гетических состояниях. 3. Молекула какого-либо вещества — это самая мелкая частица ве-щества, существующая в обычных условиях и при этом сохраняющая все признаки этого вещества. 4. Молекулы одного и того же вещества одинаковы во всех агрегатных состояниях. 5. Частицы, из которых состоят молекулы, называют атомами. Атомы каждого вида принято обозначать специальными символами.
Задание №1: Приложение 2: 1 (а)На рисунке представлены атомы, молекулы, простые и сложные вещества. Определите их. Атом | Молекула | Простое вещество | Сложное вещество |
|
|
|
| Дескрипторы: 1.Учащийся правильно записывает в таблицу номера картинок, изображающих атомы. 2. Учащийся правильно записывает в таблицу номера картинок, изображающих молекулы. 3. Учащийся правильно записывает в таблицу номера картинок, изображающих простые вещества. 4. Учащийся правильно записывает в таблицу номера картинок, изображающих сложные вещества.1(b)В таблицы приведены высказывания. Определите, какие из них «истина», а какие высказывания «ложь» (ответы отметьте галочкой в соответствующем столбце) Задание №2Раздать учащимся коробочки со спичками, пластилин (на 2 человека). Разделить на 4 группы (по желанию учащихся). Предложить создать модели атомов, молекул, простых веществ, сложных веществ. Учащиеся представляют свои работы друг другу по очереди.
| В группах выполняют лабораторную работу по инструкции; заполняют таблицу результатов; делают соответствующие выводы и записи в тетрадь; оценивают участие каждого в работе группы .
| Словесная оценка учителя . Взаимооценивание Стратегия«Стикер | Критическое мышление. Саморегулируемое обучение (самонаправленность в процессе работы над заданиями). |























