Тема урока : Систематизация и обобщение знаний по теме «Химическая связь. Строение вещества». (стр. флипчарта 1 скрыть / показать)
Цель: обобщить и систематизировать знания учащихся о видах химической связи, о типах кристаллических решеток с точки зрения строения атома, о степени окисления, о составлении окислительно-восстановительных реакций методом электронного баланса.
(стр. флипчарта 2 скрыть / показать)
Задачи:
- Образовательные:
1) актуализировать знания учащихся о различных типах химической связи;
2) повторить схемы образования веществ с разным типом связи;
3) продолжить формирование умения записывать их на примерах;
4) сравнить разные типы связи.
- Развивающие: продолжить формирование идеи познаваемости мира, развитие умений сравнивать, обобщать, делать выводы.
- Воспитательные: продолжить формирование умений работать в парах, аккуратно вести записи в тетради
Тип урока: обобщение и систематизация знаний.
Оборудование: Интерактивная доска, презентация, флипчарт, тестирующие устройства.
Методы: словесные (беседа), наглядные (демонстрация).
Ход урока
I. Организационный момент.
Готовность к уроку. Тема урока, девиз.
Девиз урока: (стр. флипчарта 3 скрыть / показать)
“В твоих знаниях, твоя сила. На нашем уроке, друзья, инертным газом быть нельзя!”
II. Актуализация знаний.
На уроке мы обобщим и закрепим имеющиеся знания по теме “химическая связь. Строение вещества ”.
Сегодня на уроке:
• Вы вспомните: что такое степень окисления химических элементов, какие виды кристаллических решеток существуют.
В ходе урока:
• Вы составите электронные и структурные формулы соединений, определите виды химической связи в соединениях.
• Вы закрепите полученные знания на практике
• Вы получите много полезной научной информации !
• Вы приятно удивитесь: оказывается вы многое знаете!
Путешествовать по удивительной стране мы будем с вами согласно индивидуальному маршрутному листу ( стр. флипчарта 4 «маршрутная карта»; флипчарт – видео, перемещение по странице, скрыть / показать), но вот небольшое недоразумение билеты в этой стране продаются только после того, как выполнишь верно задание и всего лишь до следующей станции.
Итак, вперед друзья! Счастливого пути!
III. «Сказочная»
1) Послушайте вопрос-сказку:
Мы с вами побываем в одной удивительной стране. Коренные жители этой страны назывались… Впрочем, догадайтесь сами по характеру ее жителей. Народ в этой стране был беден, но беспечен. Хотя в карманах у большинства из них не было ни донной свободной монеты (а валюта в стране называлась электронами), никто не горевал по этому поводу. Напротив, если у них заводился хоть один лишний электрончик, то характер их портился, они становились агрессивными и даже опасными, потому скорее хотели от него избавиться, чтобы стать добрыми и веселыми. Надо сказать, что высшая знать этой страны отличалась от простых граждан своей скупостью. Свою электронную валюту они неохотно одалживали, и наоборот, при малейшей возможности стремились забрать ее…
1. Кто были жители этой страны?
металлы и неметаллы.
2. Дайте определения.
3. Где в таблице Менделеева располагаются металлы и неметаллы?
1 станция «Тестирование» ( работа с тестирующим устройством стр. флипчарта 5 )
2 станция «Сортировачная» (Контейнер стр. флипчарта 6)
Задание 1 Определите тип химической связи в веществах:
NO, HF, NaF, O2, CO2. Al, Cl2. FeCl2, NaCl, KBr, CaO, CH4, Fe, NH3, H2, Na, J2,
Задание 2 Определите вид химической связи: (фронтальная работа, стр. флипчарта7)
NH3, P2O5, MgS, F2, NaCl, Al2O3
3 cтанция “ Химические связи ”. дифференцированные задания (таймер с обратным отсчетом стр. флипчарта 8)
Задание 1. Проверь свои знания. Какие утверждения верны. ( на оценку «3») (скрыть/ показать , стр. флипчарта 8 )
1. В молекулах соединений: НСl, NH3 связь ковалентная полярная. +
2. В молекулах соединений: Сl2, H2связь ковалентная неполярная. +
3. В молекулах соединений Br2, O2 связь ковалентная полярная. -
4. В молекулах соединений СO2, N2O связь ковалентная неполярная-
5. Наиболее электроотрицательный элемент O. -
6. В ходе образования химической связи общая электронная пара смещается в сторону наиболее электроотрицательного элемента. +
7. У металлов электроотрицательность > 2. -
8. Наименьшей электроотрицательностью обладает атом Fr. +
9. В молекуле азота тройная связь +
10. Электроотрицательность элементов возрастает по периоду с увеличением заряда ядра+
Задание 2.
Определите тип кристаллической решетки и дайте определение: ( На оценку – 4)
( работа с ручкой, просмотр сквозь изображения стр. флипчарта 9)
А) В) С)
Д) Е)
NH3, P2O5, MgS, F2, NaCl, Al2O3, H2O, Br2, CO2, H2S, NaF, H2, Cu, CS2, MgO, C, KCl
Задание 2. Составить молекулярную, электронную и графическую формулы молекулы хлора, хлорида калия, бромоводорода (на оценку «5») ( работа с ручкой стр. флипчарта 10)
4. Станция “Игровая”.
Задание 1
- Выбери лишний элемент, объясни: (скрыть / показать, стр. флипчарта 11)
а) Na, K, Li, С
в) H2O, O2, F2, Сl2
б) Mg, С, N, F
г) НCl, HBr, HI, N2
д) H2O, Br2, CO2, MgO
е) H2S, NaF, Cu, CS2, KCl
Задание 2
Крестики- нолики (работа с ручкой, стр. флипчарта 12)
Выигрышный путь составляет ков. неполярная связь
Ca
N2
H2O
CaO
O2
HBr
CaCl2
H2
ClF
5 станция «Спортивная »
Проведем физминутку. (функция прожектор стр. флипчарта 13)
Работа по интерактивной доске: если соединение с ковалентной полярной связью, поднимаем левую руку, если соединение с ковалентной неполярной связью поднимаем правую руку. Если металл поднимаем две руки вверх, если неметалл – хлопаем 1- 2 мин.
6 станция «Станция химическая» ( работа с ручкой, встроенная презентация, стр. флипчарта 14 )
Задание 1
1.Определите степени окисления в соединениях:
K2О HClO
AlH3 H2SO4
CaF2 HNO3
Задание2: Какая реакция является окислительно-восстановительной?
H2SO4 +Na2O —> Na2SO4 + H2O
SO3 + H2O —> H2SO4
2SO2 + O2 —> 2SO3
Н2S + O2 —> H2O + S
Задание 3: Определите в каком веществе степень окисления серы равна +4:
H2SO4 , SO3, SO2, H2SO3
______________
Задание 4: Какой коэффициент перед формулой окислителя?
Al + O2 —> Al2O3
___________________
Задание 5: Какой коэффициент перед формулой восстановителя?
P + Cl2 —> PCl3
Итак, сегодня мы с вами побывали в сказочной стране и посетили основные ее станции. Еще раз назовите в каких?
IV. Рефлексия (стр. флипчарта 17)
- Что для вас оказалось самым сложным?
- Что умели, какие знания применяли?
- Удовлетворены ли Вы своей работой на уроке?
V Домашнее задание: повторить изученные параграфы, готовиться к контрольной работе.
Просмотр содержимого документа
«Индивидуальный лист учащегося 8 класса»
Индивидуальный маршрутный лист учащегося 8 А класса:
________________________________________________________________________
Тема: Повторение по теме: « Химическая связь. Строение вещества».
Станция1: Тестирование
Тестовое задание
Станция 2: «Сортировочная»
Выпишите формулы веществ:
NO, HF, NaF, O2, CO2, Al, Cl2. FeCl 2, NaCl, KBr, CaO, CH4, Fe, NH3, H2, Na, J2,
К.Н.С. -
К.П.С. -
И.С. -
Определите вид химической связи:
NH3, P2O5, MgS, F2, NaCl, Al2O3
________________
Станция3: Химические связи ”. (3 - 5 мин)
Дифференцированные задания:
Задание 1. Проверь свои знания. Какие утверждения верны. (На оценку – 3)
“Проверь себя! Верны ли утверждения”:
В молекулах соединений: НСl, NH3 связь ковалентная полярная.
2. В молекулах соединений: Сl2, H2связь ковалентная неполярная.
3. В молекулах соединений Br2, O2 связь ковалентная полярная.
4. В молекулах соединений СO2, N2O связь ковалентная неполярная
5. Наиболее электроотрицательный элемент O2.
6. В ходе образования химической связи общая электронная пара смещается в сторону наиболее электроотрицательного элемента.
7. У металлов электроотрицательность 2.
8. Наименьшей электроотрицательностью обладает атом Fr.
9. В молекуле азота тройная связь
10. Электроотрицательность элементов возрастает по периоду с увеличением заряда ядра
Задание 2.
Определите тип кристаллической решетки и дайте определение: ( На оценку – 4)
А) 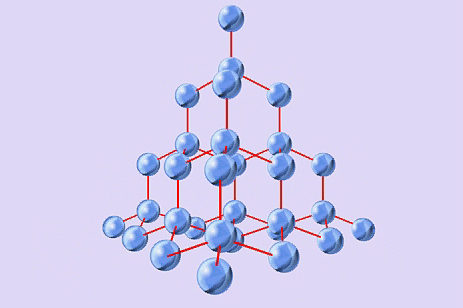 В)
В) С)
С) 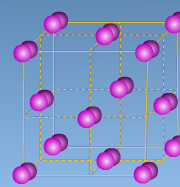
Д)  Е)
Е) 
NH3, P2O5, MgS, F2, NaCl, Al2O3, H2O, Br2, CO2, H2S, NaF, H2, Cu, CS2, MgO, C, KCl
Задание 3.
Составить молекулярную, электронную и графическую формулы молекулы хлора, хлорида калия, бромоводорода. (На оценку – 5)
_________________
Станция 4: “Игровая”
Выбери лишний элемент, объясни:
а) Na, K, Li, С
в) H2O, O2, F2, Сl2
б) Mg, С, N, F
г) НCl, HBr, HI, N2
д) H2O, Br2, CO2, MgO
е) H2S, NaF, Cu, CS2, KCl ____________
2. Крестики- нолики
Выигрышный путь составляет ков. неполярная связь
Ca
N2
H2O
O2 HBr
CaCl2
H2
ClF
________________
Станция 5: «Спортивная »
Физкультминутка.
Ковал. полярн – левая рука
Ковал. неполярная – правая рука
Металл – руки вверх
Неметалл - хлопок
________
Станция 6: «Химическая» (5 минут)
Задание 1: Определите степени окисления в соединениях:
K2О HClO
AlH3 H2SO4
CaF2 HNO3
_________________________
Задание2: Какая реакция является окислительно-восстановительной?
H2SO4 +Na2O — Na2SO4 + H2O
SO3 + H2O — H2SO4
2SO2 + O2 — 2SO3
Н2S + O2 — H2O + S
____________
Задание 3: Определите в каком веществе степень окисления серы равна +4:
H2SO4 , SO3, SO2, H2SO3
____________
______________
Задание 4: Какой коэффициент перед формулой окислителя?
Al + O2 — Al2O3
____________
___________________
Задание 5: Какой коэффициент перед формулой восстановителя?
P + Cl2 — PCl3
_______________
____________
Просмотр содержимого документа
«Обобщение и систем знан. 8 класс»
Тема: Систематизация и обобщение знаний по теме «Химическая связь. Строение вещества». (стр. флипчарта 1 скрыть / показать)
Цель: обобщить и систематизировать знания учащихся о видах химической связи, о типах кристаллических решеток с точки зрения строения атома, о степени окисления, о составлении окислительно-восстановительных реакций методом электронного баланса.
(стр. флипчарта 2 скрыть / показать)
Задачи:
- Образовательные:
1) актуализировать знания учащихся о различных типах химической связи;
2) повторить схемы образования веществ с разным типом связи;
3) продолжить формирование умения записывать их на примерах;
4) сравнить разные типы связи.
- Развивающие: продолжить формирование идеи познаваемости мира, развитие умений сравнивать, обобщать, делать выводы.
- Воспитательные: продолжить формирование умений работать в парах, аккуратно вести записи в тетради
Тип урока: обобщение и систематизация знаний.
Оборудование: Интерактивная доска, презентация, флипчарт, тестирующие устройства.
Методы: словесные (беседа), наглядные (демонстрация).
Ход урока
I. Организационный момент.
Готовность к уроку. Тема урока, девиз.
Девиз урока: (стр. флипчарта 3 скрыть / показать)
“В твоих знаниях, твоя сила. На нашем уроке, друзья, инертным газом быть нельзя!”
II. Актуализация знаний.
На уроке мы обобщим и закрепим имеющиеся знания по теме “химическая связь. Строение вещества ”.
Сегодня на уроке:
• Вы вспомните: что такое степень окисления химических элементов, какие виды кристаллических решеток существуют.
В ходе урока:
• Вы составите электронные и структурные формулы соединений, определите виды химической связи в соединениях.
• Вы закрепите полученные знания на практике
• Вы получите много полезной научной информации !
• Вы приятно удивитесь: оказывается вы многое знаете!
Путешествовать по удивительной стране мы будем с вами согласно индивидуальному маршрутному листу ( стр. флипчарта 4 «маршрутная карта»; флипчарт – видео, перемещение по странице, скрыть / показать), но вот небольшое недоразумение билеты в этой стране продаются только после того, как выполнишь верно задание и всего лишь до следующей станции.
Итак, вперед друзья! Счастливого пути!
III. «Сказочная»
1) Послушайте вопрос-сказку:
Мы с вами побываем в одной удивительной стране. Коренные жители этой страны назывались… Впрочем, догадайтесь сами по характеру ее жителей. Народ в этой стране был беден, но беспечен. Хотя в карманах у большинства из них не было ни донной свободной монеты (а валюта в стране называлась электронами), никто не горевал по этому поводу. Напротив, если у них заводился хоть один лишний электрончик, то характер их портился, они становились агрессивными и даже опасными, потому скорее хотели от него избавиться, чтобы стать добрыми и веселыми. Надо сказать, что высшая знать этой страны отличалась от простых граждан своей скупостью. Свою электронную валюту они неохотно одалживали, и наоборот, при малейшей возможности стремились забрать ее…
1. Кто были жители этой страны?
металлы и неметаллы.
2. Дайте определения.
3. Где в таблице Менделеева располагаются металлы и неметаллы?
1 станция «Тестирование» ( работа с тестирующим устройством стр. флипчарта 5 )
2 станция «Сортировачная» (Контейнер стр. флипчарта 6)
Задание 1 Определите тип химической связи в веществах:
NO, HF, NaF, O2, CO2. Al, Cl2. FeCl2, NaCl, KBr, CaO, CH4, Fe, NH3, H2, Na, J2,
Задание 2 Определите вид химической связи: (фронтальная работа, стр. флипчарта7)
NH3, P2O5, MgS, F2, NaCl, Al2O3
3 cтанция “ Химические связи ”. дифференцированные задания (таймер с обратным отсчетом стр. флипчарта 8)
Задание 1. Проверь свои знания. Какие утверждения верны. ( на оценку «3») (скрыть/ показать , стр. флипчарта 8 )
1. В молекулах соединений: НСl, NH3 связь ковалентная полярная. +
2. В молекулах соединений: Сl2, H2связь ковалентная неполярная. +
3. В молекулах соединений Br2, O2 связь ковалентная полярная. -
4. В молекулах соединений СO2, N2O связь ковалентная неполярная-
5. Наиболее электроотрицательный элемент O. -
6. В ходе образования химической связи общая электронная пара смещается в сторону наиболее электроотрицательного элемента. +
7. У металлов электроотрицательность 2. -
8. Наименьшей электроотрицательностью обладает атом Fr. +
9. В молекуле азота тройная связь +
10. Электроотрицательность элементов возрастает по периоду с увеличением заряда ядра+
Задание 2.
Определите тип кристаллической решетки и дайте определение: ( На оценку – 4)
( работа с ручкой, просмотр сквозь изображения стр. флипчарта 9)
А) 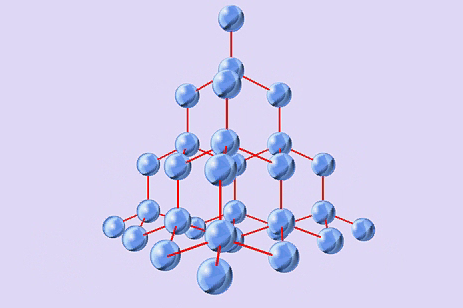 В)
В)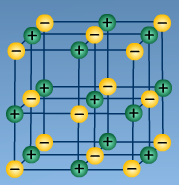 С)
С) 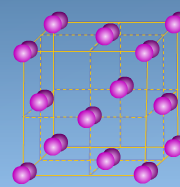
Д)  Е)
Е) 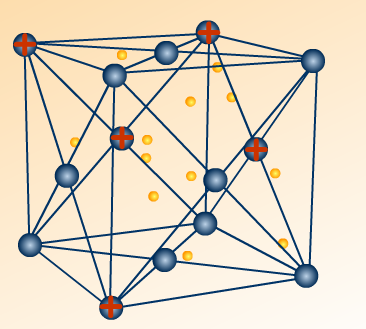
NH3, P2O5, MgS, F2, NaCl, Al2O3, H2O, Br2, CO2, H2S, NaF, H2, Cu, CS2, MgO, C, KCl
Задание 2. Составить молекулярную, электронную и графическую формулы молекулы хлора, хлорида калия, бромоводорода (на оценку «5») ( работа с ручкой стр. флипчарта 10)
4. Станция “Игровая”.
Задание 1
Выбери лишний элемент, объясни: (скрыть / показать, стр. флипчарта 11)
а) Na, K, Li, С
в) H2O, O2, F2, Сl2
б) Mg, С, N, F
г) НCl, HBr, HI, N2
д) H2O, Br2, CO2, MgO
е) H2S, NaF, Cu, CS2, KCl
Задание 2
Крестики- нолики (работа с ручкой, стр. флипчарта 12)
Выигрышный путь составляет ков. неполярная связь
Ca
N2
H2O
CaO
O2
HBr
CaCl2
H2
ClF
5 станция «Спортивная »
Проведем физминутку. (функция прожектор стр. флипчарта 13)
Работа по интерактивной доске: если соединение с ковалентной полярной связью, поднимаем левую руку, если соединение с ковалентной неполярной связью поднимаем правую руку. Если металл поднимаем две руки вверх, если неметалл – хлопаем 1- 2 мин.
6 станция «Станция химическая» ( работа с ручкой, встроенная презентация, стр. флипчарта 14 )
Задание 1
1.Определите степени окисления в соединениях:
K2О HClO
AlH3 H2SO4
CaF2 HNO3
Задание2: Какая реакция является окислительно-восстановительной?
H2SO4 +Na2O — Na2SO4 + H2O
SO3 + H2O — H2SO4
2SO2 + O2 — 2SO3
Н2S + O2 — H2O + S
Задание 3: Определите в каком веществе степень окисления серы равна +4:
H2SO4 , SO3, SO2, H2SO3
______________
Задание 4: Какой коэффициент перед формулой окислителя?
Al + O2 — Al2O3
___________________
Задание 5: Какой коэффициент перед формулой восстановителя?
P + Cl2 — PCl3
Итак, сегодня мы с вами побывали в сказочной стране и посетили основные ее станции. Еще раз назовите в каких?
IV. Рефлексия (стр. флипчарта 17)
Что для вас оказалось самым сложным?
Что умели, какие знания применяли?
Удовлетворены ли Вы своей работой на уроке?
V. Домашнее задание:
повторить параграфы , готовиться к контрольной работе.
 В)
В) С)
С) 


 В)
В) С)
С) 
 Е)
Е) 




















