Создайте Ваш сайт учителя Курсы ПК и ППК Видеоуроки Олимпиады Вебинары для учителей
Газовые законы.Изопроцессы.
Цели урока:
1. Создать условия по изучению изопроцессов термодинамических параметров, графики изопроцессов, математическая запись законов, объяснение с точки зрения МКТ.
2. Продолжить формирование стремления к глубокому усвоению знаний через решение задач.
3. Научить применять полученные знания в нестандартных ситуациях для решения задач.
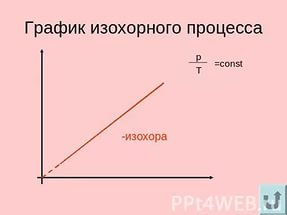
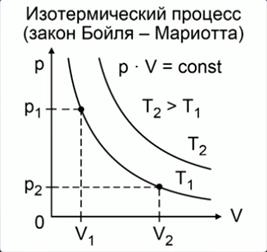
На этом уроке мы продолжим изучать связь между тремя макроскопическими параметрами газа, а конкретнее – их взаимосвязь в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных.
Вы уже знаете о суперспособностях современного учителя?
Тратить минимум сил на подготовку и проведение уроков.
Быстро и объективно проверять знания учащихся.
Сделать изучение нового материала максимально понятным.
Избавить себя от подбора заданий и их проверки после уроков.
Наладить дисциплину на своих уроках.
Получить возможность работать творчески.
Просмотр содержимого документа
«Газовые законы.Изопроцессы.»
Полезное для учителя
Распродажа видеоуроков!
1740 руб.
2180 руб.
2110 руб.
2640 руб.
2110 руб.
2640 руб.
1690 руб.
2110 руб.
Курсы ПК и ППК для учителей!
1000 руб.
4000 руб.
1000 руб.
4000 руб.
3450 руб.
13800 руб.
1000 руб.
4000 руб.
ПОЛУЧИТЕ СВИДЕТЕЛЬСТВО МГНОВЕННО
* Свидетельство о публикации выдается БЕСПЛАТНО, СРАЗУ же после добавления Вами Вашей работы на сайт
Удобный поиск материалов для учителей
Ваш личный кабинет
Проверка свидетельства

 пределение. Изобарный (или изобарический) процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении давления. Впервые такой процесс рассмотрел французский учённый Жозеф-Луи Гей-Люссак (рис. 4), поэтому закон носит его имя. Запишем этот закон
пределение. Изобарный (или изобарический) процесс – процесс перехода идеального газа из одного состояния в другое при постоянном значении давления. Впервые такой процесс рассмотрел французский учённый Жозеф-Луи Гей-Люссак (рис. 4), поэтому закон носит его имя. Запишем этот закон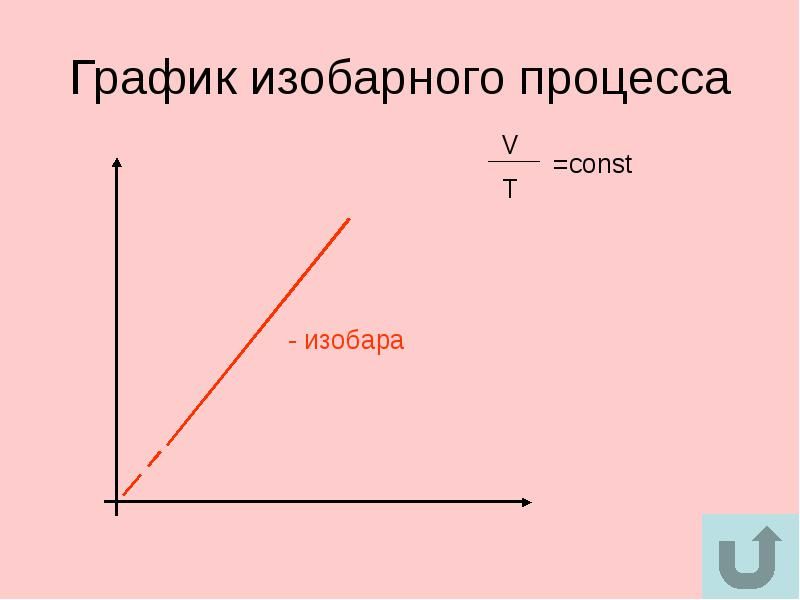 ис. 3. Графики изобарных процессов в координатах V-T (Источник)
ис. 3. Графики изобарных процессов в координатах V-T (Источник)